Preparación de NP de Ag encapsulado de silicalita-1 poroso jerárquico y su rendimiento catalítico para la reducción de 4-nitrofenol
Resumen
Se presenta una estrategia fácil y eficiente para la encapsulación de NP de Ag dentro de silicalita-1 porosa jerárquica. Las propiedades fisicoquímicas del catalizador resultante se caracterizan por TEM, XRD, FTIR y N 2 técnicas analíticas de adsorción-desorción. Resulta que los NP de Ag están bien distribuidos en el marco de zeolita MFI, que posee características porosas jerárquicas (1,75, 3,96 nm), y el área de superficie específica es tan alta como 243 m 2 · G −1 . Más importante aún, tal catalizador puede transformar rápidamente el 4-nitrofenol en 4-aminofenol en solución acuosa a temperatura ambiente, y también se obtiene una conversión cuantitativa después de ser reutilizado 10 veces. Las razones pueden atribuirse a la rápida transferencia de masa, la gran superficie y el efecto de confinamiento espacial del soporte avanzado.
Antecedentes
La estabilidad de las nanopartículas metálicas (MNP) es de gran importancia académica y práctica en los campos de la heterocatálisis porque la actividad catalítica y la selectividad están directamente relacionadas con la morfología y el tamaño de las MNP [1,2,3,4,5,6,7] . Pero es una lástima que los MNP usualmente se inclinan a agregar / lixiviar a temperaturas relativamente altas o durante el proceso de reacción, lo que lleva a una disminución notable del rendimiento catalítico [8,9,10,11]. Con este fin, se han dedicado numerosos esfuerzos a resolver el problema de estabilidad de las MNP en sistemas catalíticos heterogéneos [12,13,14,15,16,17]. Convencionalmente, los MNP estabilizados con tensioactivo se preparan principalmente y luego se recubre su superficie con una capa de materiales inorgánicos / poliméricos porosos para mejorar la estabilidad de los MNP. Por otro lado, los MNP se dispersan sobre los soportes sólidos de antemano y luego se hace crecer otro recubrimiento poroso en su superficie. Aunque estas estrategias pueden mejorar eficazmente la estabilidad de las MNP, el proceso de preparación del catalizador basado en MNP es relativamente engorroso y el tensioactivo envuelto en la superficie de MNP no favorece la exposición de los sitios activos.
Durante las últimas décadas, los catalizadores más utilizados para las reacciones químicas dependieron en gran medida de los metales preciosos soportados, como Pd, Au y Pt [18,19,20,21]. Hasta cierto punto, exhibieron un excelente rendimiento catalítico en una variedad de sistemas de reacción, pero la disponibilidad limitada, el precio caro y la estabilidad moderada de estos metales nobles han suprimido en gran medida su amplia aplicación. En contraste, las alternativas de costo extremadamente bajo y abundantes en la tierra, como los metales Co, Ni y Cu, han mostrado un gran potencial de aplicación y perspectivas de desarrollo [22,23,24,25,26,27,28]. No obstante, el comportamiento catalítico y la estabilidad de los catalizadores de metales no nobles adolecen de problemas de aglomeración y desactivación. Para abordar estos problemas, una gran cantidad de los estudios actuales se han aprovechado para encapsular diferentes tipos de MNP y mejorar su dispersión y estabilidad, pero sus procedimientos de preparación aún son excesivamente tediosos e ineficientes [29,30,31,32,33, 34,35]. Por lo tanto, es urgente desarrollar una estrategia simple y eficiente para preparar catalizadores encapsulados de MNP con buena capacidad de dispersión y estabilidad.
Con base en las razones mencionadas anteriormente, en el presente documento informamos sobre un nuevo método de un solo recipiente para la preparación ingeniosa de catalizador híbrido Ag NPs @ silicalite-1 con Ag NPs encapsuladas en las microesferas porosas jerárquicas de silicalita-1 (Ag @ HPS-1) . Vale la pena mencionar que la alta área superficial y las características porosas jerárquicas del catalizador Ag @ HPS-1 confieren una propiedad catalítica especial y estabilidad a las NP de Ag para la reducción de 4-nitrofenol en solución acuosa. Además, se puede prever que después de la introducción de otros tipos de componentes simples o bimetálicos, se encontrarán reacciones más interesantes en el futuro.
Métodos
Preparación de NP de Ag encapsulado de silicalita-1 poroso jerárquico
El catalizador de Ag NPs (Ag @ HPS-1) encapsulado en silicalita-1 poroso jerárquico se sintetizó de acuerdo con el siguiente procedimiento. En primer lugar, se añadieron 5,0 g de sílice coloidal Ludox HS-40 al 40% en peso en 20 ml de agua desionizada y se agitó durante 0,5 h. El valor del pH de la solución se ajustó a 12 añadiendo una cierta cantidad de NH 3 al 25% en peso. · H 2 O. Posteriormente, una cantidad requerida de AgNO 3 La solución se añadió gota a gota. Se continuó agitando la suspensión a 80ºC durante la noche para eliminar completamente el agua. En segundo lugar, se añadieron 2,0 g de hidróxido de tetrapropilamonio (TPAOH; 25% en peso en agua desionizada) al polvo sólido resultante, luego la mezcla se transfirió a un autoclave revestido de teflón de 25 ml para cristalización a 120 ° C durante 48 h. Finalmente, el sólido preparado se calentó a 550 ° C en aire durante 8 h para eliminar todos los componentes orgánicos posibles y luego se redujo en 5% en volumen de H 2 / Ar a 400 ° C durante 6 h. El soporte de HPS-1 se preparó utilizando el mismo procedimiento, excepto que no AgNO 3 se agregó durante el curso de reacción.
Reducción catalítica de 4-nitrofenol por Ag @ HPS-1 Catalyst
Normalmente, la mezcla de suspensión acuosa de catalizador Ag @ HPS-1 (20 ml, 0,8 g / L), 4-nitrofenol (5 ml, 3 mM) y NaBH 4 La solución acuosa (5 ml, 0,3 M) se agitó a temperatura ambiente. Después de un período de reacción, la solución superior se transfirió a una cubeta de cuarzo para la medición de espectroscopía ultravioleta visible (UV-Vis). Una vez que se adquirió un espectro, la solución se transfirió inmediatamente de nuevo al recipiente de reacción y se continuó agitando para la reacción de reducción secuencial hasta que el amarillo brillante se volvió gradualmente incoloro. Para estudiar la reciclabilidad del catalizador, el catalizador se separó por centrifugación después de que se completó cada reacción. Posteriormente, el catalizador se lavó tres veces con agua desionizada y etanol y se usó para el reciclaje posterior en las mismas condiciones de reacción.
Caracterización de propiedades fisicoquímicas y catalíticas
El microscopio electrónico de transmisión (TEM) se llevó a cabo en un Tecnai G2F30 utilizando un voltaje de aceleración de 200 kV. Las muestras se obtuvieron colocando una gota de solución coloide en una microrejilla y se evaporaron al aire bajo irradiación de luz infrarroja. Las mediciones de XRD se realizaron en un difractómetro Rigaku D / max-2400 utilizando radiación Cu-Kα como fuente de rayos X en el rango 2θ de 10 o –90 o . El N 2 Las isotermas de adsorción-desorción se lograron en un analizador ASAP2020. Antes de la medición, las muestras se desgasificaron al vacío a 393 K durante 8 h. El área de superficie específica de las muestras se calculó mediante el método Brunauer-Emmet-Teller (BET), el volumen de los poros y la distribución del tamaño de los poros se calcularon aplicando el modelo de Barrett-Joyner-Halenda (BJH). Los espectros de infrarrojos por transformada de Fourier (FTIR) se obtuvieron utilizando un espectrofotómetro NEXUS 670 (rango de frecuencia de 4000 a 400 cm −1 ) con pellet de KBr. La espectroscopía ultravioleta visible se realizó con un espectrofotómetro UV-vis UV2800PC.
Resultados y discusión
El catalizador Ag @ HPS-1 altamente activo y estable se preparó de acuerdo con el grupo de Yu y con algunas modificaciones [36]. El catalizador se preparó en primer lugar mediante un sencillo método de un solo recipiente, en el que se utilizaron la sílice coloidal comercial y el nitrato de plata como precursores de especies de metal y silicalita, respectivamente. Y todas las NP de Ag obtenidas se encapsularon en las microesferas jerárquicas de silicalita-1 porosas, lo que coincidía con los resultados publicados en la literatura. Brevemente, durante la formación de un gran ensamblaje a base de sílice en medio alcalino, el Ag (NH 3 ) 2 + en la solución se unió firmemente a los agregados de sílice cargados negativamente a través del autoensamblaje electrostático para formar nanocompuestos estables. Posteriormente, la muestra producida se trató en condiciones de tratamiento hidrotermal y de alta temperatura. Se midió que la cantidad de carga de Ag en el catalizador era aproximadamente 2,96% en peso.
La morfología y el tamaño de las muestras de HPS-1 y Ag @ HPS-1 se observaron mediante microscopía electrónica de barrido y transmisión (SEM, TEM), que se muestran en las Figs. 1 y 2. Las imágenes SEM de baja resolución de las muestras de HPS-1 y Ag @ HPS-1 revelaron que el soporte de HPS-1 tiene una forma y tamaño relativamente uniformes, mientras que el catalizador Ag @ HPS-1 tiene un tamaño y no se pueden observar los NP de Ag. A partir de la imagen TEM, se puede ver claramente que los nanocristales de zeolita de silicalita tal como se prepararon tenían una forma cercana a la esférica con un tamaño de partícula promedio de alrededor de 455 nm. La imagen HRTEM de la microesfera HPS-1, con franjas reticulares claramente distinguibles y orientadas de zeolita MFI, sugirió la alta cristalinidad del nanocristal de silicalita-1 sintetizado. Además, también había una serie de pequeños agujeros desordenados en la superficie de nanocristales, revelando la característica de porosidad jerárquica (Fig. 2a-c). Curiosamente, todo el diámetro ca. Las NP de Ag de 25 nm se encapsularon in situ en Ag @ HPS-1 y reservaron la morfología de HPS-1, excepto que el tamaño de partícula se aumentó a 1,25 μm (Fig. 2d-f).

un Imagen SEM de compatibilidad con HPS-1 y b Catalizador Ag @ HPS-1

a – c Las imágenes TEM y HRTEM de HPS-1. d – f Las imágenes TEM y HRTEM del catalizador Ag @ HPS-1
El grado de cristalinidad de las muestras preparadas se determinó adicionalmente mediante difracción de rayos X en polvo (XRD). Los patrones de XRD de HPS-1 y Ag @ HPS-1 se muestran en la Fig. 3a. Como se muestra en la Fig. 3a, ambos exhibieron los picos característicos de la estructura de MFI, lo que indica la formación de silicalita-1, que son consistentes con los correspondientes resultados de TEM [37]. Además de eso, el catalizador Ag @ HPS-1 exhibió otros cuatro picos de difracción característicos a 2θ =38.1 °, 44.3 °, 64.4 ° y 77.4 °, correspondientes a (111), (200), (220) y (311 ) planos de estructura cúbica centrada en las caras (fcc) de NP de Ag [38, 39]. Los resultados de XRD que confirman que las NP de Ag metálicas se han generado con éxito después del tratamiento de reducción con 5% en volumen de H 2 / Ar a 400 ° C. Se empleó la espectroscopía FTIR para determinar los posibles grupos funcionales orgánicos de las muestras de HPS-1 y Ag @ HPS-1 preparadas. Como se muestra en la Fig. 3b, los picos relativamente débiles y anchos a 1636 y 3454 cm −1 podría asignarse a las moléculas de agua adsorbidas en la superficie, el estiramiento O – H y las vibraciones de flexión simétricas. Las bandas de absorción alrededor de 1105 y 799 cm - 1 se correspondieron con las vibraciones de estiramiento simétricas y antisimétricas de Si-O-Si para el soporte de HPS-1. En comparación con HPS-1, los picos de absorción característicos casi no cambiaron después de la encapsulación de NP de Ag dentro de la microesfera de HPS-1, lo que indica que las especies que contienen nitrógeno se han escapado de la superficie del material durante el tratamiento térmico.
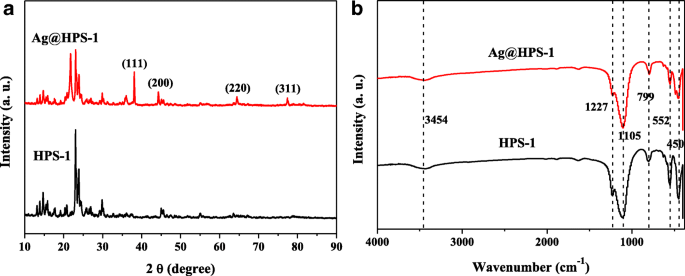
un Patrones XRD. b Espectros FTIR de las muestras de HPS-1 y Ag @ HPS-1 preparadas
N 2 Las isotermas de adsorción-desorción y las distribuciones de tamaño de poro correspondientes de HPS-1 y Ag @ HPS-1 se presentaron en la Fig. 4. Ambas dos muestras pueden clasificarse como isotermas de tipo IV y con pequeño bucle de histéresis (Tabla 1). El área de superficie específica y el volumen de poros total de HPS-1 se calcularon en 413 m 2 · G −1 , 0,394 cm 3 · G −1 , mientras que posee dos tipos de modelo de canal de 1,76 y 3,67 nm. Para el catalizador Ag @ HPS-1, se reservaron las características porosas jerárquicas (1,75, 3,96 nm), mientras que el área de superficie y el volumen total de poros se redujeron ligeramente a 243 m 2 · G −1 y 0,176 cm 3 · G −1 . Las razones de la reducción del área de superficie específica y el volumen de poros se deben presumiblemente a que las NP de Ag estaban bien incrustadas en la estructura de silicalita-1. Es bien sabido que la estructura microporosa ayudará a que los sustratos se concentren dentro de los poros y luego se reduzcan en la superficie de los NP de Ag. Además, la característica mesoporosa favorece el transporte eficiente de sustrato y producto. A partir de los resultados anteriores, se puede especular que el área de superficie alta y el poro jerárquico de Ag @ HPS-1 obviamente mejorarán la velocidad de transferencia de masa de los sustratos de reacción y la estabilidad del catalizador heterogéneo.
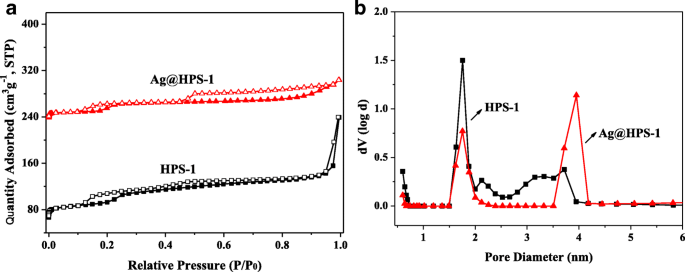
un El N 2 isotermas de adsorción-desorción y b las correspondientes curvas de distribución del tamaño de poro de HPS-1 y Ag @ HPS-1
El rendimiento catalítico del Ag @ HPS-1 casero se evaluó utilizando la reducción de 4-nitrofenol (4-NP) a 4-aminofenol (4-AP) como una reacción catalítica modelo. La Figura 5a muestra los espectros de absorción UV-vis dependientes del tiempo de la conversión de 4-NP en presencia de catalizador Ag @ HPS-1 en un sistema de reactor discontinuo. Después de agregar NaBH 4 solución en la suspensión anterior, el color de la solución cambió inmediatamente de amarillo claro a amarillo brillante debido a la producción de iones 4-nitrofenolato. La intensidad del pico de absorción característico a 400 nm asociado a los iones 4-nitrofenolato disminuyó gradualmente con el tiempo de reacción debido al consumo continuo de los mismos. Mientras tanto, surgió un nuevo pico de absorción a 300 nm asociado con el producto y aumentó sucesivamente con el tiempo. Dicha reacción podría completarse en 20 minutos a temperatura ambiente, lo que podría detectarse mediante la observación directa del color de la solución acuosa (el color cambió de amarillo brillante a incoloro). Además, un gráfico de lnA frente al tiempo permitió obtener información sobre la cinética de la reacción (Fig. 5b). Dado que la reducción se realizó en presencia de un gran exceso de NaBH 4 , la velocidad de reacción es independiente de NaBH 4 concentración y podría considerarse como un pseudo-primer orden con respecto a 4-NP. La constante de velocidad aparente ( k ) se determinó a partir de la pendiente en 4,75 × 10 −3 s −1 a 298 K, que era comparable o incluso superior a los valores informados en la literatura, como los NP de Ag desnudos (2,1 × 10 −3 s −1 ), Catalizador Ag @ HTO-PDA (3,14 × 10 −3 s −1 ), Ag NPs @ PGMA-SH (3,94 × 10 −3 s −1 ), NP de Ag compatibles con CNC / CTAB (5,76 × 10 −3 s −1 ), nanofibras de carbono / nanopartículas de plata (6,2 × 10 −3 s −1 ) y AgNP de polímero MWCNT (7,88 × 10 −3 s −1 ) [38, 40,41,42,43,44]. Los resultados demostraron que la reducción de 4-NP a 4-AP podría catalizarse eficazmente en presencia de Ag @ HPS-1catalyst.
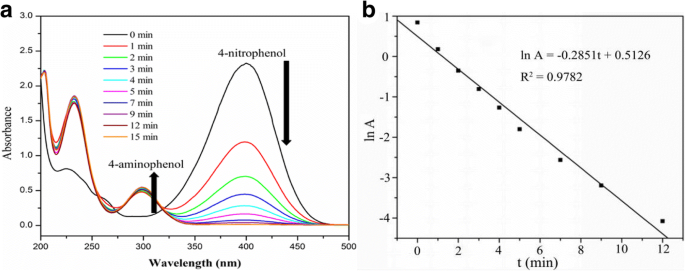
un El espectro de absorción UV-vis dependiente del tiempo y b gráfico de lnA versus tiempo para la reducción de 4-NP a 4-AP en presencia de catalizador Ag @ HPS-1
También se investigó la reciclabilidad y la estabilidad para la reducción de 4-nitrofenol sobre el catalizador Ag @ HPS-1, ya que la reutilización del catalizador heterogéneo es una de las cuestiones más importantes para las aplicaciones prácticas. Una vez completada la ejecución anterior, el catalizador se recogió de nuevo y se secó para el siguiente ciclo sin reducción de nuevo. Como se muestra en la Fig. 6, la actividad catalítica fue casi la misma que la obtenida con el catalizador recién preparado después de seis ciclos. Cabe señalar que el catalizador dio una conversión superior al 98% en 20 minutos en cada ciclo. Lo más importante es que después de la reacción catalítica, el tamaño de las NP de Ag, así como la morfología y la cristalinidad del catalizador de zeolita, permanecieron sin cambios, lo que demuestra que el catalizador de las NP de Ag encapsuladas dentro de las microesferas de HPS-1 tenía una reciclabilidad superior durante el proceso de reacción.
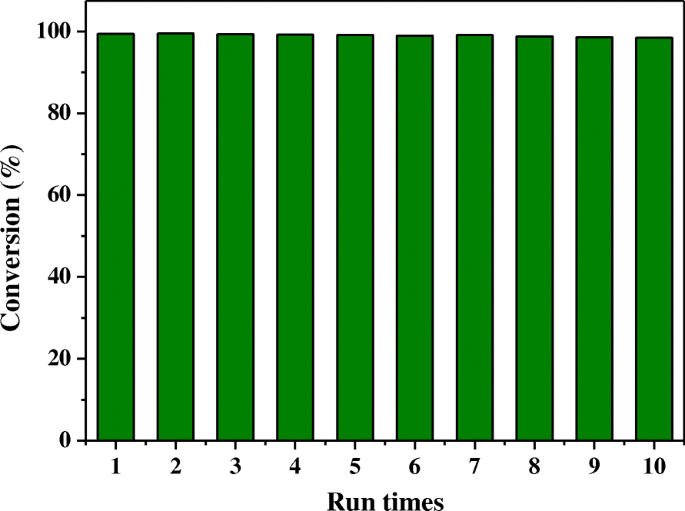
Pruebas de reciclaje para la reducción de 4-nitrofenol sobre el catalizador Ag @ HPS-1
Conclusiones
En conclusión, se ha desarrollado con éxito una estrategia de encapsulación fácil e in situ para sintetizar NP de Ag uniformes incrustadas dentro de la zeolita porosa jerárquica utilizando sílice coloidal y nitrato de plata como precursor de silicalita y especies activas de metales. El catalizador tal como se preparó mostró una estabilidad térmica superior, de reutilización, así como una excelente actividad catalítica para la reducción de 4-nitrofenol debido al confinamiento de NP de Ag dentro de la matriz de zeolita, área superficial alta y características porosas jerárquicas. Además, el presente catalizador basado en Ag podría recuperarse fácilmente de la mezcla de reacción y sin ninguna pérdida significativa de su actividad incluso después de 10 ciclos. También se puede imaginar que después de introducir otros tipos de componentes simples o bimetálicos, se encontrarán reacciones más interesantes en el futuro.
Abreviaturas
- 4-AP:
-
4-aminofenol
- 4-NP:
-
4-nitrofenol
- Ag NP:
-
Nanopartículas de plata
- Ag @ HPS-1:
-
NPs de Ag encapsulados en silicalita-1 porosa jerárquica
- APUESTA:
-
Método Brunauer-Emmet-Teller
- BJH:
-
Modelo Barrett-Joyner-Halenda
- CNC:
-
Nanocristal de celulosa
- CTAB:
-
Hexadeciltrimetilamonio
- FTIR:
-
Espectro infrarrojo de transformada de Fourier
- HPS:
-
Microesferas jerárquicas porosas de silicalita-1
- HTO-PDA:
-
Polidopamina de orientación tubular hueca
- MNP:
-
Nanopartículas metálicas
- MWCNT:
-
Nanotubos de carbono de paredes múltiples
- PGMA-SH:
-
Microesferas de poli (metacrilato de glicidilo) funcionalizadas con sulfhidrilo
- TEM:
-
Microscopio electrónico de transmisión
- TPAOH:
-
Hidróxido de tetrapropilamonio
- UV-vis:
-
Espectroscopía ultravioleta visible
- XRD:
-
Difracción de rayos X en polvo
Nanomateriales
- Ingeniería del proceso de recubrimiento por inmersión y optimización del rendimiento para dispositivos electrocrómicos de tres estados
- Preparación y actividad de hidrogenación catalítica mejorada de nanopartículas de Sb / Palygorskita (PAL)
- Dopaje sustitutivo para aluminosilicato mineral y rendimiento superior de separación de agua
- Síntesis verde en un recipiente de microesferas de SnO2 decoradas con Ag:un catalizador eficiente y reutilizable para la reducción de 4-nitrofenol
- Los efectos de la relación Li / Nb en la preparación y el rendimiento fotocatalítico de los compuestos Li-Nb-O
- Nanoesferas de carbono monodispersas con estructura porosa jerárquica como material de electrodo para supercondensador
- La preparación de la nanoestructura yema-cáscara de Au @ TiO2 y sus aplicaciones para la degradación y detección del azul de metileno
- Preparación y rendimiento fotocatalítico de fotocatalizadores LiNb3O8 de estructura hueca
- Preparación de micromateriales híbridos de MnO2 recubiertos de PPy y su rendimiento cíclico mejorado como ánodo para baterías de iones de litio
- Preparación de nanoesferas poliméricas impresas con iones de paladio (II) y su eliminación del paladio (II) de la solución acuosa
- Síntesis y rendimiento in vitro de nanopartículas de hierro-platino recubiertas de polipirrol para terapia fototérmica e imágenes fotoacústicas



