Preparación de micromateriales híbridos de MnO2 recubiertos de PPy y su rendimiento cíclico mejorado como ánodo para baterías de iones de litio
Resumen
MnO 2 Los micromateriales @PPy core-shell se preparan mediante polimerización química de pirrol en el MnO 2 superficie. El polipirrol (PPy) se forma como una capa orgánica homogénea en el MnO 2 superficie. El grosor de la carcasa de PPy se puede ajustar mediante el uso de pirrol. El análisis de SEM, FT-IR, espectroscopia de fotoelectrones de rayos X (XPS), análisis termogravimétrico (TGA) y XRD se utilizan para confirmar la formación de la capa de PPy. El ciclo de celdas galvanostáticas y la espectroscopia de impedancia electroquímica (EIS) se utilizan para evaluar el rendimiento electroquímico como ánodo para baterías de iones de litio. Los resultados muestran que después de la formación de MnO 2 @PPy micromateriales core-shell, se mejora el rendimiento cíclico como ánodo para baterías de iones de litio. Cincuenta microlitros de MnO 2 tipo caddice-clew-like recubierto de PPy tiene el mejor rendimiento cíclico al igual que 620 mAh g −1 descargar capacidades específicas después de 300 ciclos. Como comparación, la capacidad específica de descarga de MnO 2 desnudo los materiales caen por debajo de 200 mAh g −1 después de 10 ciclos. La estabilidad cíclica mejorada de almacenamiento de litio del MnO 2 @PPy muestra atributos a la estructura híbrida core-shell que puede amortiguar la expansión y contracción estructural de MnO 2 causada por la incrustación y desconexión repetidas de iones de Li y puede prevenir la pulverización de MnO 2 . Este experimento proporciona una manera eficaz de mitigar el problema de la capacidad de desvanecimiento de los materiales de óxido de metal de transición como materiales de ánodo para LIB (baterías de iones de litio).
Antecedentes
Dado que los óxidos de metales de transición 3d (MO; donde M es Fe, Co, Ni y Cu) fueron propuestos para servir como ánodos de alta capacidad teórica para baterías de iones de litio por Tarascon et al. [1], se han realizado muchos esfuerzos en la preparación de óxidos micro / nano-metálicos con diversas morfologías y en la investigación de su rendimiento electroquímico como ánodo para baterías de iones de litio [2,3,4,5,6]. Por ejemplo, el grupo de investigación de Zhu había elaborado Fe 3 monodisperso O 4 y γ-Fe 2 O 3 microesferas mediante un método solvotermal sin tensioactivos [3]. Tenían una alta capacidad de descarga inicial de 1307 y 1453 mAh g −1 , respectivamente. Después de 110 ciclos, la capacidad de descarga se mantuvo en 450 mAh g −1 para Fe 3 O 4 y 697 mAh g −1 para γ-Fe 2 O 3 . Hongjing Wu y col. había preparado esferas huecas de NiO uniformes de múltiples cáscaras, especialmente de cáscaras quíntuples, mediante un simple tratamiento hidrotermal de autoensamblaje de caparazón por caparazón. El mérito de esta investigación hizo una contribución significativa a la metodología sintética de estructuras huecas de múltiples capas. Pero los rendimientos de almacenamiento de litio de las esferas huecas de NiO no fueron muy excelentes [4]. MnO 2 poseen una alta capacidad de almacenamiento de litio teóricamente gravimétrica de aproximadamente 1230 mAh g −1 ; por lo tanto, se realizan muchas investigaciones para el diseño, síntesis y aplicaciones de MnO 2 ánodos para baterías de iones de litio [7,8,9,10]. Por ejemplo, el grupo de investigación de Chen había creado γ-MnO 2 con forma microesférica hueca y forma nanocúbica [11]. Después de 20 ciclos, las capacidades de descarga de los nanocubos y microesferas fueron 656,5 y 602,1 mAh g −1 . Además, habían realizado muchas investigaciones sobre MnO 2 materiales para baterías de iones de litio desde el año 2000 hasta ahora [12, 13]. También estudiamos las aplicaciones de MnO 2 ánodos para batería de iones de litio, pero la capacidad específica de descarga de MnO desnudo 2 materiales talados muy rápido por debajo de 200 mAh g −1 después de 10 ciclos [14].
Aunque los materiales de óxidos de metales de transición tienen grandes capacidades específicas teóricas, todos estos materiales, incluido el MnO 2 Los ánodos generalmente están plagados de un rápido desvanecimiento de la capacidad. Las razones de la mala estabilidad cíclica son las siguientes:(1) la conductividad electrónica de los materiales de óxidos de metales de transición suele ser baja, y el electrón o ión tiene dificultades en el proceso de difusión, lo que da como resultado una reacción irreversible del electrodo y un rápido deterioro de la capacidad. (2) Después de los ciclos de carga / descarga, los óxidos de metales de transición sufren una enorme tensión mecánica y se pulverizan, lo que provoca una pérdida de contacto eléctrico entre las partículas activas y el colector de corriente. Las partículas de óxido de metal de transición sin contacto eléctrico ya no pueden participar en los ciclos de carga / descarga, lo que provoca una disminución de la capacidad [15, 16].
El revestimiento de la carcasa es una estrategia eficaz para mejorar la estabilidad del ciclismo. En esta estructura, hasta cierto punto, la cubierta puede amortiguar la expansión y contracción estructural de los materiales de óxido metálico causada por la incrustación y desacoplamiento repetidos de los iones Li. Por el momento, se han utilizado revestimientos de carbono, revestimientos de polímeros conductores orgánicos, híbridos de grafeno y otros revestimientos de compuestos inorgánicos [17, 18]. Por ejemplo, Yin et al. nanocompuestos de CuO recubiertos de polipirrol (PPy) preparados. La muestra de núcleo-carcasa tenía una alta capacidad reversible de 760 mAh g −1 que fue mucho mejor que los de la muestra de CuO desnuda [19]. Li y col. preparado MnO envuelto en grafeno 2 nanocintas. La capacidad de descarga específica reversible alcanzó los 890 mAh g −1 a 0,1 A g −1 después de 180 ciclos. Por lo tanto, es necesario y urgente hacer un recubrimiento de caparazón de PPy sobre MnO 2 materiales para mejorar la estabilidad cíclica como ánodo para baterías de iones de litio [20].
En el presente trabajo, para mejorar el rendimiento cíclico de MnO 2 materiales como ánodo para baterías de iones de litio, se había preparado un revestimiento de polipirrol (un polímero conductor orgánico) mediante polimerización química. Como resultado, el rendimiento cíclico mejoró después de la formación de MnO 2 @PPy micromateriales core-shell. Este experimento proporciona una manera eficaz de mitigar el problema de la capacidad de desvanecimiento de los materiales de óxidos de metales de transición como materiales de ánodo para LIB (baterías de iones de litio).
Métodos
Preparación de muestras
Todos los reactivos eran de calidad analítica y se compraron a Shanghai Chemical Company. El pirrol se purificó mediante destilación descompresiva antes de su uso y se almacenó a 0–5 ° C y se protegió contra la exposición a la luz para evitar la polimerización residual. Se utilizaron otros reactivos sin purificación adicional.
El MnO 2 Los micromateriales se prepararon utilizando el método similar descrito por Yu et al. [14, 21] como alguna modificación. Para preparar MnO 2 tipo caddice-clew micromaterial, 1,70 g MnSO 4 · H 2 Se disolvió O en 15 ml de agua destilada con agitación vigorosa. Cuando la solución esté clara, 20 ml de solución acuosa que contenga 2,72 g de K 2 S 2 O 8 se añadieron a la solución anterior con agitación continua. Luego, la solución transparente resultante se transfirió a un autoclave de acero inoxidable revestido con teflón (50 ml) con una capacidad del 80% del volumen total. El autoclave se selló y se mantuvo a 110 ° C durante 6 h. Una vez completada la reacción, se dejó enfriar el autoclave a temperatura ambiente de forma natural. El precipitado negro sólido se filtró, se lavó varias veces con agua destilada para eliminar las impurezas y luego se secó a 80 ° C en aire durante 3 h. El MnO 2 con forma de clave de caddice obtenido Se recogió un micromaterial para la fabricación de MnO 2 recubierto de PPy materiales. MnO 2 similar a un erizo el micromaterial se preparó mediante un método similar; después de agregar 1.70 g de MnSO 4 · H 2 O y 2,72 g de K 2 S 2 O 8 en 35 ml de agua destilada, 2 ml de H 2 SO 4 luego fue agregado.
El MnO 2 Los micromateriales híbridos @PPy se prepararon mediante polimerización química de pirrol en el MnO 2 superficie utilizando bencenosulfonato de sodio (BSNa) como tensioactivo y FeCl 3 como oxidante. La relación molar de monómero pirrol a BSNa fue de 3:1. Primero, 0,2 g de MnO 2 se dispersó en un vaso de precipitados que contenía 50 ml de 0,01 mol L −1 BSNa solución acuosa y se agitó durante 0,5 h. La mezcla se puso en un baño de hielo / agua (0–5 ° C) con agitación. Luego, se añadió una cierta cantidad de pirrol a la mezcla. Después de agitar durante 0,5 h, una pequeña cantidad de FeCl 3 La solución se añadió gota a gota a la solución acuosa para iniciar el proceso de polimerización. El cambio gradual de color de negro claro a negro profundo indicó la formación de PPy. La mezcla se mantuvo a 0-5 ° C con agitación durante 12 h para formar MnO 2 @PPy micromateriales core-shell. El espesor de PPy se controló mediante el uso de pirrol. Finalmente, el compuesto obtenido se filtró, se lavó con agua y etanol y luego se secó al vacío a 60 ° C durante 4 h.
Caracterización de muestras
Las investigaciones morfológicas de imágenes SEM y espectroscopía de dispersión de energía (EDS) se tomaron en un microscopio electrónico de barrido (QUANTA-200 America FEI Company). Las estructuras cristalográficas de los productos se determinaron con XRD que se registraron en un Rigaku D / max-2200 / PC con objetivo de Cu a una velocidad de barrido de 7 ° / min con 2θ en el rango de 10 ° a 70 °. Espectros de infrarrojos por transformada de Fourier (FT-IR) del MnO 2 Los micromateriales híbridos @PPy paletizados con KBr se realizaron en un espectrómetro Nicolet IS10. También se utilizó el análisis termogravimétrico (TGA) para determinar la pérdida de peso de MnO 2 @PPy Micromateriales híbridos a 10 ° C / min de 25 a 800 ° C en aire (Analizador termogravimétrico MELER / 1600H). Las mediciones de espectroscopía de fotoelectrones de rayos X (XPS) se registraron en un espectroscopio de fotoelectrones de rayos X Ulvac-PHI, PHI5000 Versaprobe-II, utilizando rayos X de Al Kα como fuente de excitación. La energía de enlace obtenida en el análisis XPS se calibró contra el pico C1s a 284,8 eV.
Estudios electroquímicos y de montaje de células
Las propiedades electroquímicas de almacenamiento de litio de los productos sintetizados se midieron usando celdas de prueba de tipo moneda CR2025 ensambladas en una caja de guantes seca llena de argón. Para fabricar el electrodo de trabajo, una suspensión que consta de 60% en peso de materiales activos, 10% en peso de negro de acetileno y 30% en peso de fluoruro de polivinilideno (PVDF) disuelto en N -metilpirrolidinona se vertió sobre una hoja de cobre, se secó a 80ºC al vacío durante 5 h. Se sirvió una hoja de litio como contraelectrodo y electrodo de referencia, mientras que se empleó una membrana Celgard 2320 como separador. El electrolito era una solución de LiPF 6 1 M en carbonato de etileno (EC) -1,2-dimetilcarbonato (DMC) (1:1 en volumen). Los experimentos de carga-descarga galvanostática se realizaron con el sistema de prueba eléctrico Land CT2001A (Wuhan Land Electronics Co., Ltd.) a una densidad de corriente de 0,2 C entre 0,01 y 3,00 V (en comparación con Li / Li + ). Al calcular la capacidad específica de MnO 2 @PPy micromateriales core-shell, se incluyó la masa de PPy. Las mediciones de espectroscopia de impedancia electroquímica (EIS) se realizaron en una estación de trabajo electroquímica (CHI604D, Chenhua, Shanghai), y la frecuencia varió de 0,1 Hz a 100 KHz con una amplitud de señal de CA aplicada de 5 mV.
Resultados y discusión
Características morfológicas de las muestras
Las morfologías de la muestra de PPy puro, MnO 2 similar a un erizo de mar muestra y el MnO 2 Los micromateriales híbridos @PPy con diferente cantidad de polimerización de pirrol se caracterizan por mediciones SEM. Como se muestra en la Fig. 1, la muestra de PPy puro tiene forma de esfera con aproximadamente 800 nm de diámetro y tiende a aglomerarse como rocas en capas. El MnO 2 parecido a un erizo muestra se muestra en la Fig. 1a. El MnO 2 El micromaterial es una forma uniforme similar a un erizo de mar con un diámetro de aproximadamente 3 μm, que consta de varias nanovarillas rectas y de crecimiento radial con una longitud uniforme de aproximadamente 1 μm. La evolución de las morfologías de MnO 2 Los micromateriales híbridos @PPy se muestran en la figura 1b-e. Cuando la cantidad de pirrol es pequeña, el PPy primero se nuclea y luego se incrusta en el espacio de nanobarras en forma de aguja de MnO 2 muestras. Las nanovarillas en forma de aguja en la Fig. 1b son obviamente más anchas que las mostradas en la Fig. 1a. Cuando la cantidad de pirrol aumenta a 20 μL, la estructura de la nanovarilla todavía existe, pero no es obvia. A medida que la cantidad de pirrol aumenta a 30 μL, la estructura de nanovarillas en forma de aguja del MnO 2 los micromateriales desaparecen por completo y adquieren forma esférica. Cuando la cantidad de pirrol aumenta aún más (Fig. 1e), la capa de PPy se vuelve muy gruesa. El esquema 1 ilustra los posibles procesos de formación del MnO 2 @PPy Micromateriales híbridos. En la primera etapa, un pequeño núcleo cristalino de PPy se genera a partir del monómero pirrol por oxidación de FeCl 3 . Luego, el núcleo de cristal se deposita en el espacio entre las espinas en la superficie del "erizo". Con la polimerización continua de PPy, el espacio entre las espinas se llena gradualmente. Al final, todo el "erizo" está cubierto uniformemente por PPy. Las imágenes SEM de bajo aumento de MnO 2 Los micromateriales híbridos @PPy en el archivo adicional 1 confirman que el caparazón PPy se forma uniformemente en MnO 2 @PPy muestra.

Imágenes SEM de MnO 2 similar a un erizo recubierto de PPy muestra. En la esquina superior izquierda hay PPy puro, a MnO 2 similar al erizo muestra, b 10 μL, c 20 μL, d 30 μL y e 50 μL de MnO 2 similar al erizo recubierto de pirrol muestra. La barra de escala es de 1 μm
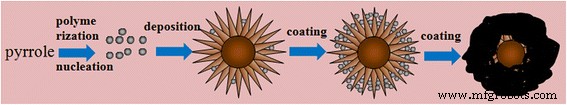
Ilustración esquemática del mecanismo de formación propuesto para MnO 2 @PPy material
En este trabajo, caddice-clew-like MnO 2 El micromaterial también se recubre con PPy utilizando un método similar. Las morfologías de SEM se muestran en el archivo adicional 1:Información de apoyo 1. El MnO 2 similar a caddice-clew el micromaterial tiene forma de nanoalambre y se agrega en esferas de 2 a 4 μm de diámetro que parecen un escuadrón de cadáveres. Cuando la cantidad de pirrol es pequeña, el PPy se forma primero como partículas pequeñas y se adhiere a la superficie del MnO 2 muestras. A medida que aumenta la cantidad de pirrol, PPy cubre gradualmente el MnO 2 similar al del caddice-clew completamente para formar una gran estructura de bloques que parece rocas.
El recubrimiento uniforme de PPy se verifica además mediante análisis de espectroscopía de rayos X de dispersión de energía (EDX) (que se muestra en la Tabla 1). No se detectan señales de carbono ni nitrógeno en MnO 2 puro muestra. Se detecta una cantidad significativa de señales de carbono y nitrógeno en PPy y MnO 2 Muestras de @PPy debido a la formación del caparazón de PPy. Con el aumento del uso de pirrol, también aumenta el contenido de carbono y nitrógeno. Los datos EDX de MnO 2 tipo caddice-clew Los ejemplos de @PPy se muestran en el archivo adicional 1:Información complementaria 4.
Análisis FT-IR de muestras
Las características de la estructura y la composición de PPy y MnO 2 sintetizados Las muestras de @PPy se caracterizan además por espectroscopia FT-IR (que se muestra en la Fig. 2). Para todos los MnO 2 @ Muestras PPy y muestra PPy, las bandas a 1550, 1448, 1283 y 1130 cm −1 son los picos característicos de los anillos PPy. Entre ellos, el pico a unos 1550 cm −1 se debe al estiramiento C-C y C =C, y el pico a aproximadamente 1448 cm −1 proviene del estiramiento C-N de PPy. El pico a aproximadamente 1130 cm −1 se debe al pico de vibración de estiramiento S =O que pertenece al BSNa, lo que indica que el ion sulfonato está dopado en el anillo pirrol. La proporción de I 1550 y yo 1448 se suele atribuir al conjugado y al grado de dopaje del PPy [22]. Cuanto mayor sea el I 1550 / I 1448 es el mayor grado de conjugado y dopaje de PPy. Es decir, si 1550 / I 1448 es alta, la conductividad de PPy debería ser mejor. Las bandas a 1550, 917 y 778 cm −1 de 30 μL de MnO 2 similar al erizo recubierto de PPy muestra son más débiles que las de 50 μL de MnO 2 similar a un clavo de caddice recubierto de PPy muestra. Por lo tanto, la conductividad del MnO 2 similar al caddice-clew recubierto de PPy La muestra debe ser mejor, y los 50 μL de MnO 2 tipo caddice-clew-like recubiertos con PPy La muestra debe tener un mejor rendimiento de almacenamiento de litio. Bandas a 1040 y 778 cm −1 son las vibraciones en el plano y fuera del plano de la deformación C-H de C β -H banda de absorción. Sin C α Se observa una banda de absorción -H en el espectro, lo que indica que el anillo pirrol está predominantemente unido por α-α en PPy. La banda de absorción a 1657 cm −1 se debe a la existencia de moléculas de agua en los productos. Por lo tanto, los resultados de FT-IR demuestran que la capa de PPy se forma en MnO 2 @PPy muestra.
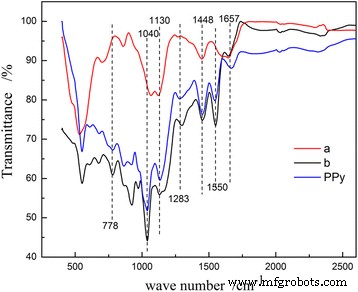
Espectros FT-IR de (a) 30 μL de MnO 2 similar al erizo recubierto de PPy muestra y (b) 50 μL de MnO 2 tipo caddice-clew-like recubierto con PPy muestra y PPy puro
Resultados de XPS
Por lo general, TEM debe verificar la estructura núcleo-capa. Sin embargo, el MnO 2 puro La muestra aquí es demasiado gruesa para tomar buenas imágenes TEM. Entonces, para verificar la estructura núcleo-capa, hicimos una prueba XPS y una prueba EDS para verificar los diferentes componentes en la superficie y la muestra completa. Para mayor claridad, solo la espectroscopia de 30 μL de MnO 2 similar al erizo recubierto de PPy muestra y 50 μL de MnO 2 tipo caddice-clew recubierto con PPy La muestra se muestra en la Fig. 3. Otros están en el archivo adicional 1:Información de apoyo 5. Los resultados finales se enumeran en la Tabla 2. Las principales energías de enlace (BE) de O1s, N1s, C1s y Mn (2p1 / 2, 2p3 / 2) se determina que son 531,2, 398,9, 284,8 y 651,4 y 640,3 eV, respectivamente. Los picos en 973 y 901,6 y 848,9 eV son picos O KLL (picos Auger de átomos de oxígeno) y picos Mn LMM (picos Auger de átomos de Mn). Hay unos pocos Fe o Cl detectados por XPS, como se muestra en la Fig. 3. Aquí, la aparición de señales de Fe o Cl se debe al uso de FeCl 3 como oxidante de polimerización en la preparación de la cáscara de PPy. Como puede verse en la Tabla 2, las diferencias del análisis EDS y el análisis XPS son distintas. En el análisis XPS, el contenido de O, N y C es mucho mayor; el contenido de Mn es menor. La profundidad máxima de análisis de XPS es de aproximadamente 5 a 10 nm. Los fuertes picos de O, N y C confirman que el MnO 2 las muestras están cubiertas por la película orgánica PPy (como se describe en el párrafo SEM).
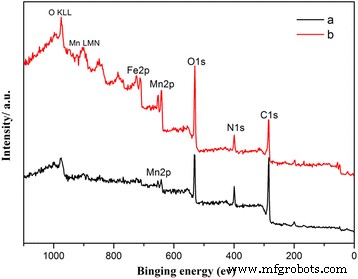
Espectros XPS de (a) 30 μL de MnO 2 similar al erizo recubierto de PPy muestra y (b) 50 μL de MnO 2 tipo caddice-clew-like recubierto con PPy muestra
Resultados de TGA
Para probar el shell PPy en el MnO 2 sintetizado @PPy samples, TGA of bare MnO 2 ejemplo, PPy desnudo y MnO 2 Las muestras de @PPy se realizan al aire. La Figura 4 son los resultados de TGA. Como puede verse en la Fig. 4, el polvo de PPy desnudo muestra dos regiones de pérdida de peso. La primera pérdida de peso de alrededor del 12% en el rango de temperatura de 60–260 ° C puede atribuirse a la desorción de agua fisisorbida y la eliminación de solventes absorbidos en la superficie, como se menciona en la literatura anterior [19, 23, 24]. Mientras que la segunda pérdida de peso alrededor del 88% en el rango de 260–600 ° C se atribuye a la oxidación de PPy. Como resultado, el polvo PPy desnudo se quema completamente a 600 ° C. Después de la prueba de TGA, el MnO 2 desnudo parecido a un erizo MnO 2 de muestra y tipo caddice-clew muestra permanecen 88,7% en peso y 91,6% a 800 ° C. La mayor pérdida de peso se produce en el rango de temperatura de 60 a 300 ° C, por lo que se puede atribuir a la eliminación de los disolventes absorbidos en la superficie, aunque ambas muestras parecían muy secas. Para 30 μL de MnO 2 similar al erizo recubierto de PPy muestra, la pérdida de peso en el rango de 60–260 ° C es del 10%, y la pérdida de peso total en el rango de 0–800 ° C es del 32,3%. El cambio de peso antes y después de la oxidación de PPy se puede traducir directamente en la cantidad de PPy en el MnO 2 @PPy muestra [25]. Con este método, las cantidades de PPy en 30 μL de MnO 2 similar al erizo recubierto de PPy muestra es de aproximadamente 22%. Este valor se acerca a las cantidades teóricas de PPy. Para 50 μL de MnO 2 similar a un ovillo de caddice recubierto de PPy muestra, la pérdida de peso total en el rango de 0–800 ° C es del 43,9% y la pérdida de peso en el rango de 60–260 ° C es del 14%. Por lo tanto, las cantidades reales de PPy en 50 μL de MnO 2 similar a caddice-clew recubierto de PPy muestra es de aproximadamente el 30%, que está muy cerca del valor teórico. Por tanto, los resultados confirman que el MnO 2 las partículas están cubiertas por la película orgánica de PPy.
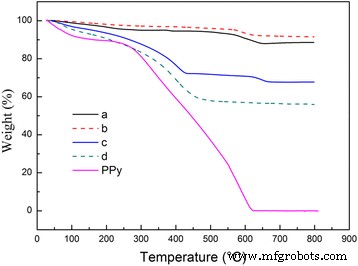
Curvas TGA de PPy y MnO 2 muestras. ( a ) MnO 2 similar a un erizo muestra, ( b ) caddice-clew-like MnO 2 muestra, ( c ) 30 μL de MnO 2 similar al erizo recubierto de PPy muestra y ( d ) 50 μL de MnO 2 similar a un ovillo de cadáver recubierto de PPy muestra
Caracterización XRD de muestras
Las estructuras cristalinas de MnO 2 Las muestras de @PPy son examinadas por XRD (Fig. 5). Como se muestra, PPy es una estructura amorfa. Cuando está recubierto por PPy, el MnO 2 similar al erizo Las muestras de @PPy retienen el α-MnO 2 estructura. Los picos de difracción aparecen en 2θ =12,7 °, 18,1 °, 28,8 °, 37,5 °, 42,1 °, 49,9 °, 56,2 ° y 60,3 ° coinciden bien con los picos de difracción de (110), (200), (310), (211), (301), (411), (600) y (521) planos cristalinos de α-MnO 2 datos estándar (archivo PDF de la tarjeta JCPDS n. ° 44-0141). Con el aumento de la cantidad de PPy, la intensidad de los picos de DRX disminuye gradualmente debido a la formación de PPy amorfo. Como se muestra en el MnO 2 similar a un ovillo de caddice recubierto de PPy muestras, hay picos amorfos obvios de 15 ° a 30 ° en muestras de 75 y 100 ul. Cuando se recubre con PPy, el MnO 2 con forma de caddice-clew Las muestras de @PPy retienen α-MnO 2 estructura también. Con el aumento de la cantidad de PPy, los materiales obviamente cambian de cristalinos a amorfos. Estos resultados demuestran además que la película orgánica de PPy se ha recubierto con éxito sobre MnO 2 partículas.
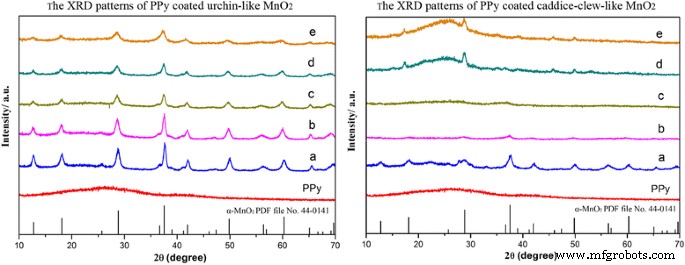
Los patrones XRD de MnO 2 recubierto de PPy muestras. La izquierda es ( a ) MnO 2 similar a un erizo muestra y ( b ) 10 μL, ( c ) 20 μL, ( d ) 30 μL y ( e ) 50 μL con recubrimiento de PPy. La derecha es ( a ) caddice-clew-like MnO 2 muestra y ( b ) 30 μL, (c) 50 μL, ( d ) 75 μL ( e ) y 100 μL recubierto con PPy
Rendimiento electroquímico
Los rendimientos electroquímicos de estos MnO 2 Se investigan muestras de @PPy como materiales de ánodo para LIB. Las figuras 6a, b presentan las curvas de carga-descarga típicas de los ánodos (en comparación con la batería completa) construidas a partir del MnO 2 desnudo. muestra y MnO 2 @PPy muestra a una velocidad de 0,2 C en el rango de voltaje de 0,01 a 3,00 V (en comparación con Li / Li + ). Para mayor claridad, solo el MnO 2 desnudo muestra y el MnO 2 Se muestran @PPy con los mejores rendimientos de carga-descarga. Como puede verse, los perfiles de descarga-carga de MnO 2 Las muestras de @PPy son similares a las de MnO 2 sin nada , lo que indica que los productos híbridos recubiertos por capas de PPy orgánico no cambian la naturaleza electroquímica del MnO 2 Ánodos LIBs. Sin embargo, el rendimiento de almacenamiento de litio del MnO 2 recubierto de PPy La muestra se ha mejorado mucho. El desnudo MnO 2 parecido a un erizo muestra y MnO 2 similar al erizo recubierto de PPy muestra que ambos tienen una alta capacidad específica de descarga inicial como aproximadamente 1200-1400 mAh g −1 , mientras que la capacidad específica de descarga teórica es 1232 mAh g −1 . Las capacidades específicas de descarga adicionales pueden resultar de la formación de la capa SEI [14]. Después de 10 ciclos, la capacidad específica de descarga de MnO 2 similar a un erizo desnudo la muestra disminuye a menos de 200 mAh g −1 . Como comparación, la capacidad específica de descarga del MnO 2 similar al erizo recubierto de PPy la muestra permanece en aproximadamente 500 mAh g −1 incluso después de 300 ciclos. El MnO 2 con forma de caddice-clew y el MnO 2 similar al ovillo de caddice recubierto de PPy son muy similares. Después de 10 ciclos, la capacidad específica de descarga de MnO 2 de tipo caddice-clew desnudo disminuye a menos de 200 mAh g −1 . El MnO 2 similar al ovillo de cadáver recubierto de PPy la muestra se mantiene entre 500 y 600 mAh g −1 después de 300 ciclos.
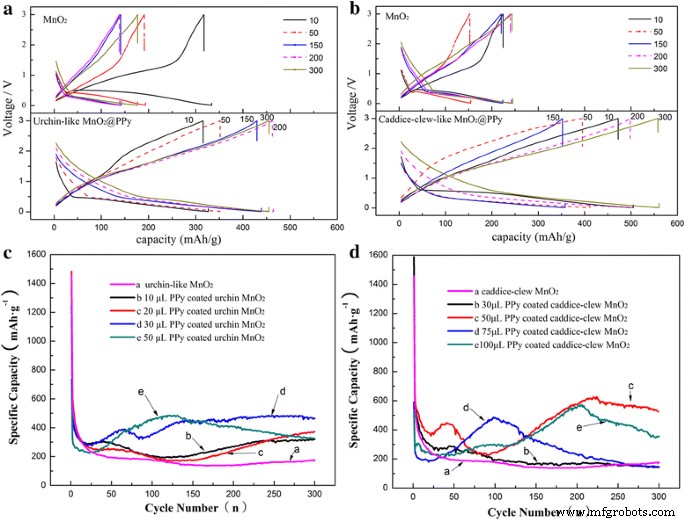
un , b Curvas de carga-descarga para ciclos seleccionados de 30 μL de muestra de MnO2 recubierta de PPy y 50 μL de muestra de MnO2 tipo caddice-clew recubierta de PPy. c , d El rendimiento cíclico de la muestra de MnO2 y las muestras de MnO2 recubiertas con PPy
Para evaluar su estabilidad cíclica de almacenamiento de litio, se realizan mediciones de carga / descarga durante 300 ciclos en MnO 2 @PPy muestras con diferentes pirroles recubiertos. El espesor de PPy está controlado por la cantidad de pirrol. Como se muestra en la Fig.6c, d, cuando la cantidad de pirrol es pequeña (como 30 uL para MnO 2 similar a caddice-clew y 10 uL para MnO 2 similar al erizo ), la capacidad de almacenamiento de litio de este híbrido MnO 2 La muestra de @PPy no mejora claramente. Esto indica que la película de PPy es demasiado delgada para evitar que MnO 2 materiales que sufren pulverización. Sin embargo, cuando aumenta la cantidad de pirrol, las capacidades específicas de descarga del híbrido MnO 2 Las muestras de @PPy se han mejorado notablemente. Para MnO 2 tipo caddice-clew , cuando la cantidad de pirrol aumenta a 50 uL, el híbrido MnO 2 La muestra @PPy tiene las capacidades específicas de descarga más grandes como 620 mAh g −1 después de 300 ciclos. Para MnO 2 similar al erizo , la mayor capacidad específica de descarga aparece cuando se utilizan 30 uL de pirrol. La capacidad específica de descarga en el ciclo 300 es de 480 mAh g −1 . Además, como puede verse en la Fig. 6c, d, todos los híbridos MnO 2 Las muestras de @PPy tienen estabilidades cíclicas mejoradas. Las estabilidades cíclicas mejoradas de almacenamiento de litio del híbrido MnO 2 Las muestras de @PPy pueden atribuirse a la estructura única de los productos híbridos de núcleo-capa de polímero conductor / óxido metálico. En esta estructura, el caparazón de PPy flexible puede amortiguar eficazmente la expansión y contracción estructural de MnO 2 causado por la incrustación y desconexión repetidas de los iones de Li. Además, el caparazón de PPy puede evitar la pulverización de MnO 2 , así como proteger la pérdida de contacto eléctrico entre el MnO 2 material y el colector de corriente (lámina de cobre). Considerando que, la baja capacidad y la rápida capacidad de desvanecimiento del MnO 2 desnudo puede atribuirse a la pulverización y pérdida de contacto entre partículas de MnO 2 o el contacto de MnO 2 con colector de lámina de cobre debido a la expansión / contracción de gran volumen durante los procesos repetidos de carga y descarga. Por lo tanto, este experimento de recubrimiento de PPy proporciona una forma eficaz de mitigar el problema de la capacidad de desvanecimiento de todos los materiales de óxido de metal de transición como materiales de ánodo para LIB.
El rendimiento de la tasa de MnO 2 Las muestras de @PPy se muestran en la Fig. 7. Para probar la capacidad de tasa, los ciclos de carga / descarga se realizan en el rango de voltaje de 0.01–3.0 V y la tasa de descarga como 0.2C → 0.5C → 1.0C → 2.0C → 5.0C → 2.0 C → 1.0 C → 0.5C → 0.2C. La Figura 7a es la capacidad de velocidad en la etapa de 5.0 a 0.2 C. Como se muestra, la capacidad específica de descarga de todos los MnO 2 muestras en la etapa de 5.0 a 0.2 C es muy similar a la de la etapa de 0.2 a 5 C, lo que prueba que el MnO 2 las muestras tienen una reversibilidad relativamente alta. Sin embargo, las capacidades específicas de descarga de todos los MnO 2 las muestras son pobres por encima de la tasa de 1 C. El mérito del híbrido MnO 2 Las muestras de @PPy en el rendimiento de la tasa se pueden ver en las tasas bajas (0.2, 0.5 y 1 C). Después de la descarga a 5 C, la capacidad de descarga del MnO 2 similar a un ovillo de caddice recubierto de PPy la muestra es 508 mAh g −1 a 0,2 C, mientras que se obtiene una capacidad de descarga mucho menor con solo 160 mAh g −1 a 0,2 C del MnO 2 con forma de ovillo de cadáver desnudo muestra. Por lo tanto, el MnO 2 similar al ovillo de caddice recubierto de PPy muestra ha mejorado el rendimiento de la frecuencia. La situación del MnO 2 similar al erizo recubierto de PPy la muestra es muy similar; sin embargo, la capacidad de descarga es un poco menor que la del MnO 2 similar a un ovillo de caddice recubierto de PPy muestra.
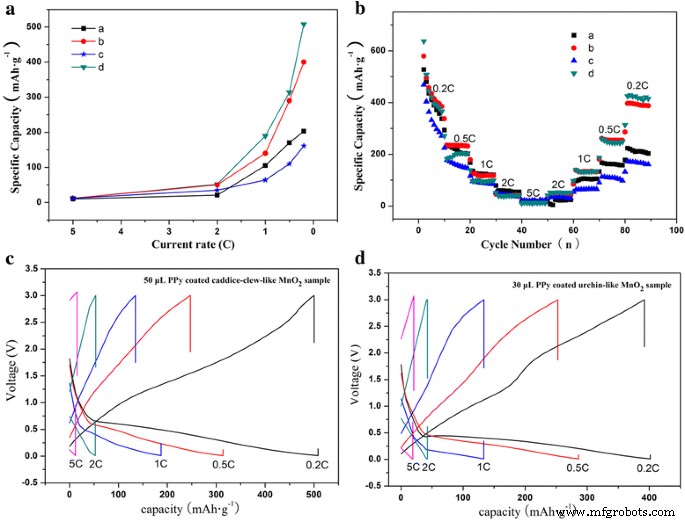
un Tasa de capacidad, b tasa de rendimiento y c , d curvas de carga-descarga del MnO 2 @PPy muestras. ( a , b ) MnO 2 similar al erizo muestra y 30 μL de muestra recubierta de PPy. ( c , d ) MnO 2 con forma de ovillo de caddice muestra y 50 μL de muestra recubierta con PPy
As shown in the rate performance, the urchin-like MnO2 micromaterial has relatively higher discharge specific capacity than caddice-clew-like MnO2 micromaterial, which is consistent with previous reports [14]. However, after PPy coating, the caddice-clew-like MnO2 @PPy sample has better lithium-storage cyclic stability. Here, the conjugate degree of the PPy may be one reason. The FT-IR analysis indicates that the PPy conjugate degree of the caddice-clew-like MnO2 @PPy sample is higher. So, the caddice-clew-like MnO2 @PPy sample should have better conductivity and better electrochemical performance. To confirm it, the EIS tests are carried out.
Figure 8 presents the EIS results for lithium cells after the fifth cycle at an ope-circuit voltage. As shown in Fig. 8a, the impedance spectra of caddice-clew-like MnO2 obviously consists of two oblate semicircles in the high-to-medium-frequency region and an inclined line in the low-frequency region. However, the two semicircles of the other three samples are not easily distinguishable. An intercept at the Z real axis in the high-frequency region corresponds to the ohmic electrolyte resistance (R s ). The first semicircle in the high frequency ascribes to the Li-ion migration resistance (R sf ) through the SEI films. The second semicircle in the high-to-medium frequency ascribes to the charge transfer resistance (R ct ). The inclined line at low-frequency region represents the Warburg impedance (W s ), which is associated with lithium-ion diffusion in the active material. The semicircular parts of both the hybrid MnO2 @PPy samples are much smaller than that of the uncoated MnO2 muestra. This indicates that the conductivities of the hybrid MnO2 @PPy samples are better and the charge transfer resistance of Li ion decreases after PPy coating. The semicircle resistance of caddice-clew-like MnO2 @PPy sample is only 77 Ω. The semicircle resistance of urchin-like MnO2 @PPy sample is only 95 Ω. Here, after PPy coating, the lower resistance of caddice-clew-like MnO2 micromaterial can explain the better lithium-storage cyclic stability.
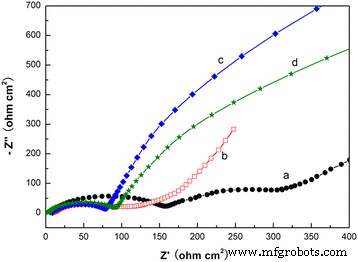
Nyquist plot of Li/MnO2 cells at open-circuit voltage. ( a ) caddice-clew-like MnO2 muestra. ( b ) Urchin-like MnO2 muestra. ( c ) 50 μL PPy-coated caddice-clew-like MnO2 muestra. (d ) 30 μL PPy-coated urchin-like MnO2 sample
Conclusions
In summary, MnO2 @PPy core-shell micromaterials are successfully prepared by chemical polymerization of pyrrole on the MnO2 superficie. The thickness of the PPy shell can be adjusted by the usage of pyrrole. After formation of MnO2 @PPy core-shell micromaterials, the cyclic performances as an anode for lithium-ion batteries are improved. Fifty microliters of PPy-coated caddice-clew-like MnO2 has the best cyclic performances and has 620 mAh g −1 discharge specific capacities after 300 cycles. As a comparison, the discharge specific capacity of bare MnO2 materials falls below 200 mAh g −1 after 10 cycles. The improved lithium-storage cyclic stability of the MnO2 @PPy samples can attribute to the core-shell hybrid structure. In this structure, the flexible PPy shell can effectively buffer the structural expansion and contraction of MnO2 caused by the repeated embedding and disengagement of Li ions and can prevent the pulverization of MnO2 . Therefore, this experiment of PPy coating provides us an effective way to mitigate the problem of capacity fading of the transition metal oxide materials as anode materials for LIBs.
Nanomateriales
- Nanopartículas de oro multifuncionales para aplicaciones terapéuticas y diagnósticas mejoradas:una revisión
- Compuesto mecánico de LiNi0.8Co0.15Al0.05O2 / Nanotubos de carbono con rendimiento electroquímico mejorado para baterías de iones de litio
- Síntesis y propiedades electroquímicas de materiales de cátodo LiNi0.5Mn1.5O4 con dopaje compuesto Cr3 + y F− para baterías de iones de litio
- Compuesto negro de acetileno / MoS2 de pocas capas como material de ánodo eficiente para baterías de iones de litio
- Preparación y rendimiento fotocatalítico de fotocatalizadores LiNb3O8 de estructura hueca
- Efecto de diferentes aglutinantes sobre el rendimiento electroquímico del ánodo de óxido metálico para baterías de iones de litio
- Compuesto de grafeno / Si integrado fabricado por reducción térmica de magnesio como material anódico para baterías de iones de litio
- Síntesis fácil y respetuosa con el medio ambiente de nanocables de Co3O4 y su prometedora aplicación con grafeno en baterías de iones de litio
- Un ánodo de película de Fe2O3 nanocristalino preparado por deposición de láser pulsado para baterías de iones de litio
- Preparación de NP de Ag encapsulado de silicalita-1 poroso jerárquico y su rendimiento catalítico para la reducción de 4-nitrofenol
- Transformación de lodo Si en estructura nano-Si / SiOx por difusión de oxígeno hacia el interior como precursor de ánodos de alto rendimiento en baterías de iones de litio



