Síntesis y propiedades electroquímicas de materiales de cátodo LiNi0.5Mn1.5O4 con dopaje compuesto Cr3 + y F− para baterías de iones de litio
Resumen
A Cr 3+ y F - LiNi 0.5 dopado con compuesto Mn 1.5 O 4 El material del cátodo se sintetizó mediante el método de estado sólido y se investigó la influencia de la cantidad de dopaje en las propiedades físicas y electroquímicas del material. La estructura y morfología del material del cátodo se caracterizaron por XRD, SEM, TEM y HRTEM, y los resultados revelaron que la muestra presentaba características claras de espinela. Sin Cr 3+ y F - Se encontraron fases de impurezas y la estructura de la espinela se volvió más estable. Los resultados de las pruebas de carga / descarga, voltamperometría cíclica (CV) y espectroscopía de impedancia electroquímica (EIS) sugirieron que LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 en el que Cr 3+ y F - Las cantidades de dopaje fueron ambas de 0.05, tenían las propiedades electroquímicas óptimas, con tasas de descarga de 0.1, 0.5, 2, 5 y 10 C y capacidades específicas de 134.18, 128.70, 123.62, 119.63 y 97.68 mAh g -1 , respectivamente. Después de 50 ciclos a una velocidad de 2 C, LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 mostró un rendimiento de ciclismo extremadamente bueno, con una capacidad específica de descarga de 121.02 mAh g −1 y una tasa de retención de capacidad del 97,9%. La prueba EIS reveló que el dopaje disminuyó claramente la resistencia a la transferencia de carga.
Antecedentes
La creciente demanda de vehículos eléctricos (EV), vehículos eléctricos híbridos (HEV) y baterías de almacenamiento de alta capacidad requiere baterías de iones de litio de mayor rendimiento con densidad de energía y densidad de potencia mejoradas [1, 2, 3]. El material del cátodo es un material clave en las baterías de iones de litio, y la investigación y el desarrollo de materiales de cátodos de alto potencial es una de las principales formas de mejorar la densidad de energía de las baterías de iones de litio. Spinel LiNi 0.5 Mn 1.5 O 4 tiene la ventaja de que el voltaje de descarga se estabiliza a aproximadamente 4,7 V:bajo costo, excelente estabilidad estructural y estabilidad térmica, y se considera uno de los materiales de cátodo más prometedores para baterías de iones de litio. Sin embargo, la estabilidad cíclica de LiNi 0.5 Mn 1.5 O 4 es pobre, y el ciclo de este material da como resultado el efecto Jahn-Teller y la disolución del Mn [4, 5, 6, 7].
Se ha aplicado una modificación del material por dopaje y recubrimiento para suprimir el efecto Jahn-Teller y reducir la pérdida de Mn con el fin de mejorar las propiedades electroquímicas del material. La modificación por dopaje es un enfoque muy eficaz que no solo puede mejorar la estabilidad de la estructura cristalina, sino también la capacidad de velocidad del material [8, 9]. Durante la carga, el 4,7% del volumen de LiNi 0.5 Mn 1.5 O 4 se mantiene al pasar de la fase rica en litio a la fase pobre en litio. El cambio de volumen en el material durante el proceso de inserción / extracción de iones de litio puede suprimirse eficazmente aplicando una pequeña cantidad de dopaje y revestimiento de superficie y, además, el dopaje puede mejorar la capacidad de velocidad y el rendimiento cíclico del material [10,11, 12]. Dopaje catiónico (Na [13], Ru [14], Rh [15], Co [16], Al [17], Cr [18], Zn [19], Nd [20], Mg [21], Mo [ 22], Sm [23], Cu [24], etc.) y el dopaje aniónico (S [25], P [26] y F [27]) se han aplicado para modificar LiNi 0.5 Mn 1.5 O 4. Por ejemplo, en comparación con LiNi 0.5 puro Mn 1.5 O 4 , LiNi dopado con Al 0.5 Mn 1.5 O 4 puede mejorar eficazmente la capacidad de descarga (hasta 140 mAh g −1 ) y estabilidad cíclica (retención de capacidad del 70% después de 200 ciclos) [28].
En este documento, F - y Cr 3+ se seleccionan para mejorar la capacidad de velocidad mediante la sustitución de compuestos aniónicos-catiónicos, y se optimizan sus cantidades de dopaje [29]. Además, se probaron y analizaron la estructura, morfología y propiedades electroquímicas de las muestras.
Métodos
El LiNi 0.5 Mn 1.5 O 4 Los materiales fueron sintetizados por el método de estado sólido usando Ni (CH 3 COO) 2 · 4H 2 O 、 Mn (CH 3 COO) 2 · 4H 2 O y Cr (CH 3 COO) 3 · 6H 2 O como materiales de partida.
Experimental
Preparación de LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05
El LiNi 0.5 Mn 1.5 O 4 Los materiales fueron sintetizados por el método de estado sólido usando Ni (CH 3 COO) 2 · 4H 2 O 、 Mn (CH 3 COO) 2 · 4H 2 O y Cr (CH 3 COO) 3 · 6H 2 O como materiales de partida. Los materiales se mezclaron completamente mediante molienda de bolas durante 2 h utilizando cantidades estequiométricas de LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075), y la mezcla seca se calentó a 400 ° C en aire durante 5 h. El óxido del complejo Ni-Mn-Cr se formó después del enfriamiento natural en un horno de mufla. La fuente compleja de óxido y litio obtenida (Li 2 CO 3 y LiF) se mezclaron mediante molienda de bolas durante 4 h usando alcohol anhidro como dispersante, y luego se calentó la mezcla a 850 ° C en aire durante 12 h para fortalecer su cristalización en un horno de mufla. Después de reducirse a 650 ° C en el aire durante 12 h, los materiales con diferentes Cr 3+ y F - cantidades de dopaje compuestas, LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075), se obtuvieron después del enfriamiento natural en un horno de mufla.
Caracterización
Las estructuras cristalinas de las muestras se identificaron mediante difracción de rayos X (XRD, UltimaIII, difractómetro de radiación Cu-Kα, 40 kV, 40 mA, Rigaku, Japón) a temperatura ambiente en un rango de 2θ de 10 ° a 80 ° con un escaneo velocidad de 8 ° min −1 . La morfología del LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 Las muestras se midieron mediante microscopía electrónica de barrido (SEM, Hitachi, S-3400N, Japón). La microestructura y composición elemental de los materiales obtenidos se observaron mediante microscopía electrónica de transmisión (TEM, Tecnai G2 F20, FEI) equipada con espectroscopía de energía dispersiva (EDS).
Prueba de rendimiento electroquímico
Las propiedades electroquímicas se evaluaron con pilas de botón CR2032, y las pilas consistían en LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 electrodo como electrodo de cátodo, lámina de metal de Li como electrodo de ánodo, Celgard2400 estadounidense como separador y LiPF de 1 mol / L 6 en EC / EMC / DMC (1:1:1 en volumen) como electrolito. El cátodo se sintetizó mezclando el material activo, negro de humo y fluoruro de polivinilideno (PVDF) en una proporción en peso de 8:1:1 en la N-metil pirrolidinona (NMP) para formar una suspensión homogénea, que luego se recubrió con Al papel de aluminio con un recubridor de cuchilla dosificadora y posteriormente se secó en un horno de vacío a 120 ° C durante 24 h para eliminar el NMP y el agua residual. Las pilas tipo botón se ensamblaron en una guantera llena de argón (MBRAUN PRS405 / W11006-1, Alemania).
El rendimiento electroquímico de LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 / Se evaluaron las pilas de botón de Li cargándolas y descargándolas a más de 3,5–5,0 V utilizando un comprobador CT-300-1A-SA (Neware Technology Ltd.). Las pruebas de voltamogramas cíclicos (CV) (el cátodo era el electrodo de trabajo y la lámina de metal de litio era el electrodo contador y de referencia) se llevaron a cabo utilizando una estación de trabajo electroquímica (Metrohm Co., Autolab PGSTAT302N, Países Bajos) con una velocidad de exploración de 0,1 mV. / sy una frecuencia de barrido de 0,5 Hz entre 3,5 y 5,0 V. La espectroscopia de impedancia electroquímica (EIS) se realizó en una estación de trabajo electroquímica con una amplitud de CA de 5 mV en el rango de frecuencia de barrido de 0,01 a 100 kHz (el cátodo era el El electrodo de trabajo y la lámina de metal de litio eran tanto el contraelectrodo como el electrodo de referencia).
Resultados y discusión
La Figura 1 muestra el patrón XRD del LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) materiales. El patrón reveló que el Cr 3+ y F - Los materiales dopados con compuesto tenían los mismos picos de difracción que la muestra sin dopar, lo que sugiere que las muestras se sintetizaron sin fases de impurezas y que Cr 3+ y F - el dopaje compuesto no cambiaría la estructura cristalina de la espinela. No se encontraron picos de impurezas o picos de superestructura, lo que indica que algunos de los Ni 2+ , Mn 4+ , Mn 3+ y O 2− Los átomos en la fase de espinela fueron sustituidos con éxito por Cr 3+ y F - . La fuerza de los picos de difracción del Cr 3+ -dopado con LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 las muestras disminuyeron y la concentración de dopantes en exceso influyó en el grado de cristalinidad. Los parámetros de celosía para LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) los materiales fueron calculados por Jade5.0, y los resultados se muestran en la Tabla 1.
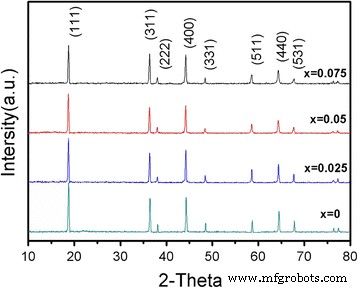
Patrones XRD de LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075)
La Figura 2 muestra las imágenes SEM del LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) con un aumento de × 10000. El LiNi 0.5 Mn 1.5 O 4 muestra consta de partículas uniformes de tamaño submicrónico, y los cristales tienen una forma cuasi-octaédrica. Después de Cr 3+ y F - dopaje compuesto, el LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) las muestras exhibieron partículas altamente cristalinas y espinelas típicas con forma octaédrica y bordes y esquinas afilados.

Imágenes SEM de LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 . ( a ) x =0, ( b ) x =0.025, ( c ) x =0.05, ( d ) x =0.075
La existencia de cromo y fluoruro en la espinela LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 compuesto fue verificado por EDS, como se muestra en la Fig. 3. Las imágenes TEM y TEM de alta resolución (HRTEM) de la morfología del cristal y las franjas de la red se muestran en la Fig. 4. Ambos LiNi 0.5 Mn 1.5 O 4 y LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 mostró morfologías superficiales similares. La distancia entre las franjas de celosía para LiNi 0.5 Mn 1.5 O 4 se midió en 0,4835 nm, correspondiente al plano (111) de la espinela. Después del dopaje, el espaciado de la red en la Fig. 4d revela un valor de 0,4811 nm, lo que indica que la energía de unión más alta del Cr-O puede encoger la estructura de la espinela. Por lo tanto, LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 Se espera que tenga excelentes propiedades electroquímicas para el almacenamiento de litio.
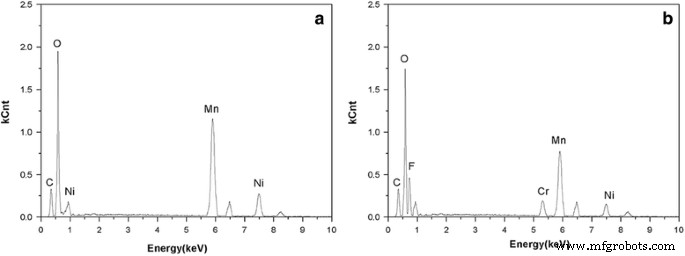
Patrones EDS de LiNi 0.5 Mn 1.5 O 4 ( a ) y LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 ( b )
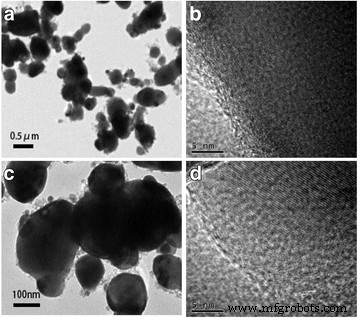
Imágenes TEM y HRTEM de LiNi 0.5 Mn 1.5 O 4 ( a y b ) y LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 ( c y d )
La Figura 5 muestra las curvas de carga / descarga del LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) muestras, donde las celdas se probaron en un rango potencial de 3.5–5.0 V a una velocidad de 0.1 C. Las capacidades específicas de descarga del LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) las muestras fueron 141.59, 139.38, 134.18 y 124.47 mAh g −1 a 0,1 C, respectivamente. La curva de carga / descarga de las muestras dopadas estaba compuesta por dos niveles obvios de voltaje de aproximadamente 4,7 y 4,1 V. El nivel de voltaje de aproximadamente 4,7 V se atribuyó al Ni 2+ / Ni 4+ par redox, mientras que la pequeña meseta de voltaje en aproximadamente 4,1 V puede deberse a la sustitución de F - para O 2− , que redujo la cantidad de carga negativa y cambió la valencia del metal de transición (Mn 4+ se redujo a Mn 3+ ) para mantener el saldo de cargo.
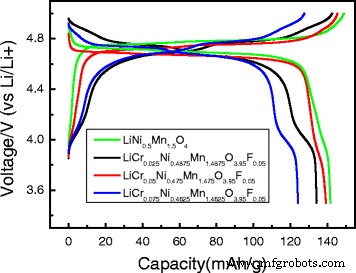
Curvas de carga / descarga de LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) a 0.1 C
La capacidad de velocidad es muy importante para las baterías de iones de litio. Las curvas de rendimiento ciclista del LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) muestras a diferentes velocidades se muestran en la Fig. 6. La capacidad de descarga específica más alta a 0.1 C se observó para LiNi 0.5 Mn 1.5 O 4 (141,59 mAh g −1 ), y la segunda capacidad de descarga más alta se observó para LiCr 0.025 Ni 0.4875 Mn 1.4875 O 3.95 F 0.05 (139,38 mAh g −1 ). Sin embargo, a otras velocidades altas de 0.5, 2, 5 y 10 C, las capacidades de descarga específicas del LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 fueron los más altos, que fueron 128,70, 123,62, 119,63 y 97,68 mAh g −1 , respectivamente. Cuando se deshace LiNi 0.5 Mn 1.5 O 4 se descarga a una velocidad de 2 C, la atenuación de su capacidad de descarga específica es más evidente. A una velocidad de descarga de 5 C, la estructura de los materiales puede sufrir daños graves. Como cantidad de dopaje y sustitución de Cr 3+ aumenta, la estabilidad del ciclismo aumenta. Una cantidad de dopaje más alta reducirá la capacidad de descarga específica del material, haciendo que la meseta de 4.1 V sea más obvia y disminuyendo la densidad de energía de las baterías. Por un lado, debido a la pequeña polarización a baja tasa, el efecto de polarización mostró pequeñas diferencias antes y después del dopaje. Sin embargo, la cantidad de material activo disminuyó después del dopaje, lo que resultó en una capacidad específica más baja. Por otro lado, debido a la gran polarización a alta velocidad y al coeficiente de difusión de iones de litio mejorado, el LiNi 0.5 dopado Mn 1.5 O 4 el cátodo exhibió una mayor capacidad específica. Este resultado indica que una cantidad adecuada de Cr 3+ , F - El codopaje puede conducir a una excelente estabilidad en el ciclismo y capacidad de frecuencia.
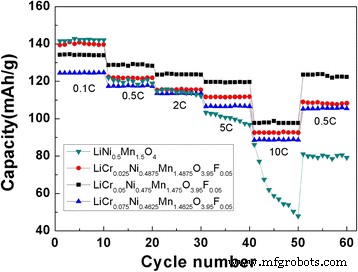
Rendimiento de ciclismo del LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) a diferentes tasas
La Figura 7 muestra claramente el rendimiento de ciclismo del LiNi 0.5 Mn 1.5 O 4 y LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 muestras después de 50 ciclos a 2 C. Las capacidades de descarga inicial de LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 y LiNi 0.5 Mn 1.5 O 4 fueron 123,62 y 114,77 mAh g −1 , respectivamente, lo que indica que LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 tiene una mayor capacidad de descarga inicial que LiNi 0.5 sin dopar Mn 1.5 O 4 . En consecuencia, LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 podría ofrecer una capacidad de descarga reversible de 121,02 mAh g −1 con una capacidad de retención del 97,9% después de 50 ciclos, mientras que LiNi 0.5 Mn 1.5 O 4 solo mantuvo una capacidad de descarga reversible de 106,24 mAh g −1 con una capacidad de retención del 92,6%. Las retenciones de capacidad de LiCr 0.025 Ni 0.4875 Mn 1.4875 O 3.95 F 0.05 y LiCr 0.075 Ni 0.4625 Mn 1,4625 O 3.95 F 0.05 fueron 95.0 y 94.5%, respectivamente, lo que indica que LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 tiene una buena retención de capacidad a altas velocidades entre todas las muestras. El material dopado tiene una tasa de retención de capacidad más alta debido a la energía de unión del Cr-O, que es más fuerte que la energía de unión del Ni-O y Mn-O y estabiliza la estructura de la espinela. Además, la incautación de la capacidad electrónica de F - era más fuerte y más estable después de la unión con Ni, Mn y Cr, mejorando así la estabilidad de la estructura de la espinela. Mientras tanto, el dopaje también redujo la erosión del material por HF en la solución de electrolito y la pérdida irreversible de sustancia activa durante el proceso de ciclado. Wang y col. [30] informó que LiNi 0.4 Cr 0.15 Mn 1,45 O 4 puede ofrecer una capacidad de descarga reversible de 139,7 mAh g −1 después de 40 ciclos, lo que corresponde a una retención de capacidad del 97,08%. Li y col. [31] informó las capacidades de descarga inicial de LiNi 0.5 Mn 1.5 O 3.9 F 0.1 a 0.1, 0.5, 1, 2 y 5 C fueron 129.07, 123.59, 118.49, 114.49 y 92.57 mAh g −1 , respectivamente.
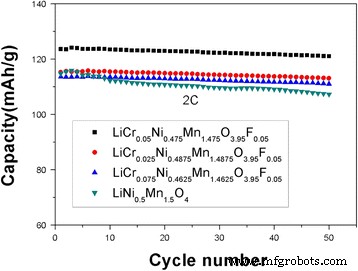
Rendimiento de ciclismo de LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) a 2 C
CV y EIS realizaron un análisis más detallado del rendimiento electroquímico. La Figura 8 muestra las curvas CV de LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 y fase pura LiNi 0.5 Mn 1.5 O 4 . La diferencia de potencial de estos dos materiales fue de 0,298 V. El LiNi 0.5 Mn 1.5 O 4 El potencial de pico de oxidación fue de 4.861 V, mientras que el potencial de pico de reducción fue de 4.563 V. La corriente de pico de oxidación ( I Pa ) fue de 2.242 mA, y la corriente de pico de reducción ( I PC ) era 2.288 mA, por lo que el I Pa / Yo PC la relación fue de 0,9799. El LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 El potencial de pico de oxidación fue de 4.864 V, el potencial de pico de reducción fue de 4.578 V y la diferencia de potencial fue de 0.286 V. La I Pa era de 1,273 mA, el I PC fue de 1.277 mA, y el I Pa / Yo PC la proporción fue 0,9968 (aproximadamente 1). Los resultados anteriores indicaron que los materiales codopados tenían una buena reversibilidad de la intercalación / desintercalación de iones de litio y una eficiencia culómbica mejorada.
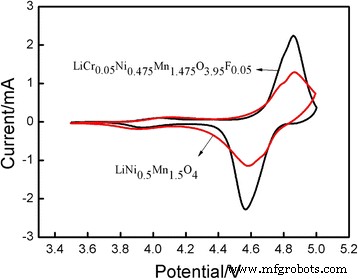
Voltamograma cíclico de LiNi 0.5 Mn 1.5 O 4 y LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05
La Figura 9 muestra los patrones EIS de las muestras. Todos los espectros EIS de la figura consisten en dos semicírculos en la región de frecuencia alta a media y una línea inclinada en la región de baja frecuencia. El semicírculo en la región de alta frecuencia corresponde a los iones de litio que pasan a través de la resistencia de la película superficial del electrolito ( R s ). El semicírculo en la región de frecuencia media corresponde a la resistencia de transferencia de carga ( R ct ), y la línea inclinada en la región de baja frecuencia es la impedancia de Warburg ( Z w ), que está relacionado con la difusión de iones de litio en los materiales. Como se ve en la Figura 7, el dopaje disminuyó la R s , lo que contribuyó a mejorar la difusividad de los iones de litio, la conductividad y la capacidad de velocidad de los materiales.
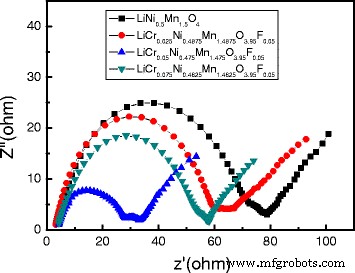
Patrones de EIS de LiNi 0.5 Mn 1.5 O 4 y LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075)
La gráfica de Nyquist del circuito analógico equivalente instalado por el software ZsimpWin se muestra en la Fig. 10. En este circuito, R e y R s representan la resistencia a los electrolitos y la resistencia de contacto interfacial partícula a partícula de la película SEI. R ct es la resistencia de transferencia de carga y Z w representa la impedancia de Warburg causada por la difusión de iones de litio. CPE y CPEdl son elementos de fase constante de la membrana de electrolito sólido y la capacitancia de doble capa de la interfaz electrodo-electrolito, respectivamente [32]. Los parámetros de ajuste del circuito analógico equivalente se resumen en la Tabla 2.
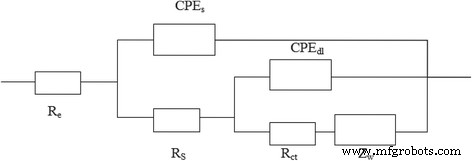
El circuito equivalente para las gráficas de Nyquist
Estudios anteriores han sugerido que el coeficiente de difusión de los iones de litio está asociado con el factor de Warburg, que puede calcularse mediante la línea inclinada en la región de baja frecuencia. El coeficiente de difusión de iones de litio se calculó mediante la regla de Fick utilizando la siguiente ecuación:[33]
$$ D =\ frac {R ^ 2 {T} ^ 2} {2 {A} ^ 2 {n} ^ 4 {F} ^ 4 {C} ^ 2 {\ sigma} ^ 2} $$ (1)donde D es el coeficiente de difusión de iones de litio, T es la temperatura absoluta, R es la constante del gas, A es el área de la superficie del electrodo, n es el número de transferencia de electrones, F es la constante de Faraday, C es la concentración molar de iones de litio, y σ es el factor de Warburg, que es la pendiente de la línea inclinada en la Fig. 7.
Como se ve en la Tabla 2, la R s Los valores de las muestras dopadas disminuyeron considerablemente en comparación con la muestra no dopada, y la R s valor de LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 disminuyó mucho. La disminución de la R s El valor indica que Cr 3+ , F - El codopaje puede inhibir el crecimiento de la película SEI hasta cierto punto, lo que puede deberse a la F - reacciones secundarias entre el material del electrodo y la solución de electrolito. Un valor de resistencia de transferencia de carga más bajo indica una polarización electroquímica más baja, lo que conducirá a una mayor capacidad de velocidad y estabilidad cíclica. LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 exhibió la R más baja ct valor (24,9 Ω) y el coeficiente de difusión de litio más alto (1,51 × 10 −10 cm 2 s −1 ) entre todas las muestras, lo que indica que su polarización electroquímica es la más baja y la movilidad de iones de litio de LiNi 0.5 Mn 1.5 O 4 puede mejorarse eficazmente mediante la sustitución del compuesto aniónico-catiónico. El EIS también se puede utilizar para comparar el tamaño de la conductividad electrónica. La menor resistencia de transferencia de carga del Cr 3+ y F - codopaje LiNi 0.5 Mn 1.5 O 4 indica una conductividad electrónica mayor que la del LiNi 0.5 prístino Mn 1.5 O 4 . La conductividad electrónica de LiNi 0.5 Mn 1.5 O 4 es aproximadamente 3,88 × 10 −5 S cm −1 , mientras que las conductividades electrónicas de LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075) las muestras fueron 6.19 × 10 - 5 S cm -1 , 1,25 × 10 -4 S cm −1 y 5,98 × 10 −5 S cm −1 , respectivamente. De hecho, LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 tiene el mejor rendimiento electroquímico entre las cuatro muestras. La disminución de R ct y el aumento de D indicar que la cantidad adecuada de Cr 3+ , F - el codopaje tiene un efecto positivo en la actividad de reacción electroquímica del material.
Conclusiones
El Cr 3+ , F - análogo codopado de LiNi 0.5 Mn 1.5 O 4 (LiCr x Ni 0.5−0.5x Mn 1,5−0,5x O 3.95 F 0.05 ( x =0.025, 0.05, 0.075)) fue sintetizado por el método de estado sólido a alta temperatura. Los patrones XRD de los materiales mostraron que Cr 3+ y F - sustituyó con éxito algunos de los Ni 2+ , Mn 4+ , Mn 3+ y O 2- átomos en el material de espinela y no existían picos de impurezas. Las capacidades de descarga específicas de LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 a 0.1, 0.5, 2, 5 y 10 C fueron 134.18, 128.70, 123.62, 119.63 y 97.68 mAh g −1 , respectivamente. La capacidad de descarga específica fue de 121,02 mAh g −1 después de 50 ciclos a 2 C, que es del 97,9% de la capacidad de descarga inicial. La tasa de retención de capacidad de LiCr 0.05 Ni 0.475 Mn 1.475 O 3.95 F 0.05 fue el más grande entre las muestras. Los materiales tenían buena cristalinidad y el mayor número de espinelas octaédricas estaba bien distribuido. Cr 3+ , F - El codopado de los materiales mejoró significativamente la capacidad de descarga específica a mayor velocidad, mejoró la estabilidad del ciclo, mejoró la reversibilidad de los iones de litio y redujo el valor de impedancia.
Nanomateriales
- Compuesto híbrido Nanoestructurado de sílice / oro-celulosa-Amino-POSS mediante el proceso Sol-Gel y sus propiedades
- Compuesto mecánico de LiNi0.8Co0.15Al0.05O2 / Nanotubos de carbono con rendimiento electroquímico mejorado para baterías de iones de litio
- Síntesis fácil de nanopartículas de SiO2 @ C ancladas en MWNT como materiales de ánodo de alto rendimiento para baterías de iones de litio
- Síntesis fácil de compuesto de CuSCN coloreado y conductor recubierto con nanopartículas de CuS
- Propiedades eléctricas de materiales compuestos con alineación asistida por campo eléctrico de rellenos de nanocarbono
- Compuesto negro de acetileno / MoS2 de pocas capas como material de ánodo eficiente para baterías de iones de litio
- Na4Mn9O18 / Compuesto de nanotubos de carbono como material de alto rendimiento electroquímico para baterías acuosas de iones de sodio
- Compuesto de grafeno / Si integrado fabricado por reducción térmica de magnesio como material anódico para baterías de iones de litio
- Síntesis fácil y respetuosa con el medio ambiente de nanocables de Co3O4 y su prometedora aplicación con grafeno en baterías de iones de litio
- Síntesis e investigación de nanocables de CuGeO3 como materiales anódicos para baterías avanzadas de iones de sodio
- Mejora del rendimiento electroquímico de la estructura de espinela Material del cátodo LiNi0.5-xGaxMn1.5O4 mediante dopaje con Ga



