Un nuevo método sin solvente orgánico para nanofármaco dirigido para mejorar la eficacia contra el cáncer
Resumen
Dado que el grupo hidrofóbico es siempre esencial para la síntesis de las nanopartículas cargadas con el fármaco, la mayoría de los métodos se basan en gran medida en solventes orgánicos, que pueden no eliminarse por completo y pueden ser una amenaza potencial para los pacientes. En este estudio, hemos sintetizado completamente nanoagujas (HFND) modificadas con folato (FA) cargadas con 10-hidroxicamptotecina (HCPT) para una terapia contra el cáncer altamente eficiente con alta carga de fármaco, propiedad de focalización y capacidad de imagen. Cabe señalar que no se utilizó disolvente orgánico en el proceso de preparación. El estudio de captación celular in vitro y el estudio de distribución in vivo mostraron que los HFND, con FA en la superficie, revelaron una propiedad de orientación obvia y entraron en las células HeLa más fácilmente que las nanoagujas de quitosano-HCPT sin FA modificado (ND). Las pruebas de citotoxicidad ilustraron que los HFND poseían una mejor capacidad de destrucción de las células HeLa que el fármaco individual o los ND en la misma dosis, lo que indica su buen efecto anticancerígeno. El experimento anticáncer in vivo reveló además los efectos anticancerosos pronunciados y los efectos secundarios más bajos de los HFND. Este nuevo método sin solvente orgánico conducirá a un sistema prometedor de administración sostenida de fármacos para el diagnóstico y tratamiento del cáncer.
Antecedentes
En el transcurso de las últimas dos décadas, la concentración de la investigación se centró en mejorar las propiedades farmacocinéticas subóptimas de la quimioterapia para mejorar su eficacia [1, 2]. Se ha logrado un progreso significativo y se han preparado con éxito muchos sistemas de administración de fármacos multifuncionales basados en nanopartículas, que demuestran una amplia gama de propiedades combinadas, como la circulación prolongada [3, 4], la focalización [5,6,7], la formación de imágenes [8 , 9,10], sensibilidad al pH [11, 12] y liberación sostenida del fármaco [9, 13].
En los últimos años, la forma de las partículas no esféricas ha atraído cada vez más la atención por su efecto potencial sobre la administración de fármacos [14, 15, 16, 17, 18, 19]. Ya ha habido pruebas de que la forma influye en muchas propiedades de las partículas, como la biodistribución y la degradación [20, 21, 22]. Sobre todo, se demostró que la internalización celular depende en gran medida de la forma [23, 24, 25]. Porque las partículas deben poder entrar en las células cancerosas y actuar sobre sus dianas terapéuticas para matarlas. Y muchos estudios han encontrado que las células cancerosas prefieren partículas con una relación de aspecto alta [10, 26].
Sin embargo, la mayoría de estos métodos se basan en gran medida en disolventes orgánicos, principalmente debido al grupo hidrofóbico necesario en los procesos de preparación de nanopartículas [27]. Estos disolventes orgánicos pueden ser residuales dentro de las partículas y no pueden eliminarse por completo mediante prácticas convencionales, como la destilación a presión reducida o la liofilización. Como resultado, quedan trazas de disolventes orgánicos en el medicamento, que se denominan disolventes residuales. Aunque los disolventes residuales son muy pocos y pueden cumplir con las instrucciones especiales publicadas en las farmacopeas que han estado controlando estrictamente las cantidades máximas permitidas de los disolventes residuales en los productos farmacéuticos, los disolventes residuales se acumularán en el cuerpo y pueden acentuar la enfermedad o causar otros problemas graves. asuntos. Por tanto, los fabricantes han estado aspirando a minimizar la cantidad de disolventes orgánicos utilizados en el proceso de producción de fármacos. Por lo tanto, será un gran salto para la medicina, la salud humana y el medio ambiente utilizar la química "verde" en la industria farmacéutica, aunque enfrenta muchas dificultades.
En este estudio, desarrollamos nanoagujas (HFND) modificadas con folato (FA) cargadas con HCPT con una relación de aspecto alta y puntas afiladas mediante un método completamente ecológico sin utilizar ningún disolvente orgánico. La precipitación de pH controlado de HCPT y quitosano modificado con FA (CS-FA) conduce a la nucleación de nanoagujas con HCPT nanocristalino como núcleo envuelto con CS-FA como estabilizadores estéricos. Se descubrió que los HFND poseen buenas propiedades de focalización y capacidad de formación de imágenes. A continuación, se investigaron sistemáticamente los estudios in vitro e in vivo. Estos resultados destacan el gran potencial de las nanoagujas con funciones de imagen modificadas con FA para la quimioterapia de alta eficacia, así como para las aplicaciones de diagnóstico del cáncer.
Métodos
Materiales
Todos los productos químicos son de calidad analítica y se utilizan tal como se reciben sin purificación adicional. Se utilizó agua desionizada (DI) en todos los experimentos. El FA se adquirió en Bio Basic Inc. La 10-hidroxicamptotecina (HCPT; pureza> 99%) se adquirió en Lishizhen Pharmaceutical Co., Ltd. El quitosano (Mw =70 000, 90% de grado de desacetilación) se obtuvo en Zhejiang Aoxing. N -Hidroxisuccinimida (NHS) y clorhidrato de 1- (3-dimetilaminopropil) -3-etilcarbodiimida (EDC) se adquirieron de Sigma-Aldrich.
Síntesis del conjugado FA-quitosano
Se añadieron FA (10 mg), quitosano (20 mg), EDC (4 mg) y NHS (4 mg) a 2 ml de solución tampón PBS (pH 5,5) y se agitaron a ta durante 12 h para obtener la suspensión de CS-FA. . Luego, la suspensión se dializó frente a una solución tampón (pH 10) para eliminar el exceso de moléculas de FA. La suspensión restante se centrifugó (5000 rpm) y se liofilizó durante 24 h para obtener el polvo seco de CS-FA.
Preparación de HFND
Se disolvió HCPT (10 μg) en 200 μL de solución acuosa de NaOH (0.1 M) para obtener la solución A, y CS-FA (10 μg) se disolvió en 200 μL de HCl (0.1 M) para obtener la solución B. Posteriormente, la solución A y la solución B se añadieron gota a gota a agua pura (1 ml) con agitación vigorosa durante 30 s, y la mezcla se sonicó (200 W) en un baño de hielo durante 6 min. La suspensión se centrifugó (10.000 rpm, 5 min) y se liofilizó durante 24 h. Para la preparación de ND, se utilizó la solución de quitosano en sustitución de la solución B.
Caracterización
La morfología de los HFND se examinó mediante SEM (UV-70) a 15 kV. El tamaño y los valores de potencial zeta se determinaron mediante una máquina Malvern Zetasizer Nano-ZS (Malvern Instruments, Malvern). Se realizaron tres mediciones paralelas para determinar los valores medios. La cristalinidad de los HFND se analizó con XRD (X'pert PRO). El contenido de FA en HFND se determinó mediante espectrofotometría UV (Beckman DU800). Todas las muestras se analizaron a 281 nm. La curva estándar se trazó de antemano para determinar la concentración de FA. El contenido de HCPT en HFND se determinó mediante espectrofotometría de fluorescencia a 383 nm. La curva estándar se trazó de antemano para determinar la concentración de HCPT. El contenido y la eficiencia de atrapamiento se calcularon mediante las Ecs. (1, 2, 3 y 4):
$$ \ mathrm {Droga} \ \ mathrm {cargando} \ \ mathrm {contenido} \ \ mathrm {de} \ \ mathrm {HCPT} \ \ left (\% \ right) =\ left (\ mathrm {peso} \ \ mathrm {de} \ \ mathrm {HCPT} \ \ mathrm {en} \ \ mathrm {HFNDs} \ right) / \ left (\ mathrm {peso} \ \ mathrm {de} \ \ mathrm {HFNDs} \ right) \ times 100 \% $$ (1) $$ \ mathrm {Atrapamiento} \ \ mathrm {eficiencia} \ \ mathrm {de} \ \ mathrm {HCPT} \ left (\% \ right) =\ left (\ mathrm { peso} \ \ mathrm {de} \ \ mathrm {droga} \ \ mathrm {en} \ \ mathrm {HFNDs} \ right) / \ left (\ mathrm {peso} \ \ mathrm {de} \ \ mathrm {alimentación} \ \ mathrm {droga} \ right) \ times 100 \% $$ (2) $$ \ mathrm {Porcentaje} \ \ mathrm {de} \ \ mathrm {F} \ mathrm {A} \ \ mathrm {in} \ \ mathrm {la} \ \ mathrm {conjugación} \ \ left (\% \ right) =\ left (\ mathrm {peso} \ \ mathrm {de} \ \ mathrm {FA} \ \ mathrm {in} \ \ mathrm {conjugación} \ derecha) / \ izquierda (\ mathrm {peso} \ \ mathrm {de} \ \ mathrm {conjugación} \ derecha) \ veces 100 \% $$ (3) $$ \ mathrm {Droga} \ \ mathrm {cargando} \ \ mathrm {contenido} \ \ mathrm {de} \ \ mathrm {F} \ mathrm {A} \ \ left (\% \ right) =\ left (1- \ mathrm {Droga} \ \ mathrm { cargando} \ \ mathrm {contenido} \ \ mathrm { de} \ \ mathrm {HCPT} \ right) \ times \ mathrm {porcentaje} \ \ mathrm {de} \ \ mathrm {F} \ mathrm {A} \ \ mathrm {in} \ \ mathrm {the} \ \ mathrm {conjugación} \ veces 100 \% $$ (4)Estudio de liberación de fármacos in vitro
El estudio de liberación de fármacos in vitro de HFND se realizó mediante la técnica de diálisis. Los HFND se dispersaron en una solución tampón PBS (10 ml) y se colocaron en una bolsa de diálisis previamente hinchada (MWCO 3500 Da). A continuación, la bolsa de diálisis se sumergió en PBS (0,1 M, 200 ml, pH 7,4) y se hizo oscilar continuamente en una incubadora con agitador (100 rpm) a 37ºC. Todas las muestras se analizaron mediante espectrofotometría de fluorescencia.
Imágenes confocales de células
La formación de imágenes confocal de las células se realizó utilizando un microscopio confocal de barrido láser Leica. La obtención de imágenes de HCPT se llevó a cabo bajo la excitación láser de 382 nm y la emisión se recogió en el rango de 500 a 550 nm. Las células HeLa se sembraron y preincubaron a 37 ° C durante 24 h (5% CO 2 ) antes de incubar con los HFND durante 8 h.
Captación celular medida por medición de fluorescencia
Las células HeLa se sembraron en una placa de 24 pocillos (1 × 10 6 mL / pocillo). Luego, la placa se incubó a 37 ° C durante 24 h en una atmósfera humidificada (5% CO 2 ). A continuación, las células se incubaron con ND y HFND a concentraciones equivalentes de HCPT. Las células tratadas con fármaco se incubaron durante 6 ha 37ºC, seguido de lavado dos veces con PBS y digerido con tratamiento con tripsina (0,05%) / EDTA. Las suspensiones se centrifugaron (1000 rpm, 4 ° C) durante 4 min. Los sedimentos celulares se lavaron con PBS para eliminar la fluorescencia de fondo en el medio. Después de dos ciclos de lavado y centrifugación, las células se resuspendieron con 2 ml de PBS y se rompieron completamente mediante sonicación vigorosa. La cantidad de HCPT en la mezcla sonicada se analizó mediante espectroscopía de fluorescencia (excitación a 382 nm). Se midieron las células en blanco en ausencia de fármaco para determinar el nivel de autofluorescencia de las células como control.
Ensayos de citotoxicidad
La citotoxicidad de las HFND se determinó mediante ensayo MTT. Brevemente, se sembró un número adecuado de células HeLa en fase exponencial por quintuplicado en una microplaca de fondo plano de 96 pocillos y se incubaron durante 24 h en presencia de fármaco / partículas. En este estudio, se agregaron 20 μL de solución de bromuro de 3- (4,5-dimetil-2-tiazolil) -2,5-difenil-2-H-tetrazolio (MTT) (5 mg / ml en PBS) en cada pocillo, y las placas se incubaron a 37 ° C durante otras 4 h. Posteriormente, se añadió un volumen de 150 μL de dimetilsulfóxido (DMSO) y la placa se agitó en un chader de baño de agua a 37 ° C durante 30 min. La absorbancia a 570 nm se midió usando un lector de microplacas (modelo 680; Bio-Rad).
Biodistribución
Para la obtención de imágenes de fluorescencia in vivo, se encapsuló DiR en los ND y HFND. Se administraron por vía intravenosa DiR-ND y DiR-HFND a ratones desnudos portadores de tumores HeLa a través de las venas de la cola a una dosis equivalente de DiR-HCPT por kilogramo de peso corporal del ratón. A intervalos de tiempo predeterminados, los ratones se anestesiaron y se tomaron imágenes con el sistema de formación de imágenes Maestro in vivo (Cambridge Research &Instrumentation, Woburn, MA, EE. UU.). Después de 24 h, se sacrificaron los ratones y se extirpó el tumor, así como los órganos principales (bazo, hígado, riñón, pulmón y corazón), seguido de un lavado de la superficie con NaCl al 0,9% para la obtención de imágenes ex vivo.
Inhibición de tumores in vivo
Cuando el volumen del tumor HeLa de los ratones portadores del tumor HeLa era de aproximadamente 60 mm 3 , los ratones se dividieron aleatoriamente en cuatro grupos y se trataron mediante inyección intravenosa de NaCl al 0,9%, HCPT libre, ND y HFND cada 3 días a una dosis de 80 μg de HCPT por ratón. El volumen del tumor y el peso corporal se controlaron cada 3 días. El volumen del tumor se calculó mediante la siguiente fórmula:volumen del tumor =0,5 × largo × ancho 2 .
Después de 21 días, se sacrificaron los ratones, seguido de la extirpación y el peso de los tumores. Luego, los tumores se fijaron en paraformaldehído al 4% durante la noche a 4 ° C, se incrustaron en parafina, se seccionaron (4 μm), se tiñeron con hematoxilina y eosina (H&E) y se observaron mediante un sistema de microscopía digital.
Análisis estadístico
La significación estadística de los resultados del tratamiento se evaluó mediante la t de Student prueba (de dos colas); P <0,05 se consideró estadísticamente significativo en todos los análisis (nivel de confianza del 95%).
Resultados y discusión
Síntesis del conjugado FA-quitosano
Primero, conjugamos FA con quitosano mediante una reacción de amidación entre el grupo terminal carboxílico de FA y el amidógeno de quitosano (Fig. 1). La estructura de la conjugación (CS-FA) se confirmó mediante espectroscopía de infrarrojos por transformada de Fourier (FT-IR). Como se muestra en la Fig. 2, el pico a 1605 / cm se hizo más fuerte en el espectro IR de CS-FA que el del quitosano, correspondiente a la vibración de estiramiento C =O del nuevo enlace amido. El resultado indicó que FA se conjugó con éxito con el amidógeno del quitosano mediante un enlace amido. Para investigar el porcentaje de FA en la conjugación, se estableció una curva estándar mediante espectrofotometría ultravioleta. Y el porcentaje de FA se calculó en 23,4 ± 2,5%.
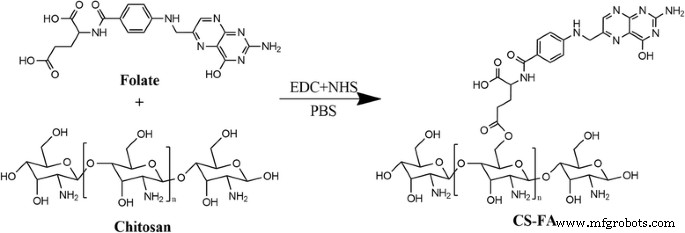
Ruta sintética del conjugado CS-FA
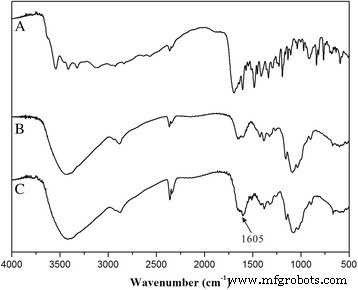
Espectros FTIR de ( a ) FA, ( b ) quitosano y ( c ) CS-FA
Preparación de HFND
Es de conocimiento común que la solubilidad de HCPT en agua es extremadamente pobre, pero puede disolverse en álcali. El quitosano es todo lo contrario:soluble en ácidos e insoluble en agua. Y el CS-FA mostró una solubilidad similar al quitosano. Por tanto, el HCPT y el CS-FA se disolvieron en álcalis y ácidos, respectivamente. Cuando se mezclaban las dos soluciones, se producía una reacción de neutralización. La mezcla producida se controló para que fuera neutra, lo que sería un mal disolvente tanto para HCPT como para CS-FA. La disminución de la solubilidad provocada por los cambios de pH brindó una oportunidad para la nucleación de nanoagujas de HCPT y la coprecipitación acompañante de CS-FA en las nanoagujas de HCPT en crecimiento (Fig. 3a). La nucleación dinámica y la precipitación de las nanoagujas bajo ultrasonido, más la oclusión activa del ingrediente blando CS-FA, condujeron a la formación de HFND, en lugar de cristales de HCPT a granel. Para optimizar las condiciones de formulación, se diseñó un experimento de condición para estudiar el efecto de la relación de HCPT a CS-FA, potencia ultrasónica, pH de la mezcla producida y concentración de la mezcla producida sobre la morfología de HFND (Tabla 1).
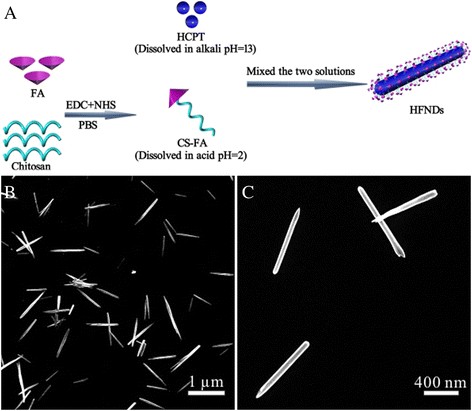
un Ilustración del método completamente verde de preparación de HFND. b , c Las imágenes SEM de HFND
La figura 4 muestra la morfología de las partículas en diferentes condiciones. Cuando CS-FA era demasiado, el exceso de CS-FA se adhería a la superficie de las partículas producidas (Fig. 4a). Si bien CS-FA era demasiado pequeño, el CS-FA no pudo detener el crecimiento de las nanoagujas de HCPT, que eran propensas a agregarse (Fig. 4b). Como la nucleación fue provocada por cambios de pH, el pH de la mezcla producida jugó un papel importante en el proceso de preparación. El pH debe controlarse a neutral, o la cristalización se dañaría (Fig. 4c). La potencia ultrasónica también tuvo una gran influencia en la morfología de las HFND. Las nanoagujas se agregarían a baja potencia (Fig. 4d) y se romperían en fragmentos a alta potencia (Fig. 4e). Además, se encontró que la concentración de la mezcla producida tenía un gran efecto sobre el tamaño de los HFND. El tamaño disminuyó al aumentar la concentración (Figs. 3b y 4f).
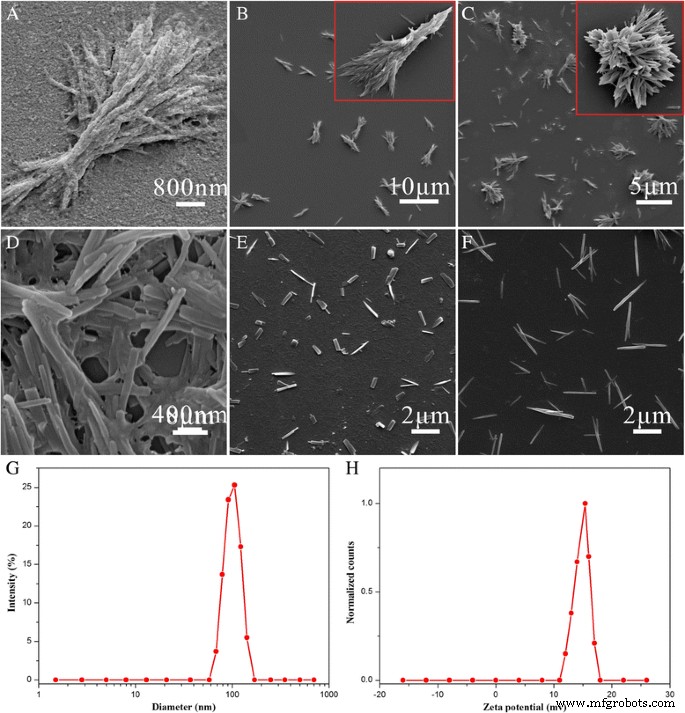
un - f Las imágenes SEM de HFND en diferentes condiciones (ver detalles en la Tabla 1). g Distribución del tamaño de partícula de los HFND. h Potencial zeta de los HFND
La Figura 3b, c muestra la morfología optimizada en forma de aguja de los HFND con una longitud media de aproximadamente 800 nm y una anchura de aproximadamente 80 nm. El resultado de la medición DLS muestra un tamaño de 104,3 ± 5,7 nm (Fig. 4g) y un potencial zeta de +16,3 ± 1,9 mv (Fig. 4h). Es más, una dispersión de HFNDs al 2% en peso mostró una buena estabilidad durante al menos 2,5 días. Dado que no hay señales de fluorescencia de CS-FA, podemos medir el contenido de carga de fármaco HCPT de los HFND utilizando las características de fluorescencia de HCPT. El contenido de carga de fármaco HCPT de los HFND fue del 70,2 ± 3,1% y la eficiencia de encapsulación fue del 83,1%. Y el contenido de FA de los HFND fue del 7,0%, que se calculó mediante el porcentaje de FA en CS-FA.
Análisis XRD
Como es bien sabido, la forma del fármaco afecta en gran medida las propiedades de las nanopartículas. Por lo tanto, es de gran importancia comprender la forma de HCPT en las HFND. Se empleó difracción de rayos X para detectar la forma de HCPT dentro de los HFND (Fig. 5). Está claro que el HCPT puro muestra muchos picos cristalinos nítidos, representativos de las características de alta cristalinidad. Si bien los picos anchos de quitosano semicristalino todavía existían en el patrón XRD de los HFND, la mayoría de los picos pertenecían a HCPT, lo que sugiere la alta cristalinidad de HCPT. En resumen, los resultados de XRD sugieren que HCPT está en estado cristalino en HFND. Además, la cinética de crecimiento de HCPT dentro de las HFND se había modificado, principalmente debido a la oclusión activa y los efectos de confinamiento de CS-FA. Para investigar el efecto de CS-FA en el proceso de cristalización, se prepararon los cristales de HCPT sin la existencia de CS-FA. La Figura 6 mostró la morfología de los cristales de HCPT. Tenían forma de varilla, con una longitud de más de 10 μm, que era totalmente diferente a la de los HFND. Esto demostró además que el CS-FA había cambiado la cinética de crecimiento de HCPT dentro de los HFND.
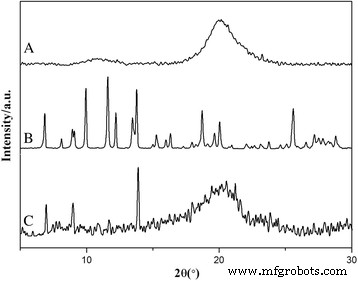
Los patrones XRD de ( a ) quitosano, ( b ) HCPT y ( c ) MHND

La imagen SEM de cristales a granel HCPT
Estudios de liberación de fármacos in vitro
Dado que el comportamiento de liberación del fármaco es una propiedad importante para un sistema de administración de fármacos, los estudios de liberación in vitro de las HFND se realizaron utilizando una técnica de diálisis, junto con polvos de HCPT libres. Todas las muestras se analizaron mediante cromatografía líquida de alta resolución (HPLC). Los perfiles de liberación se muestran en la Fig. 7. El perfil de HCPT libre mostró que al menos el 30% del fármaco se liberó en el primer tiempo de muestreo de 1 h y casi el 100% a las 18 h. Sin embargo, el perfil de liberación de las HFND parece ser una liberación prolongada y sostenida de los dos fármacos durante 48 h. La liberación prolongada del fármaco se puede atribuir a que la capa polimérica de CS-FA podría limitar la liberación del fármaco en el núcleo. Estas ventajas podrían promover la aplicación de los HFND para un sistema de administración de fármacos sostenido.
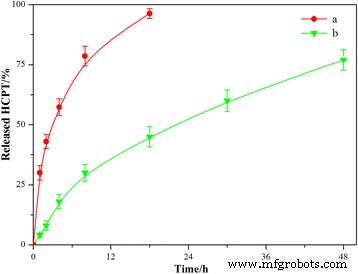
Perfiles de liberación de fármacos in vitro de los MHND en PBS (pH 7,4) a 37 ° C. ( a ) HCPT gratuito; ( b ) HFND
Captación celular
Independientemente de cómo llegue el sistema de administración de fármacos al sitio del tumor diana, por administración sistémica o por administración local directa, es de gran importancia que puedan penetrar dentro del área del tumor para actuar sobre su diana intracelular. Se realizó microscopía de barrido láser confocal (CLSM) para evaluar la captación celular de HFND. Para evaluar su eficiencia de captación celular por las células HeLa, los HFND y las nanoagujas cargadas con HCPT (ND; carga de fármaco =64,7%) se incubaron con células HeLa durante 8 ha 37 ° C (los ND se prepararon mediante HCPT y quitosano a través de el mismo método que los HFND). Como se muestra en la Fig.8, se detectó una emisión de fluorescencia mucho más intensa de HCPT en las células expuestas a los HFND que en las expuestas a los ND después de 8 h de incubación, lo que ilustra que el FA en la superficie de las partículas podría mejorar en gran medida la captación celular.
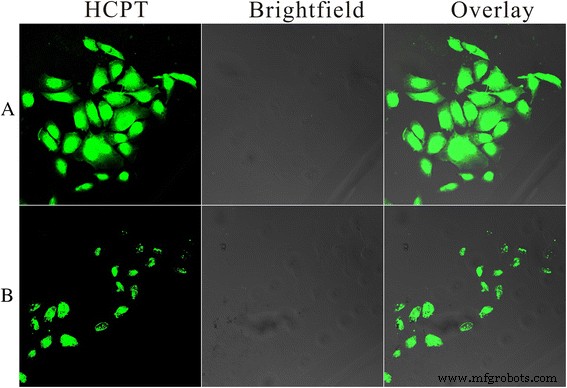
Entrega de fármaco intracelular durante 8 ha 37 ° C. Imágenes de microscopía de escaneo láser confocal de células HeLa incubadas con a HFND y b ND
Para confirmar además que la tasa de internalización celular de los HFNDs era más rápida, se realizaron mediciones de fluorescencia para cuantificar la diferencia de intensidad de emisión de fluorescencia de HCPT en las células HeLa. De acuerdo con las observaciones de CLSM, los HFND fueron mucho más favorecidos que los ND en el proceso de internalización celular (Fig. 9). Esto validó aún más la propiedad de focalización de los HFND.
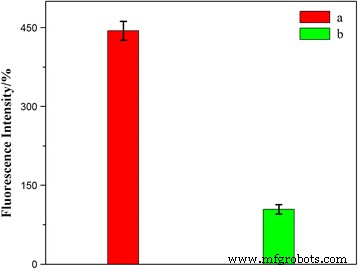
Mediciones de fluorescencia de las células HeLa incubadas con HFND ( a ) y ND ( b ) durante un período de incubación de 8 horas a 37 ° C; P <0.05
Ensayos de citotoxicidad
Para investigar más a fondo la posibilidad de utilizar los HFND para la administración local de fármacos, probamos la capacidad de destrucción de los HFND en las células cancerosas. La citotoxicidad de las HFND se evaluó utilizando el ensayo MTT con las células HeLa. Se utilizaron como control las HCPT y ND libres que contenían concentraciones equivalentes de HCPT. Las concentraciones de HCPT fueron 0.50, 1.00, 2.00, 4.00, 8.00 y 16 μg / mL. Como se muestra en la Fig. 10, la citotoxicidad de HCPT fue mayor que la de los ND, principalmente debido a la velocidad de liberación del fármaco mucho más rápida de HCPT que la de los ND. Sin embargo, la citotoxicidad de las HFND fue mayor que la de HCPT. Esto probablemente se debió a la propiedad de focalización de FA en la superficie de los HFND, que podría ayudar a las partículas a ingresar a las células y matarlas. Por tanto, los HFND presentaron una capacidad de destrucción de las células cancerosas sorprendentemente buena. Estos resultados confirman que los FA en la superficie de los HFND pueden aumentar la absorción celular de las partículas y, por lo tanto, aumentar su capacidad de destrucción de las células cancerosas al unirse con los receptores de FA.
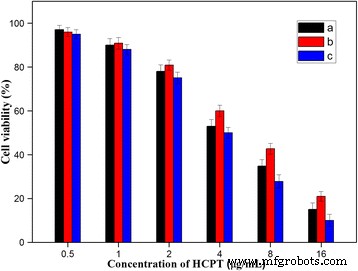
Viabilidad celular in vitro de células HeLa tratadas con ( a ) HCPT gratis, ( b ) ND y ( c ) HFND después de 24 h de incubación. P <0.05
Biodistribución
Para evaluar la capacidad de diana tumoral de las nanoagujas de fármacos duales, se utilizó DiR como una sonda de fluorescencia del infrarrojo cercano para encapsularla en HCPT, ND y HFND libres a la concentración de DiR equivalente. Se inyectaron por vía intravenosa NaCl al 0,9%, DiR-ND y DiR-HFND en los tumores portadores de ratones derivados de células HeLa de carcinoma cervical humano y se investigaron sus biodistribuciones in vivo.
Como se muestra en la Fig. 11a, aunque no se detectaron señales fluorescentes en los sitios tumorales en el grupo de DiR-ND, se visualizó una fuerte señal fluorescente en el grupo DiR-HFND. Cuando los recuentos de fluorescencia total se redujeron todo el tiempo, la intensidad de la señal en el sitio del tumor aumentó de 1 a 12 h, lo que indica que las HFND se estaban acumulando en los tumores durante este tiempo. Después de 24 h, los ratones se sacrificaron y los tejidos tumorales, así como los tejidos normales, se aislaron para la obtención de imágenes y análisis ex vivo (Fig. 11b, c). La intensidad de fluorescencia en el tejido tumoral de los ratones tratados con DiR-HFNDs fue significativamente más alto que los otros ratones. Se validó que la introducción de FA ofreció a las nanoagujas una excelente eficacia de orientación tumoral, lo que condujo a un tratamiento contra el cáncer de mayor eficacia.
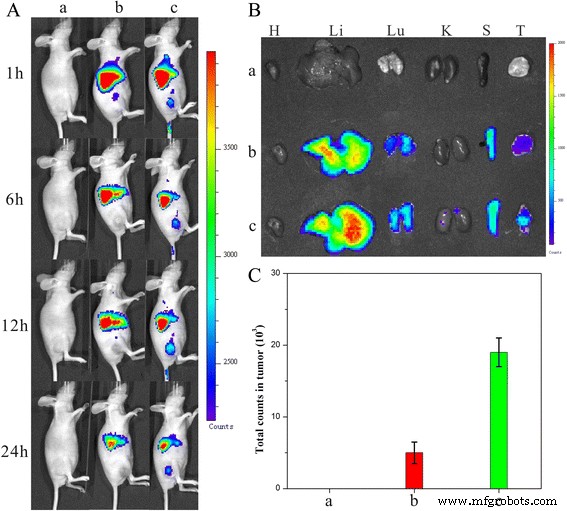
un Distribución y acumulación tumoral de nanopartículas DiR en ratones portadores de tumores HeLa que recibieron inyección intravenosa de las formulaciones indicadas. b Imágenes de fluorescencia ex vivo del tumor y tejidos normales recogidos de los ratones desnudos portadores de tumor HeLa sacrificados. Las imágenes fueron tomadas 24 h después de la inyección. H, Li, Lu, K, S y T representan el corazón, hígado, pulmón, riñón, bazo y tumor, respectivamente. c Intensidad de fluorescencia DiR en tejidos tumorales recogidos a las 24 h después de la inyección sistémica. P <0,05. ( a ) 0,9% de NaCl, ( b ) DiR-ND y ( c ) DiR-HFND
Inhibición de tumores in vivo
Para evaluar los efectos antitumorales in vivo, generamos xenoinjertos tumorales HeLa en ratones Kunming y evaluamos el crecimiento tumoral después de la administración intravenosa de NaCl al 0,9%, HCPT libre, ND y HFND con la misma concentración de HCPT. En comparación con los ratones tratados con NaCl al 0,9% como control, la tasa de crecimiento de los tumores en los ratones que recibieron HCPT o ND libres disminuyó gradualmente (Fig. 12a), lo que indica la inhibición del crecimiento tumoral significativamente eficaz. Es de destacar que los HFND condujeron a la inhibición más pronunciada del crecimiento tumoral. Al final del experimento, los tumores se extirparon y se pesaron. Como se muestra en la Fig. 12c, se encontró que las nanoagujas de doble fármaco tenían una eficacia terapéutica superior en comparación con los otros grupos ( P <0,05). En las imágenes histológicas se mostró una evidencia adicional del efecto anticanceroso mejorado de las nanoagujas de doble fármaco (Fig. 12d). Para cualquier sistema de administración de fármacos, se debe considerar la toxicidad sistémica que generalmente se encuentra en el tratamiento libre mediado por HCPT para garantizar la seguridad y la eficacia. En este trabajo, la administración del HCPT libre dio como resultado la apatía / pereza y la pérdida de peso corporal severa de los ratones (Fig. 12b), indicativo de los efectos secundarios indeseables de la quimioterapia. Por el contrario, no se mostraron efectos secundarios obvios en los ratones tratados con ND y HFND. En general, se indicó que las HFND con efectos anticancerosos superiores y una toxicidad más baja mejorarían en gran medida la eficacia de la terapia de calidad de vida.
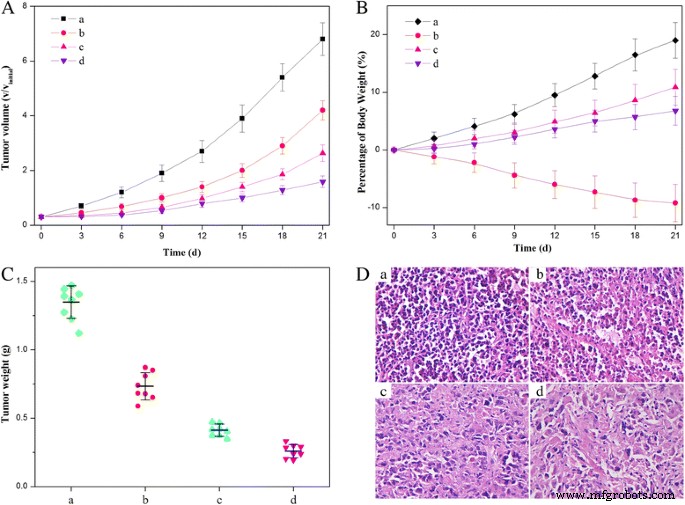
Efectos anticancerígenos de diferentes (nano) formulaciones. un Cambio de volumen del tumor en ratones durante el tratamiento. b Cambio de peso de los ratones portadores de tumores durante el tratamiento. c Pesos de los tumores HeLa después de ser tratados con diferentes formulaciones. d Corte histológico del tumor de los ratones tras el tratamiento. ( a ) Solución acuosa de NaCl al 0,9%, ( b ) HCPT gratis, ( c ) ND y ( d ) HFND. Todas las formulaciones utilizaron la misma concentración de HCPT en ratones con tumor HeLa. P <0.05
Conclusiones
El estudio en este documento presenta un enfoque completamente ecológico para obtener nanoagujas cargadas con HCPT modificadas con FA para la quimioterapia altamente eficiente con alta carga de fármaco, propiedad de focalización y capacidad de formación de imágenes. El perfil de liberación del fármaco reveló que los HFND mostraron una liberación sostenida y prolongada. El CLSM demostró la internalización celular más eficaz de HFND que de ND. El experimento MTT indicó que los HFND no solo mostraron una citotoxicidad mucho mayor que los fármacos individuales y los ND. Esto ilustró la buena propiedad de focalización de los HFND. Este trabajo abre una puerta para diseñar nuevas dosis de nanopartículas con un método completamente verde, lo que podría tener un efecto poderoso en la protección del medio ambiente en el futuro.
Nanomateriales
- El método de fabricación de moléculas artificiales gana el premio al mejor póster
- Nanofibras y filamentos para una mejor administración de fármacos
- Proveedor de automatización de ensamblajes médicos adopta un nuevo nombre para la operación en EE. UU.
- Nanopartículas de quitosano cargadas con genisteína y bioflavonoides dirigidas al receptor de folato para un efecto anticancerígeno mejorado en los cánceres de cuello uterino
- PEDOT altamente conductivo:Capa transportadora de orificios transparentes PSS con tratamiento solvente para células solares híbridas orgánicas / de silicio de alto rendimiento
- Método de postratamiento para la síntesis de nanopartículas de FePt-Fe3O4 binarias monodispersas
- Fabricación y caracterización de un nuevo catalizador anódico compuesto de nanofibras de carbono Tio2 para celdas de combustible de metanol directo mediante el método de electrohilado
- Nanocristal de Sb2O3 dopado con S:un catalizador de luz visible eficiente para la degradación orgánica
- Nuevas vías para terapias relacionadas con nanopartículas
- Preguntas y respuestas:un nuevo método para la impresión 3D de estructuras de gel diminutas
- El reto del método 5S para la industria 4.0



