Síntesis de puntos cuánticos de carbono codopados N, S ricos en piridínicos como imitadores enzimáticos eficaces
Resumen
Los puntos cuánticos de carbono codopados con N y S (N, S-CQD) con un alto nivel de dopaje N y S se sintetizaron mediante pirólisis en fase sólida de microondas en 50 s. Debido a la inyección de N piridínico dominante en la estructura conjugada, se logran simultáneamente una alta actividad catalítica que imita la enzima y un rendimiento cuántico de fotoluminiscencia.
Antecedentes
Los puntos cuánticos de carbono (CQD) que surgieron como un nuevo material de carbono de dimensión cero han recibido una gran atención debido a su alta estabilidad química, baja citotoxicidad y naturaleza electrónica y comportamientos ópticos únicos [1, 2, 3]. Con grupos de superficie activos como –OH y –CO 2 Los H, CQD se pueden recombinar con otros orgánicos o inorgánicos para diversas aplicaciones fantásticas, incluidas las bioimágenes [4, 5], los dispositivos optoelectrónicos y los fotocatalizadores para la degradación de colorantes orgánicos o la producción de hidrógeno a partir de la división del agua [6,7,8]. Muy recientemente, los resultados experimentales y teóricos confirmaron que el dopaje con heteroátomos era un método eficaz para mejorar las propiedades electrónicas y ópticas de los CQD [9, 10]. Entre los compuestos novedosos, los CQD dopados con N o los CQD codopados con nitrógeno / azufre (N, S-CQD) demostraron una eficiencia cuántica de fluorescencia o actividad fotocatalítica mucho más alta que la del prístino [11, 12]. Además, la mejora en el rendimiento de los CQD dopados con N había mostrado una correlación positiva con la cantidad de dopaje con nitrógeno [13, 14]. Aunque estos estudios certifican de manera convincente que el N-dopaje influye notablemente en las propiedades de las CQD, existen pocos informes sobre los métodos de heterodopaje efectivos para las CQD. Debido a la alta solubilidad del precursor inorgánico del dopante, las rutas de carbonización hidrotermal convencionales darían lugar a una gran cantidad de dopantes en la solución de reacción y, por lo tanto, a una cantidad de dopaje N bastante baja en los CQD finales.
En este documento, informamos sobre la síntesis de puntos cuánticos de carbono (N, S-CQD) codopados con N, S ricos en nitrógeno mediante un enfoque asistido por microondas en solo 50 s. Se eligió ácido cítrico (CA) como fuente de carbono y se utilizó tiourea no solo como fuente de nitrógeno y azufre, sino también como base débil. La concentración de nitrógeno y azufre de N, S-CQD alcanza el 12,8 y el 7,2% en peso, respectivamente, que fue aproximadamente cinco y tres veces mayor que lo informado para N-CQD y N, S co-dopado CQD [11, 14].
Métodos
Los N, S-CQD se obtuvieron de las siguientes formas:la mezcla de 0,42 g (2 mmol) de ácido cítrico monohidrato y 0,46 g de tiourea (6 mmol) se puso en un crisol de porcelana y se calentó durante 50 s en un reactor de microondas (445 W). El producto de color amarillo pardusco obtenido se añadió a 30 ml de agua desionizada para formar una suspensión amarilla y se centrifugó a 9000 rpm durante 20 min. Luego, el sobrenadante se purificó con una membrana de filtro de 0,22 μm y se dializó con agua desionizada a través de una membrana de diálisis (peso molecular retenido, 1000 Da) durante 24 h. Finalmente, el dializado se liofilizó adicionalmente al vacío. Los CQD prístinos se sintetizaron a partir de ácido cítrico monohidrato puro, y el proceso de tratamiento posterior fue el mismo que el de los CQD N, S.
La actividad de imitación enzimática de N, S-CQD para la descomposición de H 2 O 2 se midió en una solución tampón de 30 ml de ácido cítrico-hidrogenofosfato disódico (pH ≈ 3,5, 35 ° C) que contenía 1 μg ml −1 de N, S-CQD y 8 × 10 −4 M de sustrato de tetrametilbencidina (TMB). Después de 160 μL de H 2 O 2 Se añadió solución (30%) a la solución tampón incolora, se inicia la reacción y luego se toma la solución para medir la absorbancia del producto de oxidación azul de TMB a 652 nm cada 2 min. Finalmente, se calcularon las velocidades de reacción de oxidación TMB. La prueba de reutilización de N, S-CQD se realizó en el sistema de reacción que contenía 60 ml de solución tampón de ácido cítrico-hidrogenofosfato disódico y 2 μg ml −1 de N, S-CQD y 5 × 10 −3 M de sustrato TMB. La reacción comenzó como la adición de H 2 O 2 solución (0.3%, 320 μL) en la solución mezclada y tomó una pequeña cantidad de solución para medir la absorbancia a 652 nm después de 1 hora y el primer ciclo se terminó. Luego, 320 μL de H 2 fresco O 2 Se añadió una solución (0,3%) al sistema de reacción para el siguiente ciclo. Se repitieron otras reacciones de tres ciclos en la misma condición. La absorbancia correspondiente se calculó restando la última absorbancia.
Las imágenes del microscopio electrónico de transmisión (TEM) y del microscopio electrónico de transmisión de alta resolución (HRTEM) se obtuvieron en un microscopio electrónico JEM-2100 de alto voltaje (200 kV). La difracción de electrones de área seleccionada (SAED) se midió mediante FEITF20 (microscopía electrónica de transmisión de emisión de campo de alta resolución FEI) con una condición de 200 kV. Los espectros de absorción UV / vis se llevaron a cabo con UV-3600 (espectrofotómetro Shimadzu UV-VIS-NIR). Los espectros de fluorescencia se registraron en F-7000 (espectrómetro de fluorescencia de Hitachi) con la condición de 700 V. La vida útil de la fluorescencia y el FLQY se midieron mediante el FM-4P-TCSPC (Horiba Jobin Yvon). Las longitudes de onda de excitación y emisión son 358 y 436 nm, respectivamente. El difractómetro de rayos X en polvo (XRD) se caracterizó por D8 Advance (Alemania Bruker AXS Ltd.) utilizando Cu K α con la condición de 40 kV y 40 mA. Los espectros de infrarrojos por transformada de Fourier (FT-IR) se llevaron a cabo con Nicolet iS10 (espectrómetro de infrarrojos Thermo Fisher). El espectrómetro de fotoelectrones de rayos X (XPS) se obtuvo en PHI 5000 Versa (UIVAC-PHI). La TG-MS (espectrometría de masas termogravimétrica) se mide con Netzsch STA 449C con una velocidad de calentamiento de 10 K min −1 desde 35 ° C hasta una temperatura final de 450 ° C bajo el N 2 flujo de aire (10%, aire).
Resultados y discusiones
Puede verse en las imágenes TEM (Fig. 1a) que las N, S-CQD preparadas son nanoláminas delgadas uniformes y bien dispersas con un tamaño medio de 2,0 nm de diámetro. La imagen HRTEM insertada (Fig. 1a) muestra un espaciado de franjas de celosía muy claro de 0.24 nm consistente con la faceta (1120) del grafeno, lo que indica los núcleos cristalinos de N, S-CQD que podrían estar compuestos de sp 2 átomos de carbono [15, 16]. La imagen SAED insertada (Fig. 1b) muestra que los N, S-CQD son cristalinos con una franja de celosía de 0.312 nm correspondiente a los N-CQD gráficos reportados [13]. Este d El valor concuerda bien con el espaciado interplanar de (002) facetas de difracción de CQD de codopaje N, S con estructura grafítica [11]. El patrón XRD de N, S-CQDs ilustra un único pico ancho centrado en 2 θ valor de alrededor de 25,5 ° que se asignó al pico de difracción del grafeno (Fig. 1c), correspondiente al espaciado entre capas de 0,33 nm [17]. Sin embargo, g-CNQD y β-C 3 N 4 sintetizados por urea con citrato de sodio o ácido cítrico [18, 19]. A diferencia de nuestras muestras, los g-CNQD tienen dos de los picos característicos a 27,4 ° y 13,1 ° en la XRD. El pico fuerte a 27,4 ° representa el apilamiento interplanar característico de sistemas aromáticos, indexado para nitruro de carbono grafítico como el pico (002), y el pico de difracción débil a 13,1 ° corresponde a un motivo de empaquetamiento estructural interplanar indexado como el pico (100). Los g-CNQD se sintetizaron con una alta relación molar (6:1) de precursor de N / C (urea a citrato de sodio) [18]. Además, se inyecta más N en el núcleo para formar puntos de nitruro de carbono con un tiempo de tratamiento térmico más largo que llega a 60 min. Pero el tiempo de calentamiento para la pirólisis en fase sólida por microondas de nuestra muestra N, S-CQD es de solo 50 s. A diferencia de nuestras muestras, el volumen de la mezcla de urea y solución de ácido cítrico se hierve hasta un punto de 100 ° C y se obtiene nitruro de carbono β nanocristalino. En conclusión, especulamos que una relación molar baja de precursor N / C, un tiempo de reacción corto y una temperatura relativamente más alta pueden conducir a una estructura de carbono grafítico. En comparación con el de los CQD de dopaje libre [20], el pico de difracción (002) de nuestra muestra N, S-CQD se desplaza de 23 ° a un ángulo superior de 25,5 °, lo que implica una disminución del espaciado entre capas. Fuertes interacciones de apilamiento electrónico interplanar entre las capas similares al grafeno de N, S-CQD. Al poseer una electronegatividad más fuerte que el átomo de carbono, el heterodopaje de una gran cantidad de átomos de nitrógeno y azufre en el marco de carbono conjugado causaría un aumento en la densidad electrónica de todo el marco de carbono conjugado y, por lo tanto, la distancia interplanar se acortaría [21, 22 ].
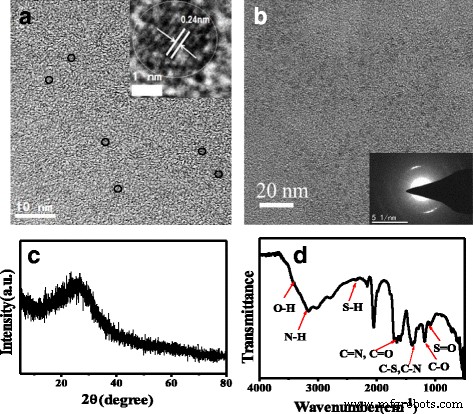
un Imagen TEM de N, S-CQD (el inserto es una imagen HRTEM). b Imagen SAED de N, S-CQD. c XRD y d Espectro FT-IR de N, S-CQD
El espectro FT-IR (Fig. 1d) confirma varios grupos de superficie de N, S-CQD. Las bandas a 3163 cm −1 con un hombro a 3416 cm −1 en 3000–3500 cm −1 el rango representa las vibraciones de estiramiento N – H y O – H, respectivamente [11]. Estos considerables grupos amino, hidroxil hidrófilos podrían permitir una hidrofilicidad superior a las N, S-CQD [23]. Los picos triples que aparecen alrededor de 1582, 1656 y 1704 cm −1 pueden asignarse a los diferentes enlaces de vibración característicos, respectivamente. Los picos alrededor de 1704 cm −1 son la vibración de estiramiento de los grupos carboxílicos C =O y los enlaces C =N [24], y los otros dos picos en 1656 y 1582 cm −1 son la vibración característica de los grupos amida que se estiran C =O (amida I) y la flexión en el plano del enlace N – H (amida II) [24, 25]. Los picos a 1405 y 1345 cm −1 pueden asignarse a la vibración de C – S y C – N, respectivamente [17], mientras que las bandas a 1177 y 1084 cm −1 confirman además la existencia de enlaces C – O y S =O en N, S-CQDs [17, 23]. El espectro de absorción UV / vis de N, S-CQD representa dos bandas de absorción claras (Fig. 2a). La fuerte banda de absorción a 234 nm se atribuye a la transición electrónica π-π * del sistema aromático conjugado sp 2 dominios [17], mientras que el pico de absorción débil a 340 nm se atribuye a la transición n-π * del enlace C =O [26]. Se notó que la intensidad relativa del pico de absorción a 234 nm es mucho más fuerte que la de las muestras de N, S-CQD sintetizadas por el método hidrotermal [17, 26], lo que sugiere la formación de sp más aromáticas 2 dominios con N-dopaje en el sistema central conjugado como N piridínico. Además, un hombro ancho a alrededor de 430 nm superpuesto por el pico a 340 nm proviene de muchos tipos de transiciones de estado de superficie [26].
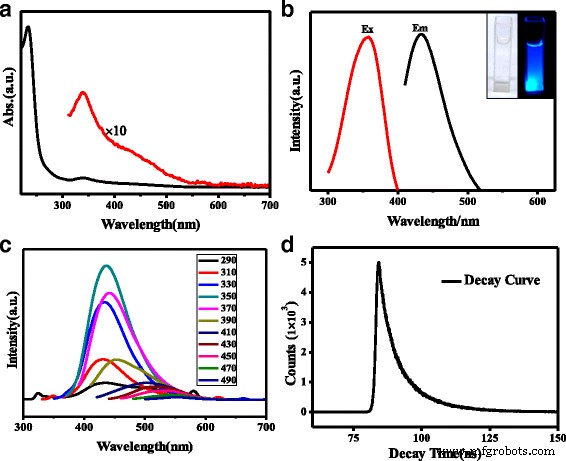
un El UV / vis de N, S-CQD. b El PL de N, S-CQD y el recuadro son las imágenes de N, S-CQD bajo luz ambiental e irradiación de 365 nm. c Los espectros PL de N, S-CQD con diferentes longitudes de onda de excitación. d Curvas de disminución de la intensidad de la fotoluminiscencia a la luz de excitación de 358 nm
Los espectros de fotoluminiscencia (PL) (Fig. 2b) ilustran que los N, S-CQD tienen una amplia distribución de excitaciones. La longitud de onda de excitación máxima es de 358 (longitud de onda de emisión 436 nm) debido a los 340 nm de pico de absorción. Puede verse en la imagen insertada en la Fig. 2b que la solución acuosa de N, S-CQDs incolora y transparente se vuelve azul brillante bajo irradiación UV de 365 nm. La solución de N, S-CQD permaneció transparente durante 10 meses sin precipitaciones; esta alta estabilidad de las partículas de N, S-CQD se atribuye a su tamaño mucho más pequeño y uniforme, así como a los grupos hidrófilos en la superficie.
Se calcula que el rendimiento cuántico de fotoluminiscencia (PLQY) de N, S-CQDs es del 23,6% bajo excitación a 358 nm, que es tres veces mayor que el reportado para N-dopados o N, S-CQDs [20, 23]. Por el contrario, el PLQY de los CQD prístinos es solo del 1,15%, que es mucho menor que el de los N, S-CQD. Se ha informado que el PLQY de CQDs estaba relacionado con la cantidad de N-dopaje en CQDs [17, 27], y por lo tanto, muchos trabajos han intentado aumentar la cantidad de N-doping en CQDs prolongando el tiempo de reacción incluso hasta 19 ho elevando la temperatura de reacción a 260 ° C [11, 23]. Sin embargo, la cantidad de N-dopaje en las muestras sólidas finales era todavía menor del 6%. En nuestro trabajo, se logra un alto nivel de N-dopaje del 12,5% en N, S-CQD mediante un método eficaz asistido por microondas en fase sólida, en el que las moléculas de ácido cítrico y tiourea reaccionan rápidamente y evitan la sublimación. Además, la tiourea actúa como una base débil para acelerar la velocidad de polimerización. Curiosamente, al cambiar la proporción de tiourea y CA de 3:1 a 1:3 y 1:1, el PLQY de N, S-CQD se redujo ligeramente a 7 y 2,1%, respectivamente. Además, aumentando el tiempo de reacción hasta 2 min, simplemente se obtuvo el carbono a granel. Para aclarar aún más el mecanismo de reacción, adquirimos el analizador térmico diferencial termogravimétrico (TG-DTA) y las curvas de masa de TG de CA puro y la mezcla reactiva de CA y tiourea. Como se muestra en la Fig. 3a, hay tres picos exotérmicos que se pueden observar en las curvas TG-DTA de CA puro; el primer pico corresponde al agua absorbente, incluida el agua cristalina. El segundo pico agudo a 154 ° C se asigna a la liberación de calor de fusión de CA cristalino, y el amplio centrado a 214 ° C se relaciona con la deshidratación y carbonización intermolecular. Mientras que para la mezcla de CA y tiourea, se pueden observar muchos cambios en los dos últimos picos exotérmicos en el espectro TG-DTA (Fig.3b), el segundo pico exotérmico aparece a una temperatura baja de 118 ° C, lo que indica que el ácido –La interacción de la base entre CA y tiourea da como resultado una caída dramática de 36 ° C en el paso de liberación de calor de fusión. Además, el además del tercer pico exotérmico que correspondió a la deshidratación y carbonización deriva dos picos a 214 y 236 ° C, y se puede observar un pico débil a 170 ° C, lo que implica que la adición de tiourea puede avanzar en el proceso de deshidratación y carbonización. . Comparando los espectros de masas de TG del CA puro y la mezcla de CA y tiourea (Fig. 3c), se puede encontrar que la temperatura máxima de H 2 El pico de liberación de O disminuye de 215 ° C para el CA puro a 180 ° C para la mezcla de CA y tiourea. Del mismo modo, el máximo de CO 2 el pico de liberación es de 227 ° C para CA, pero cambia a baja temperatura y se convierte en una liberación de dos pasos a 179 y 198 ° C para la mezcla de reactivos de CA y tiourea, respectivamente. Esta disminución de temperatura en la deshidratación y carbonización concuerda bien con los resultados de TG-DTA, lo que implica un enfoque de reacción diferente para estos dos sistemas. Para el CA puro, la deshidratación intermolecular y la carbonización ocurren simultáneamente a alta temperatura. Mientras que para la mezcla de CA y tiourea, la deshidratación intermolecular reacciona primero entre los grupos carboxilo de CA y los grupos amino de tiourea, y luego, la carbonización escalonada pasa a formar el núcleo de carbono de N, S-CQDs. En comparación con la interacción débil del enlace de hidrógeno entre las moléculas de CA, la interacción ácido-base fuerte entre los grupos carboxilo y los grupos amino da como resultado una disminución significativa de la temperatura de deshidratación. Curiosamente, como se muestra en la Fig.3c, la masa residual para el CA puro y el reactivo mixto de CA y tiourea son 1 y 21% en peso, respectivamente, lo que indica que la tiourea agregada puede desempeñar un papel como una base débil para reducir el temperatura de reacción y evita la sublimación, por lo que mejora el contenido de dopaje N y S en N, S-CQD con alto rendimiento.
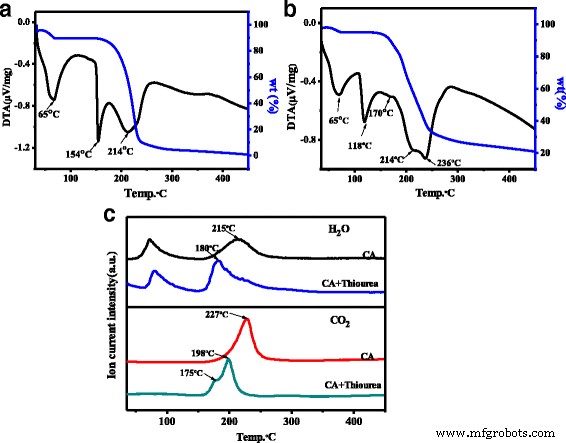
Curvas TG y DTA de a ácido cítrico puro, b mezcla reactiva de ácido cítrico y tiourea. c Curvas de TG-Mass de CA puro y mezcla reactiva de ácido cítrico y tiourea
La Figura 2c ilustra los espectros de emisión de N, S-CQD con diferentes longitudes de onda de excitación. Cuando la longitud de onda de excitación cambia de 290 a 370 nm, los picos de emisión a 440 nm casi no muestran cambios. Los componentes de emisión son bastante constantes en energía y muy probablemente se originan a partir de la absorción de la transición n-π * a 340 nm. La propiedad de emisión independiente de la excitación de los CQD se ha estudiado ajustando los picos de emisión complejos a múltiples funciones gaussianas y se ha deducido una conclusión similar [26]. Mientras que cuando la longitud de onda de excitación varía de 390 a 490 nm, el espectro de emisión PL exhibió un corrimiento al rojo como el aumento de la longitud de onda de excitación, caracterizando una propiedad dependiente de la longitud de onda de excitación. Esto puede atribuirse a varios estados superficiales de C =O o al papel del grupo amida como centros discretos de captura de excitones para afectar la energía de emisión en el proceso PL [11, 19, 28]. La polidispersidad y la heterogeneidad de la superficie es el origen del comportamiento PL dependiente de la longitud de onda de excitación [28, 29]. El pico de absorción amplio a alrededor de 430 nm es un conjunto de varios estados de superficie, incluidos carboxilo y amida, que permite el comportamiento PL dependiente de la longitud de onda de excitación de N, S-CQD. La vida útil de la fluorescencia de N, S-CQD se determinó para evaluar su propiedad óptica (Fig. 2d). Las curvas de desintegración PL de la muestra N, S-CQD se pueden ajustar mediante una fórmula doble exponencial, donde τ 1 es 3,48 ns, τ 2 es de 11,05 ns y la vida media es de 6,72 ns. En comparación con la vida media de 2,42 ns de los CQD prístinos [30], las vidas de fluorescencia de ambos τ 1 y τ 2 se obtuvieron en nuestra muestra. Se ha informado que el τ 2 La proporción y la vida media se alargan con el aumento de la cantidad de N-dopaje y se concluye que cuanto más τ 2 derivado de los estados de la superficie [11, 31].
La formación de N, S-CQD fue corroborada por XPS. Como se muestra en la Fig. 4a, cinco picos distintos a 530, 399, 284, 222 y 164 eV presentes de O 1 s , N 1 s , C 1s, S 2 s y S 2 p señales, respectivamente, que indican N y S fueron inyectadas en el marco de CQDs [17]. C 1 s de alta resolución El espectro XPS (Fig. 4b) indica tres características de la estructura C, incluida la sp aromática conjugada 2 C (C =C) a 284,4 eV, sp 3 C (C – N, C – O, C – S) a 285,6 eV y C =O / C =N a 288,1 eV [11]. Los N 1 s El espectro XPS (Fig. 4c) de los N, S-CQD muestra tres picos a 399,5, 400,3 y 401,0 eV, que representan N piridínico, N pirrólico y N amídico, respectivamente [17, 24]. En el g-CNQD, la relación atómica Ncore / Ccore, según se deriva de la relación de intensidad XPS experimental, es igual a 1,40, que está cerca del valor esperado de 1,33 esperado para un C 3 N 4 [19]. Realizamos un análisis de datos similar de nuestra muestra, tomando 285,6 eV de C 1 s pico como "Ccore" mientras que 400,3 eV (pirrólico) y 399,6 eV (piridínico) de N 1 s como "Ncore" (porque los valores de energía de enlace son similares con 399,9 eV de NCore en [19]), y el Ncore / Ccore calculado es 0,43, mucho menor que 1,33 para C 3 N 4 . Además, se encontró que la relación relativa de N piridínico a N pirrólico en nuestras N, S-CQDs era muy diferente de la de las CQDs co-dopadas con N- o N, S sintetizadas por método hidrotermal [17, 21]. El N piridínico es el dopante dominante en nuestra muestra de N, S-CQD, que es 1,5 veces el N pirrólico, pero suele ser inferior a 1,0 para muchas muestras sintetizadas térmicamente. Tal N piridínico alto puede dotar a los N, S-CQDs de una propiedad superior para la aplicación de catálisis adicional debido a que pueden actuar como sitios catalíticos activos [32]. Además, el N pirrólico en el borde es una composición importante de defectos superficiales y puede actuar como centro de fotoluminiscencia [17, 27]. El S 2 p El espectro XPS (Fig. 4d) muestra dos señales típicas a 163,3 y 164,4 eV, que corresponden a S 2 p 3/2 y S 2 p 1/2 de tiofénico S, respectivamente [16]. Combinando con el espectro FT-IR, especulamos que los átomos de azufre se dopan con éxito en el marco de N, S-CQD como S tiofénico y existen en el borde de N, S-CQD para mejorar su PLQY.
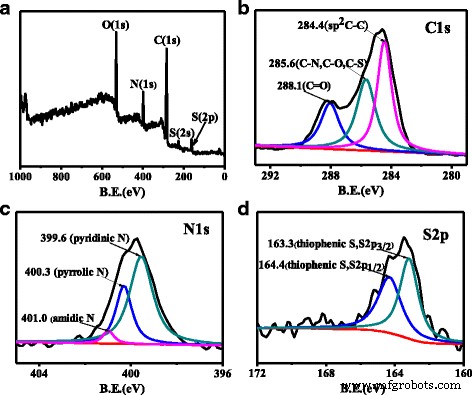
un El XPS de escaneo completo de N, S-CQD. El XPS de alta resolución de C 1 s b N 1 s c y d S 2p espectros de N, S-CQD
La catálisis enzimática es expectativa debido a su alta especificidad y actividad. La peroxidasa de rábano picante (HRP) es la enzima vegetal más estudiada que contiene el centro activo del ciclo de la porfirina en el grupo hemo para catalizar eficazmente la oxidación de un electrón, una amplia variedad de sustrato orgánico e inorgánico mediante peróxido de hidrógeno [33, 34]. Las propiedades de imitación de N, S-CQD ricos en piridínicos se probaron para la oxidación de los sustratos de peroxidasa de 3, 3 ′, 5 ′, 5′-tetrametilbencidina (TMB) en presencia de H 2 O 2 midiendo la absorción del producto de oxidación azul de TMB a 652 nm. La absorción UV / vis de N, S-CQDs alcanza un máximo a 234 y 340 nm. La Figura 5a ilustra las líneas de ajuste de la concentración de productos de oxidación derivados de TMB (μmol / L) a través del tiempo en presencia de N, S-CQD y CQD prístinos. La velocidad de reacción ( r ) para la descomposición de H 2 O 2 en N, S-CQD como imitadores de enzimas es 2,16 × 10 −3 μmol −1 L −1 S −1 , que es dos veces mayor que el de los CQD prístinos y los CQD libres de dopados reportados anteriormente en las mismas condiciones [35, 36]. La excelente actividad de los N, S-CQD ricos en piridínicos se puede atribuir al alto contenido de dopaje de N que posee una gran electronegatividad que el átomo de carbono para aumentar la densidad electrónica de los N, S-CQD y, especialmente, del N piridínico dominante. Un solo par de electrones que conduce a la mejora en la densidad electrónica y la movilidad en el marco π-conjugado de N, S-CQDs, acelera así la reacción. Este es el primer informe sobre la mejora espectacular de la propiedad de imitación de catalasa de la dependencia de CQD del dopaje dominante de N piridínico en el marco de carbono.
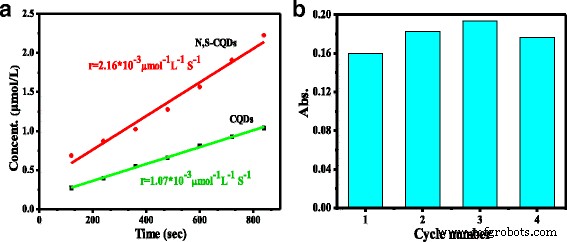
un La velocidad de reacción inicial de N, S-CQD y CQD dopados libres. b Prueba de reutilización de N, S- CQD
La reutilización de N, S-CQD se investigó mediante el uso de cuatro veces consecutivas para la reacción de imitación de catalasa (Fig. 5b). En el uso de cuatro ciclos, no se observó una disminución obvia en la actividad de N, S-CQD. La alta estabilidad de la actividad de catálisis intrínseca de N, S-CQD se atribuye al dopaje N piridínico dominante en el marco C =C porque el N piridínico puede desempeñar un papel como sitios catalíticos de imitación enzimática eficaz para H 2 O 2 descomposición.
Conclusiones
En resumen, sintetizamos un N, S-CQD rico en piridínicos con un alto nivel de dopaje N y S mediante el método de polimerización sólida por microondas en tan solo 50 s. La tiourea no solo actúa como fuente de S, sino también como base débil para acelerar la deshidratación intermolecular a baja temperatura y la carbonización en varios pasos, lo que permite que el alto nivel de dopaje N y S en N, S-CQD y N piridínico dominante se inyecte en el conjugado. marco como la enzima imita los sitios activos. Nuestro trabajo proporciona un método eficaz para sintetizar N, S-CQD ricos en piridínicos que poseen una elevada actividad de PLQY y de imitación de enzimas.
Nanomateriales
- Síntesis de ADN
- S, N Co-Doped Graphene Quantum Dot / TiO2 Composites para la generación eficiente de hidrógeno fotocatalítico
- Puntos de carbono luminiscentes azules independientes de excitación de alta eficiencia
- Síntesis de puntos cuánticos de tipo II / tipo I de ZnSe / CdS / ZnS con supresión de reabsorción y su aplicación para el ensayo inmunoabsorbente
- Puntos cuánticos de bismuto en pozos cuánticos de GaAsBi / AlAs recocidos
- Síntesis ecológica de puntos cuánticos de núcleo / carcasa de InP / ZnS para su aplicación en diodos emisores de luz sin metales pesados
- Microesferas de carbono magnéticas como adsorbente reutilizable para la eliminación de sulfonamidas del agua
- Un enfoque simple para sintetizar puntos cuánticos de carbono fluorescente de aguas residuales de tofu
- Síntesis de puntos cuánticos de sulfuro de antimonio solubles en agua y sus propiedades fotoeléctricas
- Síntesis sonoquímica de un solo paso y propiedades fotocatalíticas fáciles de compuestos de puntos cuánticos de grafeno / Ag3PO4
- Dependencia del espesor de la cáscara de la transferencia de energía entre partículas en el dopaje de puntos cuánticos de ZnSe / ZnSe Core-Shell con europio



