Microesferas de carbono magnéticas como adsorbente reutilizable para la eliminación de sulfonamidas del agua
Resumen
Se prepararon nuevas microesferas de carbono magnético reutilizables (MCM) mediante un método hidrotermal con glucosa como fuente de carbono y Fe 3 O 4 nanopartículas como materias primas magnéticas. Y se investigó en detalle el rendimiento de adsorción de los MCM para la eliminación de sulfonamidas del agua. Los resultados indicaron que la temperatura de calcinación y el tiempo de calcinación tuvieron efectos significativos sobre el área superficial y su volumen poroso de MCM. Cuando los MCM se calcinaron a 600 ° C durante 1 h, el área de superficie y el volumen poroso de los MCM fueron 1228 m 2 / gy 0,448 m 3 / g, respectivamente. Los resultados de la adsorción mostraron que los datos de adsorción encajaban bien con el modelo de isoterma de Langmuir y seguían una cinética de pseudo-segundo orden. Cuando el valor de pH se cambió de 4,0 a 10,0, la capacidad de adsorción de MCM para sulfonamida se redujo de 24,6 a 19,2 mg / g. La capacidad de adsorción de MCM sintetizados alcanzó 18,31 mg / g después de que se reutilizó cuatro veces, lo que mostró una capacidad de adsorción y reutilización deseables.
Antecedentes
Los antibióticos farmacéuticos se utilizan ampliamente en el mundo para tratar enfermedades y mejorar la tasa de crecimiento de los animales. Sin embargo, se ha descubierto que los antibióticos tienen graves efectos adversos en el medio acuático, lo que ha suscitado una creciente preocupación en los últimos años [1, 2, 3]. Entre todos los antibióticos, los antibióticos de sulfonamida se utilizan habitualmente en gran medida en la clínica, la cría de animales y la acuicultura. Son muy estables y se absorben mal en el tracto digestivo con solo una pequeña porción de antibióticos de sulfonamida metabolizados o absorbidos. Cuando se descargan al medio ambiente, los antibióticos de sulfonamida se han detectado con frecuencia en plantas de tratamiento de aguas residuales, aguas subterráneas, aguas superficiales, suelos, sedimentos, etc. [4, 5, 6]. Los residuos de antibióticos de sulfonamida no solo pueden dañar el medio ambiente, sino que también representan un riesgo significativo para la salud humana. Por lo tanto, es necesario investigar una nueva tecnología para eliminar de manera efectiva estos residuos de antibióticos del agua.
Los materiales de carbono han llamado mucho la atención por su inercia química, biocompatibilidades y estabilidades térmicas [7,8,9] y se han investigado ampliamente en el campo de la separación, catalizador y adsorción [10,11,12]. Sin embargo, los materiales de carbono tradicionales son difíciles de separar de la solución cuando se utilizan como adsorbentes. Los métodos convencionales son principalmente la filtración y la centrifugación, que son inconvenientes y poco eficientes, especialmente cuando las condiciones de trabajo son complicadas. Con el desarrollo de la nanotecnología en los últimos años, se ha prestado mucha más atención a los materiales de carbono combinados con materiales nanomagnéticos, a saber, microesferas de carbono magnéticas (MCM), que pueden separarse fácilmente con un imán. Estos compuestos de carbono magnético se han utilizado como adsorbentes para la eliminación de contaminantes del agua, como el azul de metilo [13] y el fenol y nitrobenceno [14]. Zhu y col. han revisado la síntesis y aplicación de compuestos de carbono magnético [15].
En este artículo, presentamos un enfoque novedoso para sintetizar nuevas microesferas de carbono magnético (MCM) con un área de superficie alta mediante el método hidrotermal, en el que la glucosa y el Fe 3 O 4 Se utilizaron nanopartículas como materia prima. Y se evaluó en detalle el rendimiento de adsorción de los MCM para la eliminación de sulfonamidas del agua.
Métodos
Productos químicos y materiales
FeCl 3 · 6H 2 Se adquirieron O, etanol, etilenglicol y sulfonamida de Sinopharm Chemical Reagent Co., Ltd. NaAc · 3H 2 O, glucosa, KCl, NaOH y HCl eran de Nanjing Chemical Reagent Co., Ltd. ZnCl 2 se compró a Xilong Chemical Co., Ltd. Se utilizó agua destilada en todos los experimentos.
Preparación de Fe 3 O 4 Nanopartículas
Fe 3 O 4 Las nanopartículas se prepararon mediante el método hidrotermal como se informa en [16]. FeCl 3 · 6H 2 O (1,35 g) y NaAc · 3H 2 Se disolvió O (3,60 g) en 40 ml de etilenglicol para formar una solución homogénea y luego se trasladó a un autoclave de acero inoxidable revestido de teflón (100 ml de capacidad), se calentó a 200ºC durante 8 h. Después de que se enfrió a temperatura ambiente, el producto resultante se lavó con agua desionizada y etanol tres veces, respectivamente.
Preparación de MCM
0,1 g Fe 3 O 4 Se agregaron nanopartículas, la dosis adecuada de glucosa y 60 ml de agua destilada en un vaso de precipitados de 100 ml y luego se agitaron para obtener el Fe 3 O 4 nanopartículas homodispersas. La solución se vertió en un autoclave de 100 ml y se calentó a 200ºC durante 11 h. Los MCM obtenidos se lavaron dos veces con agua desionizada y etanol.
Los MCM se sumergieron en el 40% de ZnCl 2 solución [17, 18] y luego se secaron en un horno de secado al vacío. Los MCM sintetizados se colocaron en un horno de tubérculos y se calentaron en una atmósfera de nitrógeno. Así, se obtuvieron los MCM calcinados y activados. Los MCM resultantes se lavaron, se utilizaron 50 ml de agua desionizada de cinco a ocho veces hasta la concentración de Zn 2+ fue inferior a 0,05 mg / L, y los MCM se secaron en un horno de secado al vacío para la adsorción de sulfonamidas.
Caracterización
Los MCM se caracterizaron mediante microscopía electrónica de transmisión (TEM, Modelo Tecnai 12, Philips Co., Ltd., Holanda) y microscopía electrónica de barrido de emisión de campo (FE-SEM, Modelo S-4800, Hitachi Co., Ltd., Japón). Las propiedades magnéticas de los MCM se midieron a temperatura ambiente utilizando un magnetómetro de muestra vibrante (VSM, Modelo 7410, Lake Shore Co., Ltd., EE. UU.). El rendimiento de adsorción y desorción de nitrógeno se realizó utilizando un analizador de superficie específico (Modelo Coulter SA3100, Beckman Co., Ltd., EE. UU.). Las superficies se calcularon mediante la ecuación de Brunauer-Emmett-Teller (BET). El potencial zeta de superficie se midió con un analizador de potencial zeta (ZS90, Malvern Instruments, Reino Unido).
Procedimiento de adsorción
Los experimentos de adsorción se llevaron a cabo en matraces cónicos de 50 ml en un agitador orbital de temperatura controlada (QHZ-98A, Taicang Bio-Instrument Manufacture Co., Ltd). Para reducir la posibilidad de fotodegradación de la sulfonamida, todos los matraces cónicos contenían soluciones de sulfonamida y la dosis apropiada de MCM se envolvió con papel de aluminio y se agitó a temperatura ambiente (300 K) a 120 rpm. Una vez finalizada la adsorción, los MCM se separaron de la solución de sulfonamida mediante un imán. La concentración de sulfonamida se midió a 258 nm mediante un espectrofotómetro ultravioleta-visible (UV-vis, Modelo 759S, China) y la capacidad de adsorción de MCM ( Q e , mg / g) se calculó de acuerdo con la Ec. (1):
$$ {Q} _e =\ frac {\ left ({C} _0- {C} _e \ right) \ times V} {m} $$ (1)donde Q e es la capacidad de adsorción en equilibrio (mg / g); C 0 y C e denotar las concentraciones inicial y de equilibrio de sulfonamida (mg / L), respectivamente; V es el volumen de solución de sulfonamida (50 mL); m es la masa de los MCM adsorbentes (mg).
El método de reutilización de MCM
Para evaluar la reutilización de MCM, se agregó 1 g / L de MCM en una solución de sulfanilamida de 25 mg / L en la que se simuló su concentración de drenaje de plantas farmacéuticas. La capacidad de adsorción de MCM se calculó cuando la adsorción alcanzó el equilibrio. El MCM absorbido pudo separarse y dispersarse en agua destilada y desorberse agregando 0.1 mol / L de NaOH hasta que el valor de pH alcanzara 10.0, luego ultrasonido a 500 W durante 10 min, y este proceso se repitió tres veces [19, 20]. Luego, los MCM se lavaron con agua destilada repetidamente hasta un pH =7. En todos los experimentos, se empleó el imán para separar MCM de la solución acuosa.
Resultados y discusión
TEM de MCM
Los TEM de Fe 3 O 4 nano / microesferas y MCM se muestran en la Fig. 1.
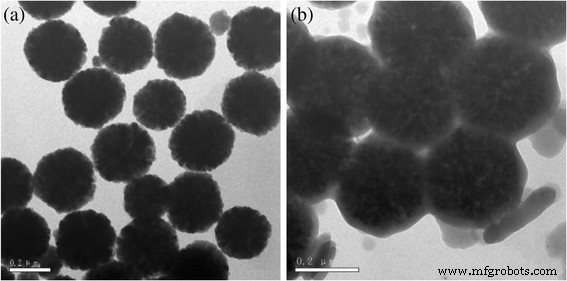
Imágenes TEM. un Fe 3 O 4 nano / microesferas. b MCM
Como se muestra en la Fig. 1a, los tamaños de Fe 3 O 4 nano / microesferas estaban alrededor de 200 nm y se dispersaron uniformemente. Después de Fe 3 O 4 nano / microesferas se hicieron reaccionar con glucosa por método hidrotermal, el carbono se cubrió en la superficie de Fe 3 O 4 microesferas (Fig. 1b). Al mismo tiempo, se formaron algunas microesferas de carbono que estaban de acuerdo con trabajos previos de Cakan et al. [21].
Espectro FT-IR y XRD de MCM
El espectro FT-IR y XRD de los productos resultantes Fe 3 O 4 nano / microesferas y MCM se muestran en la Fig. 2.
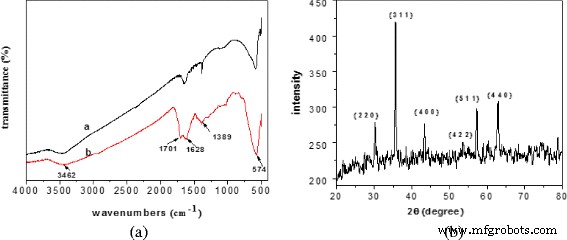
Espectro FT-IR y XRD de los productos resultantes. un Espectro FT-IR (a:Fe 3 O 4 , b:MCM). b Espectro XRD de Fe 3 O 4
El Fe 3 resultante O 4 y los MCM tenían un pico de adsorción cercano a 574 cm −1 , que era el pico característico de Fe 3 O 4 . Hubo un pico de absorción amplio cerca de 3462 cm −1 para Fe 3 O 4 y MCM, que sugirieron el Fe 3 resultante O 4 y los MCM tenían un grupo funcional –OH. Los picos en 1701 y 1621 cm −1 fueron la absorción de vibraciones de carbonilo y alqueno, que se atribuyeron a la carbonización de la glucosa en el método hidrotermal.
Se encuentra que todos los picos de reflexión se pueden asignar a la difracción de (2 2 0), (3 1 1), (4 0 0), (4 2 2), (5 1 1) y (4 4 0 ) planos cristalinos de estructura cúbica de Fe 3 O 4 (JCPDS no. 19-0629), que indicó la formación de nanopartículas de magnetita [22].
Área de superficie y volumen poroso de MCM
El N 2 Las isotermas de adsorción-desorción y su distribución de tamaño de poro Brunauer-Emmett-Teller (BET) relevante de los MCM preparados se muestran en la Fig. 3, y sus parámetros de área de superficie BET ( S APUESTA ), el volumen y el tamaño de los poros se enumeraron en la Tabla 1.
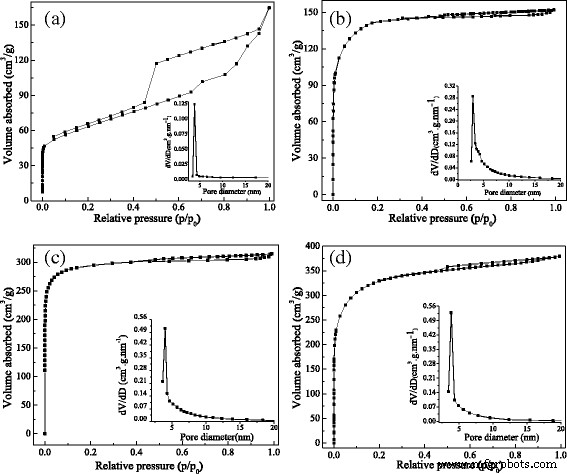
Isotermas de adsorción-desorción de nitrógeno y distribuciones de tamaño de poro de MCM. un MCM sin ZnCl 2 impregnación. b MCM calcinados a 550 ° C durante 1 h sin ZnCl 2 impregnación. c MCM con ZnCl 2 impregnación durante 1 h se calcinó a 550 ° C durante 1 h. d MCM con ZnCl 2 impregnación durante 1 h se calcinó a 600 ° C durante 1 h
Como se muestra en la Fig. 3a, la curva de adsorción de MCM sin ZnCl 2 la impregnación y calcinación pertenecían a la isoterma de adsorción tipo II, que generalmente presentaba material no poroso; el bucle de histéresis podría asignarse al tipo H2 de acuerdo con la nomenclatura de la IUPAC, lo que implicaba que el volumen poroso se formaba mediante el empaquetado de granos [23]. Al mismo tiempo, la muestra de la Fig. 3a poseía un área superficial baja (223 m 2 / g) y volumen poroso bajo (0,082 m 2 / g), aunque tenía un gran tamaño poroso (3,7 nm), lo que confirmó que la porosidad era la porosidad del empaque pero no la porosidad primaria.
Las muestras de MCM en la Fig. 3b-d fueron todas calcinadas a alta temperatura y tenían isotermas de adsorción similares. Como se muestra en la Fig. 3, todas las curvas de isotermas aumentaron rápidamente a baja presión relativa, lo que implicaba que había microporos en las muestras de MCM y facilitaba una fuerte adsorción; mientras que a alta presión relativa, estas curvas exhibieron una meseta, lo que demostró que no tuvo lugar más adsorción, y estas curvas eran la típica isoterma de adsorción de tipo I. En el procedimiento de adsorción-desorción, apareció un bucle de histéresis a la presión relativa alta. El fenómeno sugirió la presencia de microporos o mesoporos y el bucle de histéresis podría clasificarse en el tipo H4. Este tipo de bucle de histéresis suele aparecer en el carbón activado [24]. Los datos de distribución de tamaño de poro correspondientes calculados por el método BJH mostraron que el tamaño de poro se distribuyó principalmente por debajo de 3-5 nm, lo que acaba de confirmar que existen grandes cantidades de mesoporos en la superficie de los MCM. Aunque las tres muestras de MCM tenían la isoterma de adsorción similar a la del carbón activado, sus áreas de superficie y volúmenes porosos eran diferentes, como se indica en la Tabla 1.
En comparación con las muestras de MCM (c) y (d), las muestras de MCM (b) tenían un área de superficie mucho menor (356 m 2 / g) y volumen poroso (0,175 cm 3 / g), que se calcinaron a 550 ° C durante 1 h sin ZnCl 2 impregnación. Por tanto, se puede concluir que ZnCl 2 jugó un papel vital en el aumento de la superficie y el volumen poroso. Como se informó anteriormente, ZnCl 2 se utiliza para agentes activos en el proceso de preparación de carbón activado y puede resultar en la degradación del material celulósico y la deshidratación, lo que puede causar encanto y aromatización del esqueleto de carbón y la creación de la estructura de los poros [25]. Además, las muestras de MCM (c) y (d) se impregnaron todas durante 1 hora, y la única diferencia fue su temperatura de calcinación, lo que provocó que el área superficial y el volumen poroso cambiaran significativamente. Cuanto mayor sea la temperatura, mayor será la superficie y el volumen poroso. Por lo tanto, las muestras de MCM (d) se eligieron por las siguientes propiedades magnéticas e investigación de adsorción debido a su mayor área de superficie y volumen poroso.
Propiedades magnéticas de MCM
Las propiedades magnéticas de los MCM se investigaron utilizando un magnetómetro de muestra vibrante (VSM) y su circuito de histéresis de Fe 3 O 4 nano / microesferas (a) y MCM calcinadas a una temperatura de 600 ° C durante 1 h (b) se mostró en la Fig. 4 que se midió a temperatura ambiente (300 K) con VSM.
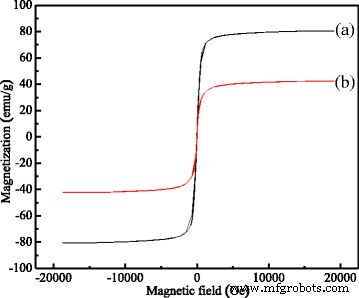
Propiedades magnéticas de los MCM. ( a ) La magnetización por saturación del Fe 3 puro O 4 nano / microesferas. ( b ) La magnetización de saturación de MCM
Como se muestra en la Fig.4, la magnetización de saturación del Fe 3 puro O 4 nano / microesferas era 80,3 emu / g, que era menor que 92,0 emu / g, la magnetización de saturación de Fe 3 a granel O 4 [19], mientras que su magnetización de saturación de MCM fue 42,3 emu / g, que fue mucho menor que la del Fe 3 puro O 4 nano / microesferas y Fe 3 a granel O 4 . Esta fuerte disminución indicó que había mucho carbono adherido a la superficie de Fe 3 O 4 nano / microesferas. Sin embargo, los núcleos magnéticos en los MCM poseían una magnetización de alta saturación, el carbono que se adhirió a la superficie del Fe 3 O 4 Las nano / microesferas casi no tenían efectos sobre su responsabilidad magnética. Se encontró que su magnetización y coercitividad remanentes eran cero, lo que indica Fe 3 O 4 Las nano / microesferas y los MCM eran superparamagnéticos, lo que implicaba que los MCM podían controlarse y separarse mediante el uso de un campo magnético aplicado.
Isoterma de adsorción
Las ecuaciones de Langmuir y Freundlich se usaron comúnmente en el equilibrio de adsorción para ilustrar la interacción de adsorción, que se enumeraron en las Ecs. (2) y (3) [26, 27]:
$$ \ frac {C _ {\ mathrm {e}}} {Q _ {\ mathrm {e}}} =\ frac {1} {Q _ {\ mathrm {m}} {K} _L} + \ frac {C_ { \ mathrm {e}}} {Q _ {\ mathrm {m}}} $$ (2) $$ \ ln {Q} _ {\ mathrm {e}} =\ ln {K} _F + \ frac {1} { \ mathrm {n}} \ ln {C} _ {\ mathrm {e}} $$ (3)donde C e (mg / L) es la concentración de equilibrio de sulfonamida, Q e (mg / g) es la cantidad de sulfonamida adsorbida por gramo de MCM adsorbentes en equilibrio, Q m (mg / g) es la capacidad de adsorción máxima teórica de MCM para sulfonamida y K L (L / mg) es la constante que representa la afinidad en el proceso de adsorción de Langmuir; donde K F son las constantes empíricas de Freundlich indicativas de la capacidad de adsorción relativa de los MCM, y 1 / n es la constante indicativa de la intensidad de la adsorción de Freundlich [27].
Las isotermas de adsorción de Langumir y Freundlich se muestran en la Fig. 5, y sus parámetros de adsorción característicos se enumeran en la Tabla 2.
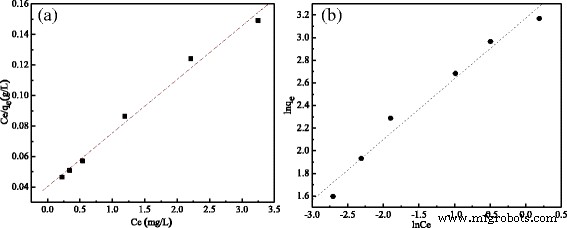
Las isotermas de adsorción de MCM. un Modelo Langumir. b Modelo Freundlich
Como se muestra en la Fig. 5 y la Tabla 2, hubo una relación lineal en los modelos de isotermas de Langumir y Freundlich y no hubo grandes diferencias en los dos modelos. En el modelo de Langumir, la capacidad de adsorción máxima teórica de MCM para sulfonamida fue Q m =27,8551 mg / g. En el modelo de Freundlich, los valores de las constantes K F y 1 / n se calcularon en 3,0564 L / gy 0,476, respectivamente. Dado que el valor de 1 / n es menor que 1, indicó una adsorción favorable. En cuanto al valor del coeficiente lineal ( R 2 ) estaba preocupado, en comparación con el modelo de Freundlich, el valor del coeficiente lineal ( R 2 ) del modelo de isoterma de Langmuir fue mayor que el otro, lo que indicó que los datos de adsorción en equilibrio se ajustaban mejor a la isoterma de Langmuir.
Cinética de adsorción
Para proporcionar una idea del proceso de adsorción y su relación entre los MCM y la sulfonamida y aclarar aún más el tipo de adsorción, así como los factores que influyen, se utilizaron dos modelos cinéticos, la ecuación de pseudo primer orden y la ecuación de pseudo segundo orden. utilizado para estudiar la cinética de adsorción de MCM, que fueron dados por Eqs. (4) y (5) [28,29,30]:
$$ \ ln \ left ({Q} _e- {Q} _t \ right) =\ ln {Q} _e- {K} _1t $$ (4) $$ \ frac {t} {Q_t} =\ frac { 1} {K_2 \ veces {Q_e} ^ 2} + \ frac {t} {Q_e} $$ (5)donde Q e y Q t denotó la capacidad de adsorción de la sulfonamida en el estado de equilibrio y en el momento de t ; K 1 (mínimo −1 ) y K 2 (g mg −1 min −1 ) son el módulo de adsorción de pseudo-primer orden y pseudo-segundo orden, respectivamente. La gráfica lineal de ln ( Q e - Q t ) versus t dio la pendiente de - K 1 y una intersección de ln Q e . Una parcela de ( t / Q t ) versus t dio una pendiente de ( 1 / Q e ) e intersección de 1 / ( K 2 × Q e 2 ).
Las curvas cinéticas y los parámetros calculados de los modelos con su coeficiente lineal ( R 2 ) se enumeran en la Tabla 3.
Como se muestra en esta Tabla 3, el coeficiente de correlación en la ecuación de pseudo-segundo orden fue mayor que el del modelo de pseudo-primer orden y mostró una buena linealidad, lo que indicó que la adsorción de sulfonamida por MCM probablemente fue controlada cinéticamente como un reacción de segundo orden en lugar de una de primer orden, y el paso que limita la velocidad de adsorción puede incluir quimisorción.
Efectos de los valores de pH en la capacidad de adsorción de los MCM
Se encontró que el valor de pH natural de la solución de sulfonamida de 25 mg / L era 6,0. El valor de pH se cambió de 4,0 a 10,0 ajustando con 0,1 mol / L de NaOH y 0,1 mol / L de HCl. Se investigaron los efectos de los valores de pH sobre la capacidad de adsorción de MCM, y los resultados se muestran en la Fig. 6.
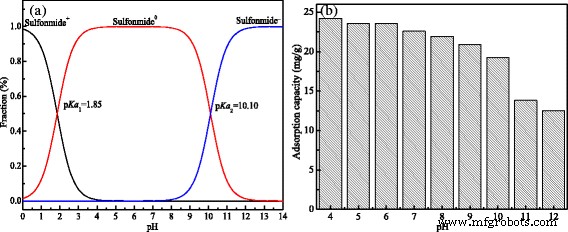
Efectos del pH sobre la especiación de sulfanilamida y la capacidad de adsorción de la sulfonamida. un La especiación de sulfanilamida varió con el pH. b La capacidad de adsorción de los MCM varía con el pH
La capacidad de adsorción de los MCM se vio influenciada por la especiación de sulfanilamida y las cargas en la superficie de los MCM. Como se muestra en la Fig.6, la capacidad de adsorción de MCM se redujo de 24.22 a 12.48 mg / g cuando el pH se incrementó de 4 a 12. El mayor rendimiento de adsorción en solución ácida que en solución alcalina puede estar relacionado con el pKa de la sulfonamida. y potencial de punto cero de MCM. Cuando el pH estaba en el rango de 4.0 ~ 6.0 que estaba en la condición ácida, su potencial zeta era 2.96 mV, la superficie de los MCM era principalmente de carga positiva y la sulfanilamida existía principalmente por estado molecular natural (sulfonamida 0 ) al mismo tiempo [28, 29]. Por lo tanto, la sulfonamida podría absorberse fácilmente en los MCM, lo que indicó que los MCM tenían una mayor eficiencia de eliminación que los que estaban en condiciones alcalinas; mientras que en la condición alcalina, su potencial zeta era - 4.01 mV, la carga positiva en la superficie de los MCM se modificó en carga negativa, y la especiación de sulfanilamida se varió en negativas (sulfonamida - ), lo que provocó el efecto de repulsión electrostática entre las especies de sulfonamidas y los MCM debido a su mismo tipo de cargas. Además, la sulfanilamida se disolvió fácilmente en la solución alcalina [30], lo que hizo que tuviera más tendencia a disolverse en la solución en lugar de ser absorbida por los MCM. Por lo tanto, la capacidad de adsorción se redujo significativamente, lo que implicaba que los MCM se pueden desorber eficazmente en una solución alcalina, como pH =10.
Efectos de la temperatura y la fuerza de los iones en la capacidad de adsorción de los MCM
Se investigaron los efectos de la temperatura y la fuerza de los iones (KCl como regulador de iones) sobre la capacidad de adsorción de los MCM, y los resultados se enumeran en la Tabla 4.
Como se muestra en la Tabla 4, al aumentar la temperatura y la fuerza iónica, disminuyó su capacidad de adsorción de MCM, lo que puede atribuirse a la competencia de adsorción de KCl con sulfonamida. La comparación de la capacidad de adsorción de los MCM con otros absorbentes utilizados para sulfonamidas a partir de soluciones acuosas se enumera en la Tabla 5.
Esta comparación sugiere que los MCM pueden servir como un absorbedor alternativo para eliminar la sulfonamida. En las mismas condiciones de adsorción, la capacidad de adsorción de los MCM y Fe 3 resultantes O 4 nanopartículas fue de 24,22 y 10,83 mg / g, respectivamente, lo que significa que su capacidad de adsorción de MCM proviene principalmente del carbono.
La reutilización de MCM
La frecuencia de reutilización de los MCM se muestra en la Fig. 7a, y su morfología y microestructuras de los MCM después de reutilizados cuatro veces se muestran en la Fig. 7b.
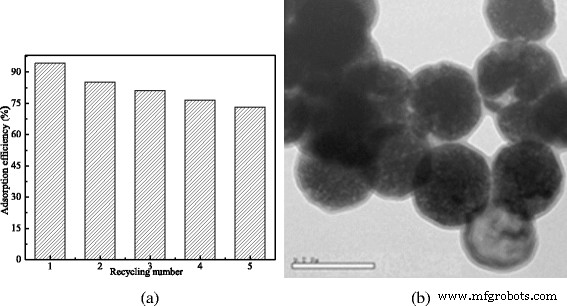
Las frecuencias de reutilización de los MCM y su morfología después de haber sido reutilizadas cuatro veces. un La frecuencia de reutilización. b La morfología de los MCM después de reutilizados cuatro veces
Como se muestra en la Fig. 7, la eficiencia de eliminación por adsorción fue del 94,28% y su capacidad de adsorción para la sulfonamida se calculó en 23,6 mg / g. Después de lavarse con una solución diluida de NaOH y reutilizarse, su eficacia de adsorción disminuyó a medida que aumentaba el número de reciclado. Las eficiencias de remoción de adsorción obtenidas fueron 85.23, 81.17, 76.53 y 73.23% para la segunda, tercera, cuarta y quinta adsorción, respectivamente, que correspondieron a 21.31, 20.29, 19.13 y 18.31 mg / g de capacidad de adsorción. Comparando la Fig. 7b con la Fig. 1b, no se cambiaron la morfología y las microestructuras de las MCM después de reutilizarlas cuatro veces. En consecuencia, los MCM podrían reutilizarse para la eliminación de sulfanilamida.
Conclusiones
Los MCM que poseen una responsabilidad magnética sensible y una gran superficie se sintetizaron con éxito mediante un sencillo método hidrotermal, y su superficie específica y volumen de poros alcanzaron hasta 1228 m 2 / gy 0,445 m 3 / g, respectivamente. La adsorción de sulfanilamida por MCM encajó bien con el modelo de isoterma de Langmuir y siguió una cinética de pseudo-segundo orden. Después de ser desorbido con una solución de NaOH, el adsorbente de MCM podría reciclarse. Los principales hallazgos del presente trabajo contribuirán al diseño y síntesis de absorbentes novedosos y a una mejor comprensión de sus procesos fisicoquímicos de adsorción.
Nanomateriales
- Nanodiamantes para sensores magnéticos
- De los automóviles a la industria aeroespacial:una visión general de la industria en auge para las tecnologías compuestas
- Puntos de carbono luminiscentes azules independientes de excitación de alta eficiencia
- Compuestos de grafeno y polímeros para aplicaciones de supercapacitores:una revisión
- Fibras de carbón activado con nanoestructura jerárquica derivada de guantes de algodón usados como electrodos de alto rendimiento para supercondensadores
- Síntesis de puntos cuánticos de carbono codopados N, S ricos en piridínicos como imitadores enzimáticos eficaces
- Nanodots de carbono como nanosensores de modo dual para la detección selectiva de peróxido de hidrógeno
- Un enfoque simple para sintetizar puntos cuánticos de carbono fluorescente de aguas residuales de tofu
- Compuesto de aerogel / azufre de carbón activado recubierto de polianilina para batería de litio-azufre de alto rendimiento
- Sintetizado hidrotermal de microesferas de CoMoO4 como excelente material de electrodo para supercondensador
- Eliminación de antibióticos del agua con una membrana de nanofiltración 3D totalmente de carbono



