La fuente orgánica de fósforo y calcio induce la síntesis de microesferas estructuradas de cáscara de yema de fosfato de calcio con una superficie específica alta:aplicación en la adsorción de HEL
Resumen
Las microesferas de fosfato cálcico estructuradas en cáscara de yema tienen un gran potencial para aplicaciones médicas debido a sus excelentes propiedades fisicoquímicas y biocompatibilidad. Sin embargo, el desarrollo de un fosfato de calcio con estructura de cáscara de yema y con alta capacidad de adsorción sigue siendo un desafío. Aquí, una microesfera porosa con estructura de cáscara de yema (ATP-CG) de fosfato de calcio con un área de superficie específica alta [ S APUESTA =143 m 2 g −1 , que es aproximadamente tres veces más alta que la de las microesferas de ATP-CL sintetizadas al reemplazar la fuente de calcio con l-lactato de calcio pentahidratado (CL)] se sintetizó con éxito utilizando la sal de adenosina 5'-trifosfato disódico (ATP) como fuente de fósforo y gluconato de calcio monohidrato (CG) como fuente de calcio a través de un enfoque de autoplantación. También se investigaron las influencias de la relación molar de Ca a P (Ca / P), la temperatura hidrotermal y el tiempo sobre la morfología de las microesferas de ATP-CG. Se encuentra que la fuente de calcio orgánico y la fuente de fósforo orgánico juegan un papel vital en la formación de la estructura de la cáscara de la yema. Además, se investigó un lote de experimentos de adsorción para iluminar el mecanismo de adsorción de dos tipos de microesferas con estructura de cáscara de yema sintetizadas con diferentes fuentes de calcio. Los resultados muestran que la capacidad de adsorción de las microesferas de ATP-CG (332 ± 36 mg / g) es aproximadamente dos veces mayor que la de las microesferas de ATP-CL (176 ± 33 mg / g). Además, el área de superficie específica más alta causada por la fuente de calcio y las propiedades químicas superficiales únicas de las microesferas de ATP-CG juegan un papel importante en la mejora de la capacidad de adsorción de HEL. El estudio indica que la microesfera con estructura de cáscara de yema preparada es prometedora para su aplicación en los campos de administración de fármacos y proporciona un enfoque eficaz para mejorar la capacidad de adsorción de fármacos.
Introducción
El fosfato de calcio ha ganado una atención considerable durante los últimos años debido a su excelente biocompatibilidad [1], alta capacidad de carga y eficiencia de administración. Los biomateriales relacionados con el fosfato de calcio se han utilizado ampliamente en varios campos biomédicos, como la ingeniería de tejidos [2], la reparación ósea [3] y la administración de fármacos [4]. Con el fin de ampliar el rango de aplicación y mejorar el rendimiento de los materiales a base de fosfato de calcio, varios materiales de fosfato de calcio con variedades de morfologías y microestructuras, incluidas microesferas de hidroxiapatita carbonatada (HAp) [5], microtubos de HAp [6], microesferas huecas de HAp [7 ], se han reportado nanoesferas mesoporosas de yema de huevo @ cáscara de jaula de fosfato de calcio amorfo (ACP) [8].
Entre las diversas morfologías, las microesferas con estructura de caparazón de yema han atraído cada vez más atención, ya que no solo son ciencia de materiales de frontera, sino que también muestran características morfológicas únicas. En las microesferas con estructura de cáscara de yema, el espacio vacío entre el núcleo de la yema y la cáscara puede servir como depósito de almacenamiento para varias cargas y la cáscara de estructura porosa puede proporcionar una vía de difusión para las moléculas huéspedes, lo que las hace tener un gran potencial para diversas aplicaciones, entre ellas catálisis [9], baterías de iones de litio [10], fotocatalizador [11] y biomedicina [12]. Tradicionalmente, los métodos de sacrificio de plantilla son los principales para preparar microesferas con estructura de cáscara de yema [13, 14]. Estas estrategias de plantilla han logrado un gran éxito en el ajuste de la estructura y las propiedades. Sin embargo, estos enfoques presentan algunas desventajas. Por ejemplo, tediosos pasos de procesamiento y reactivos tensioactivos o directores de estructura, que pueden ser peligrosos para la salud humana. Actualmente, los métodos de autoplantación se han utilizado ampliamente en la investigación de microesferas estructuradas con caparazón de yema [15, 16]. A diferencia de los enfoques tradicionales de creación de plantillas, las plantillas empleadas en los enfoques de creación de plantillas propias no son solo las plantillas para formar los huecos, sino también el precursor de las microesferas estructuradas con caparazón de yema. Por tanto, los métodos de autoplantación son enfoques convenientes para preparar microesferas con estructura de cáscara de yema. Sin embargo, la introducción de enfoques de autoplantación para la síntesis de microesferas de fosfato de calcio con estructura de cáscara de yema sigue siendo un desafío interesante.
Además, los materiales de fosfato de calcio se han utilizado para transportar diferentes tipos de cargas, como proteínas [17], ADN [18] y ARNip [19]. Sin embargo, la capacidad deficiente de adsorción de fármacos del fosfato de calcio debe resolverse con urgencia. Generalmente, los enfoques de las moléculas de fármaco que se inmovilizan sobre la superficie del portador dependen de las propiedades de la superficie que contienen potencial de superficie [20], hidrofobicidad / hidrofilicidad [21], enlace de hidrógeno [22] y área de superficie específica [23]. Por lo tanto, mejorar las propiedades de la superficie y el área de la superficie específica es un enfoque válido para mejorar la capacidad de adsorción de fármacos del portador.
En este documento, preparamos una especie de microesferas de fosfato cálcico con estructura de yema porosa mediante el uso de sal disódica de adenosina 5'-trifosfato (ATP) como fuente de fósforo y gluconato de calcio monohidrato (CG) como fuente de calcio a través de un enfoque de autoplantación. Sin ninguna adición de agente moldeador, las microesferas de fosfato cálcico estructuradas con cáscara de yema tal como se preparan presentan una superficie específica particularmente alta. Además, se investigó el comportamiento de adsorción de lisozima de huevo de gallina (HEL) de las microesferas de ATP-CG en comparación con las microesferas de ATP-CL preparadas reemplazando la fuente de calcio con l-lactato de calcio pentahidratado (CL). Los resultados revelan que la diferencia de superficie específica causada por la fuente de calcio y las propiedades químicas de la superficie juegan un papel vital en la mejora de la capacidad de adsorción de HEL.
Métodos
Materiales
La sal de adenosina 5'-trifosfato disódico (ATP) se obtuvo de Macklin Biochemical Co., Ltd (Shanghai, China). El gluconato de calcio monohidrato (CG) y el (l) lactato de calcio pentahidratado (CL) se adquirieron de Sangon Biotech Co., Ltd (Shanghai, China). La lisozima de huevo de gallina (HEL, ~ 70000 U / mg) se adquirió de Sigma-Aldrich (Taufkirchen, Alemania).
Síntesis y caracterización de microesferas estructuradas con capa de yema de ATP-CG y ATP-CL
Las microesferas de fosfato cálcico estructuradas con cáscara de yema de ATP-CG se prepararon de la siguiente manera:En resumen, se disolvieron 0,9 g de CG en 20 ml de agua ultrapura para formar la solución C a 60 ° C y se disolvieron 0,11 g de ATP en 5 ml de agua ultrapura para formar la solución P. Luego, la solución C se enfrió a temperatura ambiente y se mezcló con la solución P con agitación vigorosa y el pH de la solución se ajustó mediante una solución de NaOH 2 M a 5. El volumen final de la solución fue 30 mL con la adición extra de agua ultrapura y la relación molar de Ca a P (Ca / P) fue 3.3. La solución final se transfirió a un sistema de digestión por microondas para la reacción hidrotermal por microondas y se trató a 120ºC durante 15 min. Los precipitados resultantes se recogieron por centrifugación (4500 rpm, 10 min), se aclararon con agua ultrapura y se liofilizaron durante 48 h. Las microesferas de ATP-CL se prepararon de acuerdo con los procedimientos de la bibliografía [24].
La fase cristalina de las microesferas se caracterizó por difracción de rayos X (XRD, Cu K α fuente, λ =0,154). La morfología de las microesferas se observó mediante microscopía electrónica de barrido (SEM), microscopía electrónica de transmisión (TEM) y TEM de alta resolución (HRTEM). Las composiciones de microesferas se estudiaron mediante espectrofotómetro de infrarrojos por transformada de Fourier (FTIR). El área de superficie específica de las microesferas fue determinada por Brunauer-Emmett-Teller (BET). Se empleó el análisis de termogravimetría (TGA) para estudiar las propiedades térmicas de las muestras a una velocidad de calentamiento de 10 ° C / min en una atmósfera de nitrógeno.
Adsorción y caracterización HEL
Los experimentos de adsorción HEL de dos tipos de microesferas se llevaron a cabo de la siguiente manera:ciertas cantidades de microesferas de cáscara de yema (ATP-CG, Ca / P =3.3, 120 ° C, 15 min, y ATP-CL, Ca / P =2.5, 120 ° C, 30 min) se dispersaron en el agua con tratamiento ultrasónico constante durante 10 min para formar 1,5 mg / mL de suspensión de microesferas. Luego, se agregaron inmediatamente 0,5 ml de soluciones acuosas que contienen varias concentraciones de HEL a 1 ml de la suspensión anterior y las concentraciones finales de fármaco fueron de 1 a 7,5 mg / ml. Cada solución se agitó (200 rpm) a 37 ° C durante 6 h. Posteriormente, se centrifugaron las soluciones y se midieron las cantidades de HEL en los sobrenadantes mediante espectrofotómetro UV-vis a 280 nm. Los potenciales zeta y las composiciones de las microesferas antes y después de la carga del fármaco se caracterizaron mediante un analizador de potencial zeta, un espectrómetro FTIR y un analizador termogravimétrico (TGA, velocidad de calentamiento 10 ° C min −1 , atmósfera de nitrógeno).
Isoterma de adsorción
Para investigar el comportamiento de adsorción, en nuestro estudio se llevó a cabo el modelo de isoterma Dubinin-Radushkevic (D-R). El modelo D-R se basa en la teoría del relleno de microporos, que se utiliza para describir la sorción no ideal en una superficie heterogénea, así como para distinguir el mecanismo de sorción (sorción física o sorción química). El modelo se expresa mediante la siguiente ecuación:donde Q eq es la capacidad de adsorción del adsorbente en equilibrio (mg / g), C eq es la concentración de adsorbato en la fase acuosa en equilibrio (mL / L). Q m es la capacidad máxima de adsorción. R es la constante de gas, 8,314 J / (mol ∙ k). T es la temperatura absoluta. E representa la energía libre media para estimar el tipo de adsorción. Si el E el valor es inferior a 8 kJ / mol, el tipo de adsorción puede explicarse por adsorción física, entre 8 y 16 kJ / mol, el tipo de adsorción pertenece al intercambio iónico y mayor a 16 kJ / mol, el tipo de adsorción puede describirse por adsorción química .
$$ {Q} _ {\ mathrm {eq}} ={Q} _m \ exp \ left (- {K} _ {\ mathrm {DR}} \ {\ varepsilon} ^ 2 \ right) $$ (1) $$ \ varepsilon =\ text {RT1n} (1+ \ frac {1} {{C} _ \ text {eq}}) $$ (2) $$ \ mathrm {E} =\ frac {1} {\ sqrt {K _ {\ mathrm {DR}}}} $$ (3)Análisis estadístico de la adsorción de fármacos
Los datos se presentaron como valor medio ± desviación estándar (DE). Diferencias significativas ( p <0,05) se calcularon estadísticamente entre diferentes grupos utilizando el ANOVA de una vía. Todos los experimentos se llevaron a cabo por triplicado y los datos se analizaron mediante el software DPS.
Resultados y discusión
Morfología y caracterización química de microesferas
Microesferas estructuradas con caparazón de yema ATP-CG
Las imágenes SEM en la Fig. 1 muestran las morfologías de varias muestras obtenidas bajo diferentes condiciones de reacción. En t =5 min o 15 min, todos los productos están compuestos por microesferas uniformes. Sin embargo, cuando el tiempo hidrotermal se incrementa aún más a 30 min, se formaron microesferas autoensambladas en nanohojas (como se muestra en la Fig. 1 f, i, l). Mientras tanto, el efecto de Ca / P sobre la morfología de los productos también se observa en t =30 min. A medida que aumentaba el Ca / P, las microesferas autoensambladas de nanohojas se formaron gradualmente (como se muestra en la Fig. 1 f, i, l). La formación de microesferas autoensambladas en nanohojas podría explicarse por las siguientes razones. En primer lugar, bajo el proceso hidrotermal de microondas, las moléculas de ATP podrían hidrolizarse para formar moléculas a base de adenosina que incluyen difosfato de adenosina (ADP), monofosfato de adenosina (AMP) y adenosina, y simultáneamente liberar iones fosfato (PO 4 3− ). Mientras tanto, las moléculas de CG podrían hidrolizarse para formar iones de calcio y gluconato (Ca 2+ ). Entonces, los iones fosfato reaccionarían con los iones calcio para formar núcleos ACP primarios [25]. Luego, los núcleos de ACP iniciales crecen y se ensamblan para formar microesferas de ACP. Por lo tanto, cuando el tiempo hidrotermal se extiende más, las moléculas de ATP y CG en solución se hidrolizan aún más y liberan más PO 4 3− y Ca 2+ iones, lo que provoca la formación de microesferas autoensambladas en nanohojas mediante la mejora de la sobresaturación del sistema y la velocidad de nucleación. Además, al aumentar el Ca / P, la alta concentración local de Ca 2+ también acelera la transformación morfológica de los productos de la misma forma que antes. El análisis anterior indica que el tiempo hidrotermal y el Ca / P tienen una influencia importante en la morfología de los productos.

Imágenes SEM de microesferas de ATP-CG preparadas por método hidrotermal de microondas a 120 ° C
A continuación, se investigan los espectros FTIR de microesferas sintetizadas con varios Ca / P a 120 ° C durante 15 min (Fig. 2). Los picos a 1620 cm −1 , 1383 cm −1 y 912 cm −1 atribuidos a los picos característicos de los grupos C =O, C – O de CG y P – O de ATP [26], respectivamente, lo que implica que las moléculas de CG y ATP no hidrolizadas o sus derivados se absorben en la superficie de las microesferas. El leve pico característico del PO 4 3− de HAp se encuentra a 1035 cm −1 [27] y la absorción alcanza su punto máximo a 1122 cm −1 y 567 cm −1 están asignados a PO 4 3− iones de ACP [28], lo que indica que los productos están compuestos de ACP y HAp. Los resultados de FTIR sugieren que el fosfato de calcio se prepara con éxito utilizando ATP como fuente de fósforo y CG como fuente de calcio.
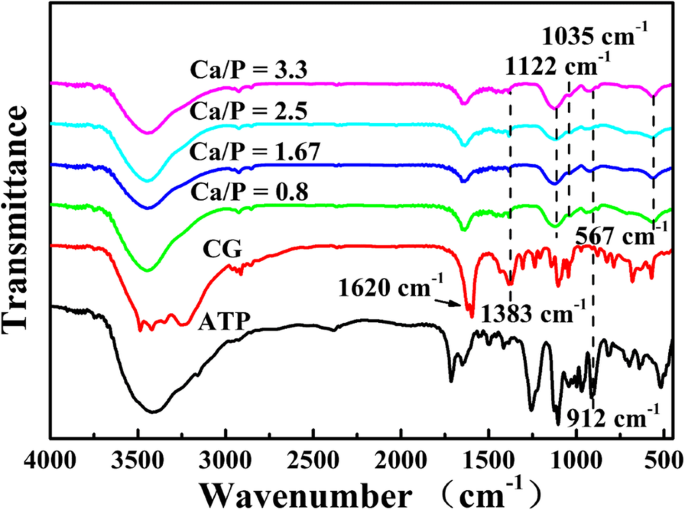
Espectros FTIR de microesferas de ATP-CG sintetizadas con varios Ca / P a 120 ° C durante 15 min
Además, las imágenes SEM y TEM de muestras sintetizadas con varios Ca / P a través del método hidrotermal de microondas a 120 ° C durante 15 min se muestran en la Fig. 3. Cuando el Ca / P es 0.8 o 1.67, las muestras consisten en microesferas porosas ( Fig. 3b, d). Cuando el Ca / P es 2.5, la morfología de los productos comienza a transformarse en microesferas con estructura de cáscara de yema (Fig. 3f). A medida que el Ca / P aumenta aún más a 3,3, los productos están compuestos enteramente por microesferas estructuradas con cáscara de yema (Fig. 3h). Más allá de eso, se observan algunas de las esferas rotas y los núcleos expuestos de las microesferas de cáscara de yema (inserto en la figura 3g) después de la fractura mecánica, lo que proporciona evidencia de una estructura hueca entre la yema y la cáscara. Basándonos en la observación anterior, proponemos tentativamente el mecanismo de formación de microesferas con estructura de cáscara de yema sintetizadas con varios Ca / P. Cuando el Ca / P es menor, las microesferas de ACP porosas se forman primero, lo que se atribuye al efecto inhibidor de las moléculas de ATP y CG o sus derivados adsorbidos en la superficie de las microesferas. Luego, a medida que aumenta aún más el Ca / P, el ACP metaestable seguirá creciendo, lo que es impulsado por la alta sobresaturación del sistema. Finalmente, los HAps cristalinos se forman en la superficie externa, lo que se confirma mediante la imagen TEM de alta resolución (HRTEM) de las microesferas en la Fig. 3i (la distancia interplanar de 0.308 nm puede indexarse a (210) de HAp). Como resultado, las estructuras huecas entre la yema y la cáscara se generan debido a la diferencia de volumen o densidad entre HAp y ACP [24]. El mapeo de EDS correspondiente indica que los elementos Ca, P y O están distribuidos uniformemente por las microesferas. Los espectros EDS en la Fig. 3k y el espectro XPS en la Fig. 3l revelan que los elementos químicos de las microesferas incluyen principalmente Ca, P y O, lo cual es consistente con el resultado de FTIR (Fig. 2).

Imágenes SEM y TEM de microesferas de ATP-CG sintetizadas con varios de Ca / P. un , b Ca / P =0,8. c , d Ca / P =1,67. e , f Ca / P =2,5. g , h Ca / P =3,3. yo HRTEM, j Mapeo EDS, k Espectros EDS, l Espectros XPS de microesferas de ATP-CG con Ca / P =3.3
Se investiga más a fondo el impacto del tiempo hidrotermal asistido por microondas y la temperatura en la morfología de las microesferas sintetizadas con Ca / P =3.3. Como se muestra en la Fig. 4a-b, cuando el tiempo hidrotermal es de 5 min, las muestras se componen de microesferas porosas. Como se discutió anteriormente, cuando t =15 min, el producto también se compone de microesferas con estructura de cáscara de yema (Fig. 4c-d). Cuando el tiempo hidrotermal se extiende a 60 min o la temperatura aumenta a 160 o C, se observan límites de láminas o varillas (Fig. 4e-l). La transformación morfológica de porosa a cáscara de yema a hoja o varilla se atribuye al crecimiento adicional de ACP con la hidrólisis continua de moléculas de ATP y CG en solución. Además, la hidrólisis de las moléculas de ATP y CG o sus derivados adsorbidos en la superficie de las microesferas de ACP también acelera el crecimiento de ACP. Un fenómeno interesante surgió a los 60 minutos o 160 o C, estas láminas o varillas también se desarrollan a partir de nanopartículas de ACP (como se muestra en los recuadros rojos), lo que se confirma mediante el análisis de DTA en la Fig. S1. Se observa un pico exotérmico a 650 ° C en las curvas DTA [29, 30], que se atribuye a la cristalización de ACP. El pico exotérmico se debilita gradualmente con el aumento del tiempo hidrotermal o la temperatura, lo que implica que la transformación de ACP en los productos hacia fosfato cálcico de criestilina.

Imágenes SEM y TEM de microesferas de ATP-CG sintetizadas con Ca / P =3.3 en diferentes condiciones experimentales. un , b T =120 ° C, t =5 min. c , d T =120 ° C, t =15 min. e – h T =120 ° C, t =60 min. i – l T =160 ° C, t =15 minutos
La constitución química y la estructura de las muestras sintetizadas con Ca / P =3.3 bajo diferentes tiempos o temperaturas hidrotermales son investigadas por FTIR y XRD. Como se muestra en la Fig. 5a, los picos característicos de PO 4 3− Los iones de HAp se encuentran a 1037 cm −1 y 603 cm −1 [27]. El pico a 1122 cm −1 se asigna al pico característico de PO 4 3− iones de ACP. La absorción alcanza su punto máximo a 1620 cm −1 y 1383 cm −1 se atribuyen al pico característico de los grupos C =O y C – O de CG, respectivamente. El pico de absorción a 912 cm −1 se refiere a la vibración asimétrica de estiramiento P – O del ATP. Al aumentar el tiempo hidrotermal o la temperatura, la intensidad de los picos característicos de CG y ATP disminuye gradualmente, lo que indica que las moléculas de ATP y CG o sus derivados adsorbidos en la superficie de las microesferas se hidrolizan aún más. Mientras tanto, la intensidad del pico característico de PO 4 3− Los iones en HAp presentan una tendencia creciente gradualmente con la disminución de la intensidad del pico característico de ACP, iluminando la transformación de la fase cristalina de los productos hacia la fase HAp.
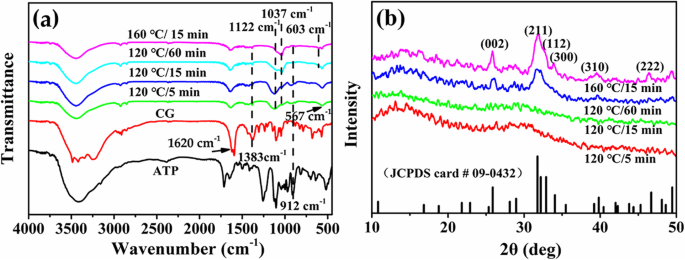
un Espectros FTIR y b Patrones XRD de microesferas de ATP-CG sintetizadas con Ca / P =3.3 en diferentes condiciones experimentales
La Figura 5b muestra los patrones XRD de diferentes muestras. Una joroba característica de fase amorfa de alrededor de 2 θ Se observa =30 ° de microesferas sintetizadas a los 5 o 15 min. Sin embargo, cuando el tiempo hidrotermal se extiende a 60 min o la temperatura aumenta a 160 ° C, la fase cristalina de las microesferas se transforma completamente en HAp, que podría indexarse como datos estándar (JDCPS no. 09-0432). La mejora en la intensidad relativa de los planos de celosía (211), (300) y (002) podría explicar aún más el aumento de la cristalinidad de los productos. Por lo tanto, los resultados de XRD y FTIR confirman aún más la transformación de la fase cristalina de los productos con el aumento de la temperatura o el tiempo hidrotermal.
Microesferas estructuradas con capa de yema ATP-CL
Para comparar el comportamiento de adsorción del fármaco, las otras microesferas con estructura de cáscara de yema se prepararon utilizando CL como fuente de calcio orgánico mediante el método hidrotermal de microondas [24]. En términos de morfología, las muestras todavía consisten en microesferas estructuradas con caparazón de yema, que se verifica mediante las esferas rotas (inserto en la Fig. 6a) y las imágenes TEM (Fig. 6b, c). El resultado demuestra que el cambio en la fuente de calcio no tiene un efecto significativo sobre la morfología de los productos. Además, la difracción de electrones de área seleccionada (SAED) muestra los puntos SAED discretos (Fig. 6d), lo que demuestra que se obtienen microesferas bien cristalizadas. Además, el mapeo EDS exhibe la distribución uniforme de elementos Ca, P y O en microesferas (Fig. 6e). Los espectros de EDS correspondientes también confirman la presencia de elementos de Ca, P y O en las microesferas (Fig. 6f), lo que indica que las microesferas preparadas son fosfato de calcio.

un SEM . b , c Imágenes TEM . d S difracción de electrones de área elegida (SAED) . e Mapeo EDS y f Espectros EDS de microesferas ATP-CL
HEL Mecanismo de adsorción y adsorción de microesferas
Como se muestra en la Fig. 7, la capacidad de adsorción de dos tipos de microesferas aumenta con la concentración inicial creciente de HEL. Cuando la concentración inicial de HEL aumenta a 6,5 mg / ml, la capacidad de adsorción de las microesferas de ATP-CG alcanza una meseta y la capacidad máxima de adsorción de las microesferas es de aproximadamente 332 ± 36 mg / g (Fig. 7a), que es aproximadamente el doble más alto que el de las microesferas de ATP-CL (176 ± 33 mg / g, 6 mg / mL, Fig. 7b).
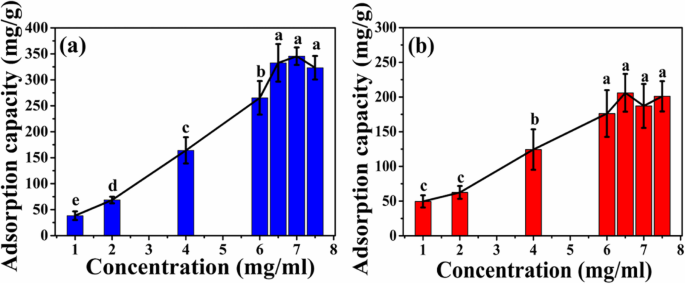
Curva de adsorción de microesferas a diferentes concentraciones iniciales de HEL. un Microesferas de ATP-CG. b Microesferas de ATP-CL
El resultado de la adsorción HEL está respaldado además por los espectros FTIR y las curvas TG. Como se muestra en la Fig. 8a, b, la absorción alcanza un máximo a 1134 cm −1 (1139 cm −1 ) y 563 cm −1 (568 cm −1 ) asignado al pico característico PO 4 3− iones de ACP y 1039 cm −1 (1040 cm −1 ) asignado al pico característico de PO 4 3− Se observan iones de HAp en las microesferas adsorbidas con HEL, lo que indica que la introducción de HEL en las microesferas no provoca ningún cambio significativo en la estructura de las microesferas. La adsorción alcanza su punto máximo a 1542 cm −1 y 1545 cm −1 atribuidos al grupo amida de HEL se observan en microesferas adsorbidas por HEL, lo que confirma que HEL se adsorbe con éxito en las microesferas. Mientras tanto, las bandas de adsorción a 2966, 2962, 2935 y 2927 cm −1 se originó a partir de –CH 3 y –CH 2 También se detectan grupos de HEL en microesferas adsorbidas con HEL, lo que verifica además la presencia de HEL en las microesferas. Las curvas de TGA muestran que la pérdida de peso de las microesferas de ATP-CG antes y después de la adsorción de HEL es de 11,3% y 36,7%, respectivamente (Fig. 8c). Por tanto, la capacidad de adsorción de HEL de las microesferas de ATP-CG es de aproximadamente 340 mg / g. Sin embargo, se obtiene una pérdida de peso del 21,1% de ATP-CL antes de la adsorción de HEL y aparece un 37% en las microesferas adsorbidas con HEL (Fig. 8d). Entonces, la capacidad de adsorción de HEL es de 189 mg / g para microesferas de ATP-CL. Los resultados de TGA se cierran al resultado de la Fig. 7.
Espectros FT-IR y curvas TGA de microesferas antes y después de la adsorción de HEL . un Espectros FTIR y c Curvas TGA de microesferas ATP-CG, b Espectros FTIR y d Curvas TGA de microesferas ATP-CL
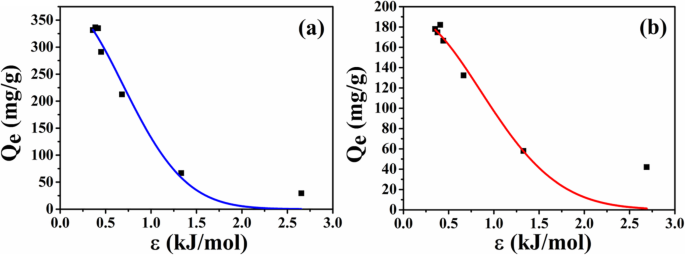
Para investigar la causa de la diferencia de capacidad de adsorción entre dos tipos de microesferas, los datos de adsorción de equilibrio de las microesferas se analizan adicionalmente de acuerdo con el modelo de isoterma D-R. Las curvas de ajuste se muestran en la Fig. 9 y los parámetros de ajuste se enumeran en la Tabla 1, respectivamente. A partir de los resultados del ajuste, el coeficiente de correlación de ATP-CG es más alto que el de ATP-CL, lo que sugiere que el modelo D-R es adecuado para describir el comportamiento de adsorción de fármacos de las microesferas de ATP-CG. Dado que el E valor es inferior a 8 kJ / mol, la adsorción de HEL en microesferas de ATP-CG es sorción física. La capacidad máxima ( Q m ) de microesferas de ATP-CG para HEL podría alcanzar hasta cerca de 381 mg / g, que está cerca del resultado de la Fig. 7a.

un Modelo de isotermas de adsorción de HEL en microesferas de ATP-CG. b Modelo de isotermas de adsorción de HEL en microesferas de ATP-CL
Dado que la adsorción de HEL en las microesferas de ATP-CG es una sorción física, se investiga el potencial de superficie de las microesferas. Como se muestra en la Fig. 10a, el valor de potencial zeta de ATP-CG, microesferas de ATP-CL y HEL en agua ultrapura es - 17 mV, - 22 mV y 20 mV, respectivamente. Después de la adsorción de HEL, el valor de potencial zeta de las microesferas de ATP-CG y ATP-CL cambia a 2,7 mV y 1,5 mV, respectivamente, lo que indica que la adsorción de moléculas de HEL en la superficie de las microesferas a través de la fuerza electrostática de atracción. Sin embargo, la fuerza electrostática atractiva no es la causa principal de la diferencia de capacidad de adsorción entre dos tipos de microesferas, porque no hay una diferencia significativa en los valores de potencial zeta (- 17 mV y - 22 mV) entre microesferas.
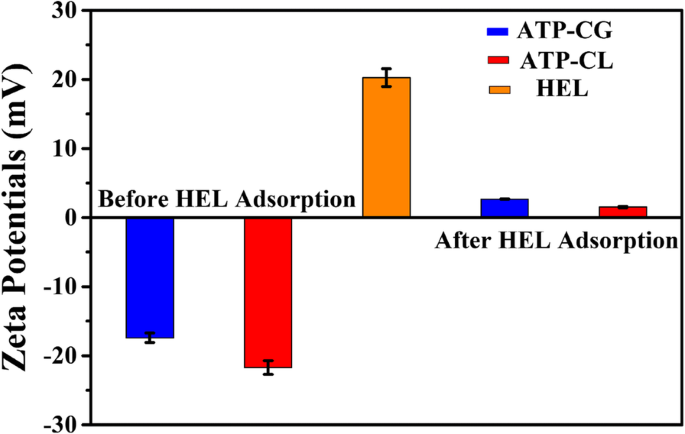
Potenciales zeta de HEL y microesferas antes y después de la adsorción de HEL
Por lo tanto, para aclarar aún más la razón que causa la diferencia de capacidad de absorción entre microesferas, se investiga el área superficial específica de las microesferas. Como se muestra en la Fig. 11a, el área de superficie específica BET ( S APUESTA ) de microesferas de ATP-CG es 143 m 2 g −1 , que es aproximadamente tres veces más alto que las microesferas de ATP-CL (55 m 2 g −1 , Tabla 2). Entonces, el área de superficie específica puede contribuir a la diferencia de capacidad de absorción entre microesferas. Esta alta superficie específica de las microesferas de ATP-CG se atribuye principalmente a la baja cristalinidad [31]. De la Fig. 11b, las microesferas de ATP-CG exhiben una cristalinidad más baja que la de las microesferas de ATP-CL. Además, la diferencia de cristalinidad entre ATP-CG y ATP-CL se debe principalmente a las diferentes condiciones de síntesis. Generalmente, la cristalinidad del producto aumenta con el grado de hidrólisis de los reactivos bajo cierta presión y temperatura. Aquí, la acidez del ácido glucónico (pKa =3.39) es más alta que la del ácido l-láctico (pKa =3.86), lo que provocaría una tasa de hidrólisis más lenta y finalmente presentaría una cristalinidad más baja. Como resultado, se obtienen microesferas de ATP-CG con un área de superficie específica más alta cambiando la fuente de calcio.
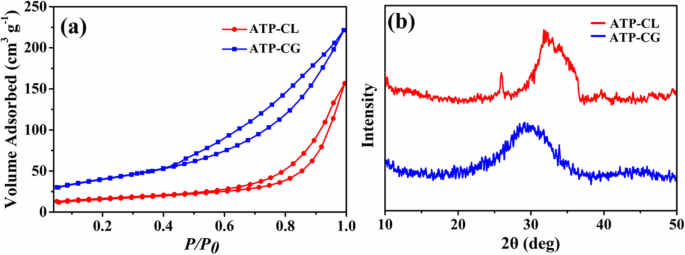
un Isotermas de adsorción-desorción de nitrógeno. b Patrones XRD de microesferas
Conclusiones
Las microesferas de cáscara de yema de ATP-CG se han diseñado utilizando ATP como fuente de fósforo orgánico y CG como fuente de calcio orgánico a través de un método hidrotermal asistido por microondas. Las microesferas muestran un área de superficie específica alta y una alta capacidad de adsorción. También se investigaron las influencias del Ca / P, la temperatura hidrotermal y el tiempo en la morfología y estructura de las microesferas. El estudio indica que la fuente de fósforo orgánico y la fuente de calcio orgánico tienen un efecto significativo en la formación de microesferas con estructura de cáscara de yema. Además, las condiciones hidrotermales que incluyen Ca / P, hidrotermal y temperatura son responsables de la formación de microesferas de cáscara de yema. Además, encontramos que el área de superficie específica y las propiedades químicas de la superficie, como el potencial de superficie, son dos factores clave que afectan la capacidad de adsorción de las microesferas al comparar el comportamiento de adsorción de HEL de dos tipos de microesferas sintetizadas con diferentes fuentes de calcio.
Disponibilidad de datos y materiales
Todos los datos que respaldan las conclusiones de este artículo se incluyen en el artículo.
Abreviaturas
- APUESTA:
-
Medidas de Brunauer-Emmet-Teller
- FTIR:
-
Espectroscopia infrarroja por transformada de Fourier
- TEM:
-
Microscopía electrónica de transmisión
- XRD:
-
Difracción de rayos X
- TGA:
-
Análisis de termogravimetría
- HRTEM:
-
TEM de alta resolución
- SAED:
-
Difracción de electrones de área seleccionada
Nanomateriales
- Preparación de nanopartículas de mPEG-ICA cargadas con ICA y su aplicación en el tratamiento del daño celular H9c2 inducido por LPS
- Absorbedor perfecto de banda ultra estrecha y su aplicación como sensor plasmónico en la región visible
- Síntesis fácil de compuesto de CuSCN coloreado y conductor recubierto con nanopartículas de CuS
- El efecto del plasma de no equilibrio por contacto sobre las propiedades estructurales y magnéticas de Mn Х Fe3 - X О4 Espinelas
- Efecto del tratamiento de recocido in situ sobre la movilidad y morfología de transistores de efecto de campo orgánico basados en TIPS-pentaceno
- Ajuste de las morfologías de la superficie y las propiedades de las películas de ZnO mediante el diseño de la capa interfacial
- Ajuste del rendimiento tribológico de nanoplaquetas de fosfato de circonio en capas en aceite mediante modificaciones de la superficie y de la capa intermedia
- Síntesis de nanocristales de ZnO y aplicación en células solares de polímero invertido
- Propiedades de láser y transporte del poli [(9,9-dioctil-2,7-divinilenfluorenileno) -alt-co- (2-metoxi- 5- (2-etilhexiloxi) -1,4-fenileno)] (POFP) para la aplicación de láseres sólidos orgánicos …
- Los efectos de acoplamiento de los polaritones de plasma superficial y las resonancias magnéticas dipolo en metamateriales
- Síntesis controlada de BaYF5:Er3 +, Yb3 + con morfología diferente para la mejora de la luminiscencia de conversión ascendente



