Diseño de liposomas sensibles al pH cargados con nanopartículas de aptámero-oro encapsulan la morina para tratar el cáncer
Resumen
Este estudio propone la síntesis de un tipo de nanopartículas anticáncer, aptámeros y liposomas sensibles al pH (MSL) de Morina modificada con nanopartículas de Au (Apt-Au), que exhibe propiedades de focalización. Los tumores son difíciles de curar porque su microambiente varía del del tejido normal; su pH es más bajo que el del tejido normal, lo que generalmente impide la eficacia de los fármacos. Por tanto, los fármacos que responden al pH han atraído una gran atención. Las nanopartículas de oro (AuNP) muestran potencial como portadores de fármacos debido a su pequeño tamaño, buena biocompatibilidad, fácil modificación de la superficie y fuerte penetración celular. Apt-Au @ MSL exhibe excelentes propiedades de monodispersidad y de direccionamiento tumoral y puede liberarse en un ambiente parcialmente ácido mediante diálisis. Examinamos nuestra célula cancerosa modelo mediante el ensayo MTT y descubrimos que las células SGC-7901 pueden suprimir eficazmente la proliferación. Los resultados in vivo demuestran que la administración de Apt-Au @ MSL podría inhibir el crecimiento tumoral en modelos de ratón de xenoinjerto. La tinción H&E y el ensayo TUNEL confirmaron además que Apt-Au @ MSL puede promover la apoptosis tumoral. Apt-Au @ MSL puede inducir la apoptosis al desencadenar la sobreproducción de especies reactivas de oxígeno (ROS) y regular la diafonía de múltiples señales. Tanto las pruebas de bioquímica sanguínea como la tinción con H&E sugirieron que estos materiales exhiben una toxicidad aguda insignificante y una buena biocompatibilidad in vivo. Con su potente función, Apt-Au @ MSL se puede utilizar como material anticanceroso basado en diana para futuros tratamientos clínicos contra el cáncer.
Introducción
Una de las causas de muerte más frecuentes [1], el cáncer, puede provocar pérdidas económicas sustanciales y daños a los seres humanos. Se han dirigido esfuerzos considerables hacia el desarrollo de fármacos inteligentes para el tratamiento del cáncer [2]. Debido a su capacidad para proteger los fármacos hasta que alcanzan el sitio objetivo, las nanopartículas de polímero pueden mejorar potencialmente la administración de fármacos terapéuticos [3]. Para garantizar que el agente terapéutico se administre al sitio activo, se utilizan nanopartículas altamente reactivas. Estas nanopartículas pueden diseñarse para variar en las propiedades del material bajo diferentes estímulos biológicos. Las nanopartículas reactivas se diseñan utilizando diferentes estímulos, incluidos estímulos externos (por ejemplo, temperatura y luz) y estímulos biológicos (por ejemplo, condiciones de pH o redox). Los NP que responden al pH han atraído el interés de la investigación debido a los cambios en el pH después de la endocitosis de nanopartículas. Los materiales que responden al pH también llaman la atención porque la función de respuesta al pH se puede integrar fácilmente en una variedad de estructuras poliméricas para diseñar un conjunto de nanopartículas que respondan al pH. Las nanopartículas pueden responder al pH mediante la alteración de la química de la superficie, el cambio en el tamaño o la forma de las partículas y la descomposición o liberación de sustancias. Este cambio en las propiedades de las nanopartículas se puede utilizar para regular la captación celular y la liberación controlada. Por lo tanto, las nanopartículas sensibles al pH proporcionan una estrategia poderosa para el diseño de sistemas de administración terapéutica.
El hidrato de morina (3,5,7,2 ′, 4′-pentahidroxiflavona) (Fig. 1) es una sustancia activa natural aislada de plantas o medicinas a base de hierbas chinas [4]. Es un compuesto de progesterona y un metabolito secundario del fenol en las plantas. La morina se distribuye ampliamente en la naturaleza y ejerce buenos efectos antioxidantes, anticancerosos [5] y antiinflamatorios significativos. El potencial de Morin para diversas aplicaciones ha atraído un interés considerable [6], pero dicho potencial está significativamente limitado por la baja solubilidad en agua y la biodisponibilidad de la sustancia [7].
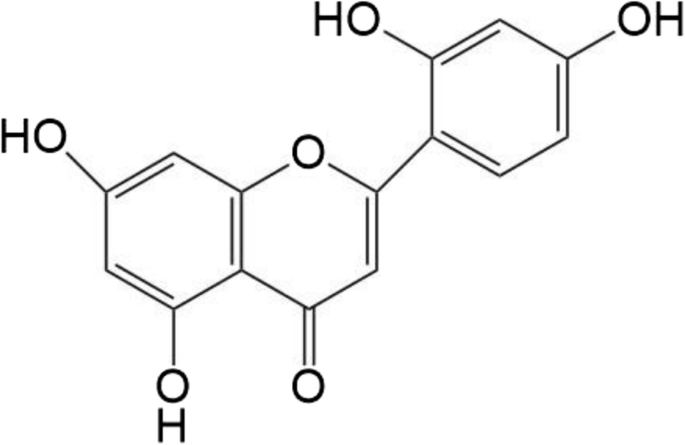
Estructura química del hidrato de morina
Los liposomas (huecos) compuestos por lecitina y ceramida, entre otros, tienen una estructura bicapa formada por moléculas lipídicas anfifílicas [8]. Los liposomas proporcionan características deseables, como biocompatibilidad, funcionalidad, efectos secundarios reducidos y capacidad para encapsular grandes cantidades de medicamento [9, 10]. Pueden transportar eficazmente agentes hidrófilos e hidrófobos y protegerlos de las condiciones externas, transportándolos con éxito a las regiones de tejido objetivo [11]. Se incorpora una eficacia mejorada en el diseño para facilitar la liberación del material anticanceroso desencadenada por el pH dentro del intersticio del tumor a través de liposomas sensibles al pH [12,13,14,15]. Estos liposomas sensibles al pH son liposomas especiales que liberan fármacos en entornos tisulares y se desestabilizan rápidamente en entornos ácidos, como los endosomas del tejido canceroso [16,17,18].
Para mejorar la selectividad y la eficacia del tratamiento tumoral, los liposomas sensibles al pH deben modificarse para formar nanopartículas dirigidas al tumor [19]. Recientemente se han desarrollado aptámeros de ADN como sensores de formación de imágenes y biosensores altamente selectivos y sensibles, así como agentes potenciales para terapias dirigidas contra el cáncer [20]. Se ha demostrado que el aptámero de ADN monocatenario AS1411 funciona como un agente quimioterapéutico debido a su alta afinidad de unión por los núcleos de las células cancerosas [21]. Este aptámero (Apt) se combinó con NP de Au para fabricar una nanoconstrucción de dos componentes de NP de Au cargada con Apt que pueden interactuar con los núcleos de las células cancerosas. Algunos estudios también han demostrado que el diseño de híbridos de liposomas y nanopartículas puede proporcionar una rica caja de herramientas para la fabricación de tales modalidades multifuncionales [22]. Se ha diseñado un sistema vesicular híbrido entre liposomas y NP de Au que consta de liposomas catiónicos y NP de Au para mejorar la penetración del fármaco en el intersticio del tumor y mejorar la actividad anticancerígena [23, 24].
Las nanopartículas de oro (NP de Au) se han considerado buenos portadores de fármacos y pueden modificarse con moléculas biorelacionadas para mejorar la especificidad dirigida al cáncer [25]. Con la modificación de la superficie de las NP de Au, el aptámero del grupo sulfhidrilo se puede usar para modificar la superficie de las NP de Au, que pueden ser dirigidas por el enlace covalente Au-S, y el grupo sulfhidrilo apropiado en la superficie del nano oro puede unirse a la superficie de nano oro [26]. Desde una perspectiva de ingeniería y aplicación, los nanomateriales de oro unidos a ligandos proporcionan una plataforma poderosa para facilitar la identificación, detección y tratamiento específicos.
En el estudio actual, utilizamos liposomas sensibles al pH que encapsulan Morin y ensamblamos Au-Apt que se modificó en la superficie de los liposomas (Apt-Au @ MSL, Fig. 3a). Morin, que se caracteriza por una baja solubilidad en agua y biodisponibilidad, se transformó. Se caracterizaron la morfología, el tamaño y otras propiedades del Apt-Au @ MSL preparado. La nueva nanopartícula mostró propiedades dirigidas al tumor y una alta actividad anticancerígena. La actividad anticancerosa de Apt-Au @ MSL se exploró in vitro e in vivo (Fig. 2).
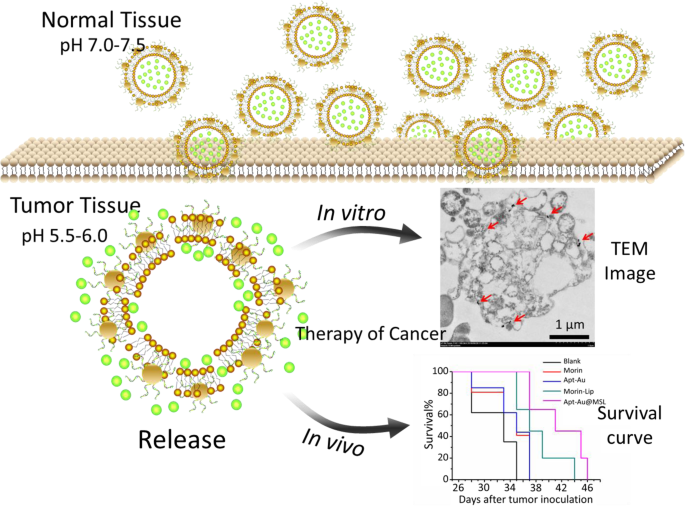
Diagrama esquemático propuesto de nuestro Apt-Au @ MSL diseñado que contiene Morin para la administración de fármacos a las células cancerosas con propiedad dirigida al tumor.
Materiales y métodos
Materiales
L-α-fosfatidilcolina (PC), colesterol (Chol), hemisuccinato de colesterilo (CHEMS), Morina (≥ 99,99%), citrato de sodio (99,9%), HAuCl 4 · 3H 2 Se adquirieron O (≥ 99,9%), polivinilpirrolidona (PVP, peso 40.000), NaOH (≥ 98,0%) y HCl (37%) de Sigma-Aldrich Chemical Co. (EE. UU.). El aptámero AS1411 con una modificación de disulfuro fue sintetizado por TaKaRa (Dalian, China) con la siguiente secuencia:5′-HS-T- (C6-S-S-C6) -TTG GTG GTG GTG GTT GTG GTG GTG GTG G-3 ′. Se adquirieron bromuro de tetrazolio azul de tiazolilo (MTT), yoduro de propidio (PI), calceína y Alexa Fluor 488 Annexin V de Sigma-Aldrich Chemical. Todas las soluciones acuosas se prepararon en agua bidestilada. Todos los demás reactivos eran los mejores disponibles comercialmente.
Síntesis de NP de Au
Hasta 1 ml de HAuCl 4 · 4H 2 Se disolvió O (1%) en 25 ml de agua Milli-Q (pH =5,5) y se añadieron 50 mg de PVP a la solución. La solución obtenida se vertió en un matraz de tres bocas (150 ml) y se trató mediante irradiación con microondas (MW) durante 5 min con agitación mecánica. Posteriormente, se añadieron rápidamente 1,5 ml de solución de citrato de sodio (1%) a la solución y se irradió por MW durante 3 min. La solución se recogió mediante centrifugación a 10000 rpm durante 5 min.
Síntesis de NP Apt-Au
El enlace disulfuro de los aptámeros se escindió usando tris (2-carboxietil) fosfina. Después de 30 min, se añadió la solución de aptámero (100 μL, 100 μM) a 10 ml de solución 5 nM de NP de Au y luego se incubó durante 24 h para formar NP de Au-Apt. Después de 1 día, salamos la solución mezcla con 2,5 ml de una solución 500 mM de NaCl dos veces, separados por 4 h [27].
Preparación de liposomas sensibles al pH
Los liposomas compuestos de huevo PC a CHEMS a Chol en la proporción molar de 33:13:5 y 5% de Morin se prepararon mediante hidratación de película. Se disolvieron Egg PC, CHEMS, Chol y 2 mg de Morin en 8 mL de CHCl 3 , y los disolventes orgánicos se eliminaron a 40 ° C con un evaporador rotatorio. Para los liposomas de Morin, la película de lípidos delgada resultante se hidrató con PBS al 2% (p / v) y luego se sonicó con una sonda de baño de hielo durante 15 min. El liposoma final se sintetizó y estabilizó en el sistema coloidal. Para los liposomas sensibles al pH Apt-Au @ Morin (Apt-Au @ MSL), la película lipídica se hidrató con NP de Au-Apt 475 μg / ml en dextrosa al 5% seguido de sonicación [23].
Caracterización
Se realizaron espectroscopía ultravioleta-visible (UV-Vis, S-3100 Photodiode Array, Scinco Co., Ltd., Corea) y espectroscopía infrarroja por transformada de Fourier (FT-IR) (Nicolet iS50, EE. UU., Thermo Fisher Scientific). La morfología del Apt-Au @ MSL se examinó mediante microscopía electrónica de transmisión (TEM, HT7700, Tokio Japón, Hitachi). El porcentaje de liberación de Morin se detectó mediante espectroscopía UV-vis. La morfología de los liposomas de Morin y Apt-Au @ MSL también se observó mediante microscopía electrónica de barrido (SEM, S-4800, Hitachi, Japón). Se utilizaron medidas de dispersión dinámica de luz (DLS) y potencial zeta para caracterizar las propiedades ópticas y los tamaños de los liposomas de Morin y Apt-Au @ MSL en un analizador de potencial Brookhaven ZetaPALS.
Cultivo celular
Las líneas celulares de cáncer humano, SGC-7901, BGC-823, A549, HeLa, MCF-7 y Hs68, se compraron en American Type Culture Collection (ATCC) y se mantuvieron en RPMI con suero bovino fetal al 10% a 37 ° C y 5% CO 2 .
Estudio de actividad anticáncer in vitro
SGC-7901, BGC-823, A549, HeLa, MCF-7 y Hs68 se sembraron en placas de 96 pocillos (2,0 × 10 3 células / pocillo) y luego se cultivó con Apt-Au @ MSL en concentraciones variables (0, 5, 10, 15, 20 y 30 μg / mL). Se asignaron NP de Au y Morin como grupos de control. El grupo en blanco estaba formado por células no tratadas. Las placas de 96 pocillos se incubaron en una incubadora humidificada. Después de la incubación, se añadieron 9,6 ml de solución de MTT (5 mg / ml) a cada pocillo y se incubaron durante 2 h más. Cada grupo se probó por triplicado y la CI 50 los valores se derivaron de los valores medios de DO de las pruebas por triplicado frente a las curvas de concentración de fármaco. El brillo de cada grupo se obtuvo mediante microscopía de fluorescencia confocal [28].
La adhesión celular se controló utilizando un sistema de detección electrónica celular en tiempo real (RT-CES; ACEA Biosciences, Inc.) cada 10 min durante 75 h. Para determinar la adhesión celular, cada pocillo de la placa se sembró con células (1.0 × 10 4 células / pocillo) con un medio fresco hasta un volumen final de 200 μL y luego se incuban en una solución Apt-Au @ MSL a concentraciones variables (10, 20 y 30 μg / mL) a 10 h incubados durante 12 h [29] . El grupo en blanco consistió en células no tratadas, y los grupos de control consistieron en los grupos de liposomas Morin y Morin.
Microscopía de fluorescencia
Se cultivaron células SGC-7901 en las placas de 48 pocillos durante la noche a 37 ° C, 5% de CO 2 . Luego, las células se trataron con soluciones de Apt-Au @ MSL (10 y 30 μg / mL) a diferentes concentraciones durante 12 h. Los grupos de control consistieron en los grupos de liposomas Morin y Morin. Posteriormente, se retiró el medio. El grupo en blanco estaba formado por células no tratadas. Las células se lavaron con PBS tres veces. Las células se tiñeron y luego se midieron mediante tinción conjunta de células vivas y muertas (el ensayo LIVE / DEAD). Después de la tinción conjunta con calceína-AM / PI durante 30 min, las células se lavaron con PBS dos veces para eliminar el exceso de tinte, y se obtuvieron imágenes de fluorescencia mediante microscopía de barrido láser confocal (CLSM) (para calceína-AM, Ex =488 nm y Em =515 nm; PI Ex =535 nm y Em =615 nm [30]).
Análisis de muerte celular apoptótica
Para medir los efectos anticancerígenos de Apt-Au @ MSL, cada pocillo de una placa de seis pocillos se sembró con células SGC-7901 (1,0 × 10 5 células / pocillo) y luego se incubaron en soluciones de Apt-Au @ MSL a concentraciones variables (5, 10, 20 y 30 μg / mL) durante 12 h. El grupo en blanco consistió en células no tratadas y los grupos de control consistieron en los grupos de liposomas Morin y Morin. Después del tratamiento, las células se recogieron y se lavaron con PBS dos veces. Las células se tiñeron con PI y Anexina V-FITC y luego se analizaron con un analizador CytoFLEX (Beckman Coulter) (para PI, Ex =535 nm y Em =615 nm; Anexina V-FITC, Ex =488 nm y Em =525 nm ) [31].
Estudios sobre la destrucción de muros
Para estudiar la destrucción de la pared celular en un ensayo contra el cáncer, las células SGC-7901 se cultivaron en placas de seis pocillos a 37 ° C y 5% de CO 2 . Las células cultivadas sin el material se utilizaron como grupo en blanco. Después de que las células se cultivaron con Apt-Au @ MSL en concentraciones variables (5, 10, 20 y 30 μg / mL) durante 12 h, se trataron con solución de tripsina-EDTA al 0,25%. Todas las células (incluidas las células flotantes en el medio) se recogieron a 2000 r / min durante 5 min. Las células recolectadas se fijaron posteriormente en una solución de dialdehído glutárico al 2,5% durante 4 h [32]. Las células fijadas se deshidrataron en una serie de gradientes de acetona durante 20 min. Finalmente, las células se sometieron a una serie de procedimientos, se montaron en rejillas de cobre y se observaron mediante TEM (HT-7700, Hitachi, Japón).
Ensayo de transferencia Western
La expresión de proteínas de las células SGC-7901 se detectó mediante análisis de transferencia Western. Se inocularon células SGC-7901 (4,0 x 105 células / pocillo) en una placa de cultivo de 9 cm y 20 μg / ml de Apt-Au @ MSL durante 1, 6, 12 y 24 h. Las células se recogieron después del tratamiento y se suspendieron en un tampón de lisis celular en hielo durante 1 h. La mezcla se colocó en una centrífuga a 11.000 g a 4 ° C durante 10 min, y se recogió el sobrenadante que contenía proteína celular total. La concentración de proteína total en el sobrenadante se determinó utilizando el método BCA. Después, la proteína se resuspendió en el tampón de carga y se hirvió a 100 ° C durante 10 minutos. Las muestras que contenían cantidades iguales de proteína (40 µg / carril) se sometieron a SDS-PAGE (geles de tricina al 10%). Luego se transfirieron a membranas de nitrocelulosa (NC) a 100 V durante 1,5 hy se bloquearon usando leche desnatada al 5% en solución salina tamponada con Tris con Tween-20 al 0,1% (TBST) durante 1 h. Luego, la membrana NC se incubó con los anticuerpos primarios y el segundo anticuerpo, respectivamente. Las bandas de proteína diana se visualizaron en la membrana usando los reactivos de detección de transferencia Western ECL. La β-actina se utilizó como control interno de la carga y transferencia de proteínas iguales. La expresión de proteínas se cuantificó mediante el software de cantidad uno, y la tasa de expresión se etiquetó debajo de la banda [33].
Modelo animal
Se adquirieron ratones desnudos macho BALB / c (~ 17 g) del Centro de Investigación de Animales Modelo de la Universidad de Nanjing y se criaron en un entorno axénico (animales libres de patógenos específicos). Los modelos tumorales se establecieron mediante inyección subcutánea de suspensión celular (células SGC-7901, 100 μL, 1 × 10 6 / mL) en el hombro de los ratones desnudos. Se generaron imágenes brillantes del tumor 15 días después de la inyección subcutánea de células tumorales. Todos los experimentos con animales se realizaron de acuerdo con los protocolos aprobados por el Centro de Animales de Laboratorio de la Universidad Agrícola de Anhui (Número de permiso:SYXK 2016-007). Se utilizó un calibre de nonio para determinar el diámetro longitudinal máximo (longitud) y el diámetro transversal máximo (ancho) de cada tumor. A continuación, se calculó el volumen del tumor utilizando la fórmula longitud × ancho 2 × 0,5 [34].
Estudio in vivo contra el cáncer
Se realizaron pruebas de seguimiento cuando el volumen del tumor alcanzó 50 mm 3 . Los ratones divididos aleatoriamente en cinco grupos se sometieron a los siguientes tratamientos intravenosos:PBS (100 μL), Morin, liposomas de Morin, Au-Apt y Apt-Au @ MSL. Los ratones se inyectaron por vía intravenosa en la cola a una dosis de 2 mg / kg del material para el tratamiento. Los tamaños de los tumores de los ratones se midieron después de 24 días. También se determinaron el peso corporal y la supervivencia de los ratones. Los ratones fueron sacrificados y se recolectaron tejidos de órganos y tumores de los ratones para tinción con H&E [35, 36].
Después del bloqueo y la permeabilización, los portaobjetos de tumor se lavaron con PBS, se tiñeron con el ensayo TUNEL y se sometieron a contratinción con DAPI. Las imágenes de fluorescencia se obtuvieron mediante CLSM. Para imágenes DAPI, Ex =358 nm y Em =461 nm, y para el ensayo TUNEL, Ex =450–500 nm y Em =515–565 nm [37].
Ensayo de evaluación de toxicidad
Para evaluar la toxicidad del tratamiento con Apt-Au @ MSL en órganos vitales, los ratones de los cuatro grupos de tratamiento se sacrificaron después de 30 días. Los órganos importantes (hígado, bazo, riñones, corazón, pulmones y tumor) de los ratones de todos los grupos se recogieron y se tiñeron con H&E. También se recogieron muestras de sangre y se midió la glucosa en sangre. Además, se determinó el peso de los ratones [38].
Resultados y discusión
Caracterización
El presente estudio tuvo como objetivo desarrollar un nuevo liposoma que posea las ventajas de las nanopartículas (NP de Au cargadas con Apt) y pueda usarse de manera efectiva como un agente contra el cáncer. Las propiedades básicas de los nuevos liposomas son importantes para realizar más estudios. Apt-Au @ MSL se sintetizó como se describe en un estudio anterior [23], con modificaciones menores, y luego se caracterizó utilizando varios métodos (Fig. 3). La Figura 3b presenta los resultados de la espectroscopía UV-vis, que muestra el pico característico y puede monitorear la formación de NP de Au. Se observaron picos característicos en el espectro UV-vis de NP de Au a aproximadamente 530 nm. Específicamente, el análisis de espectros UV-vis mostró una fuerte absorbancia de UV, que fue influenciada por la modificación de la superficie Apt. Se observaron los mismos resultados. Los picos característicos se desplazaron después de que los liposomas sensibles al pH se recubrieron con Morin. El pico característico del Apt-Au @ MSL fabricado se ubicó a 362 y 550 nm. Estos resultados indicaron que la síntesis se completó con éxito. Para una mayor caracterización, se realizó espectroscopía FT-IR para verificar los resultados de la síntesis. El desplazamiento al rojo de los picos característicos de los liposomas de Morin y Apt-Au @ MSL indicaron además la modificación exitosa de Morin (Fig. 3c). Realizamos un ensayo de liberación de morina en PBS a diferentes niveles de pH para determinar la sensibilidad al pH de Apt-Au @ MSL. Estos tres valores de pH simulan el entorno neutro de la circulación sanguínea, el entorno levemente ácido del tumor y el entorno ácido del cuerpo intracelular. El porcentaje de liberación de Morin se detectó mediante espectroscopía UV-vis. A pH 5,0, se liberó aproximadamente el 54% de Morin en 24 h, y se observó una liberación continua en las siguientes 96 h; mientras tanto, a pH 7,4, sólo se liberó alrededor del 10% de Morin en 24 h. Estos resultados muestran que Apt-Au @ MSL exhibe una buena estabilidad en condiciones fisiológicas normales, evitando la fuga del fármaco; sin embargo, la droga se libera rápidamente en el cuerpo nuclear. Este comportamiento de liberación del fármaco puede mejorar eficazmente el efecto del tratamiento (Fig. 3d). Se realizaron TEM y SEM para dilucidar las estructuras del liposoma y Apt-Au @ MSL (Fig. 3f). TEM se llevó a cabo para dilucidar las estructuras de los AuNP. Como se muestra en la Fig. 3g, las AuNP tienen un tamaño de partícula de aproximadamente 10 nm, que es consistente con el tamaño de la modificación en los liposomas (Fig. 3g). Los resultados de SEM en la Fig. 3e indican que los liposomas en bruto forman únicamente vesículas unilaminares con un diámetro no uniforme de aproximadamente 120 nm, que es consistente con el tamaño determinado por DLS. Por el contrario, Apt-Au @ MSL muestra que la morfología de las vesículas híbridas se atribuye a la modificación de Au-Apt. El diámetro de 150 nm también fue consistente con el tamaño determinado por DLS (Fig. 3i). En particular, la investigación de TEM de las interacciones entre los liposomas sensibles al pH y Au-Apt reveló que las NP de Au estaban asociadas casi exclusivamente con la bicapa lipídica vesicular y localizadas en la periferia de las vesículas (Fig. 3h). Las medidas del potencial ζ se presentan en la Fig. 3j, y los potenciales zeta de Au NP y Au-Apt son negativos. El resultado muestra que tanto Au NP (- 57,1 ± 0,3 mV) como Au-Apt están cargados negativamente (- 31,7 ± 0,2 mV). Apt-Au @ MSL se modificó con liposomas de Morin cargados positivamente y el potencial cambió a 36,4 ± 0,3 mV. La adsorción de carga positiva y negativa es el mecanismo por el cual se unen los liposomas Au-Apt y Morin. Además, la Fig. 3k representa el cambio en la velocidad de encapsulación de la partícula a lo largo del tiempo, lo que indica la estabilidad de la partícula durante un período de tiempo. Como se muestra en la Fig. 3k, la velocidad de encapsulación de la partícula apenas cambia en 24 h, lo que indica que la partícula exhibe una buena estabilidad durante un período de tiempo. La curva estándar de concentración de Morin versus la absorbancia UV-Vis de Morin se preparó para estudiar la tasa de encapsulación de Morin-liposoma y Apt-Au @ MSL. Los resultados revelaron que la eficiencia de atrapamiento del liposoma Morin y Apt-Au @ MSL puede alcanzar el 90,2% y el 89,6%, como se muestra en la Tabla S1 y la Fig. S1
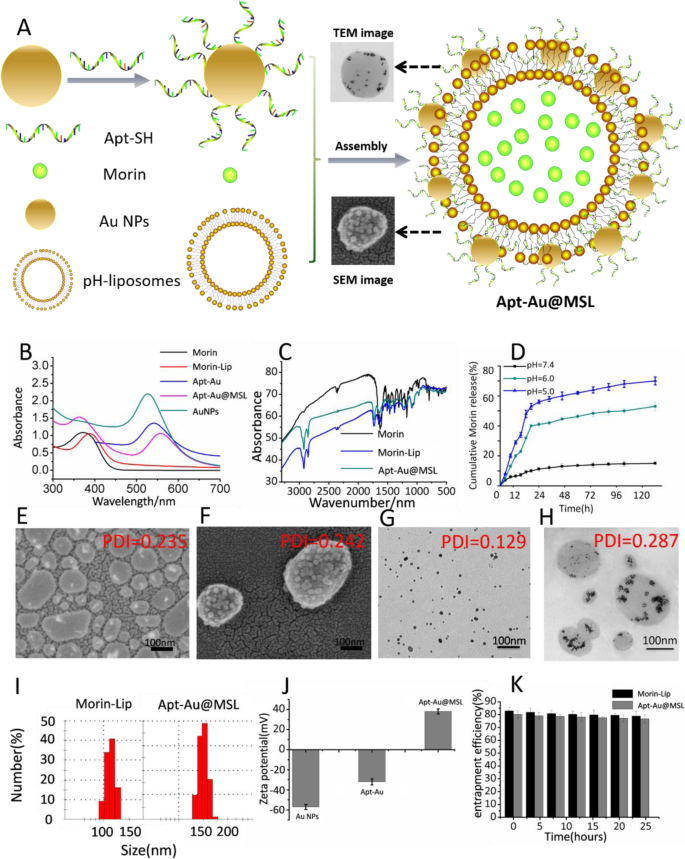
Imágenes de caracterización. un Ilustración esquemática de la síntesis de Apt-Au @ MSL. b Espectros de absorción ultravioleta de Morin, Au NP, Au-Apt, Morin-liposoma y Apt-Au @ MSL. c Espectrómetros FT-IR de Morin, Morin-liposoma y Apt-Au @ MSL. d El comportamiento de liberación de Morin de Apt-Au @ MSL en diferentes condiciones de pH. e Imagen SEM del liposoma de Morin. f Imagen SEM del Apt-Au @ MSL. g Imagen TEM de los NP de Au. h Imagen TEM del Apt-Au @ MSL. yo Los diámetros de Morin-liposoma y Apt-Au @ MSL se determinaron al menos tres veces mediante DLS. j ζ-Potencial de Au NP, Apt-Au y Apt-Au @ MSL. k Tasa de eficiencia de atrapamiento (EE%) del liposoma Morin y Apt-Au @ MSL
Prueba de actividad anticancerígena de Apt-Au @ MSL
In Vitro
Morin exhibe una actividad antitumoral superior pero tiene baja biodisponibilidad debido a su baja solubilidad en agua. Después de que Morin fuera encapsulado por liposomas sensibles al pH y transformado en un material soluble en agua, la superficie del liposoma se modificó usando Au-Apt para obtener el efecto antitumoral dirigido. La Figura 4a muestra la actividad anticancerosa de Apt-Au @ MSL mediante ensayo MTT in vitro. La concentración de fármaco se define por la concentración de Morin. El grupo tratado con Morin no mostró actividad anticancerosa aparente, en comparación con el grupo en blanco. Sin embargo, el grupo tratado con Morin encapsulado por liposomas sensibles al pH exhibió una actividad anticancerígena mejorada. El resultado sugiere que la actividad antitumoral de los liposomas de Morin fue superior a la de Morin crudo. Simultáneamente, encontramos que se mejoró la actividad antitumoral del liposoma modificado por Apt (Apt-Au @ MSL). La Tabla 1 enumera el IC 50 valores de Morin, liposomas de Morin, Apt-Au @ MSL y cisplatino. Morin, liposomas de Morin y Apt-Au @ MSL exhibieron una amplia gama de actividad anticancerígena en las células tumorales. Mostraron una clara preferencia por las células SGC-7901 con alta potencia y baja toxicidad hacia las células humanas normales. El IC 50 El valor de Apt-Au @ MSL fue de 15,6 ± 1,5 μg / ml para las células SGC-7901. Estos resultados fueron confirmados adicionalmente por pruebas RTCA. Las células SGC-7901 se cultivaron con Apt-Au @ MSL a diferentes concentraciones; el grupo en blanco se trató con PBS y el grupo de control consistió en Morin y liposomas de Morin. La adhesión y la extensión se controlaron usando iCELLigence (Fig. 4b). Los resultados fueron en gran medida similares a los obtenidos por las pruebas MTT. La actividad antitumoral de Apt-Au @ MSL fue significativamente mayor que la de los liposomas de Morin y Morin. Apt-Au @ MSL podría inhibir la proliferación de células SGC-7901 con un aumento de concentración. También se observaron cambios en la morfología celular después del tratamiento con Apt-Au @ MSL mediante microscopía de fluorescencia. Como se muestra en la Fig. 4c, las células SGC-7901 sin Apt-Au @ MSL mantienen la integridad estructural de la célula. Por el contrario, la integridad celular se ve comprometida después de que las células se tratan con Apt-Au @ MSL en diferentes concentraciones.
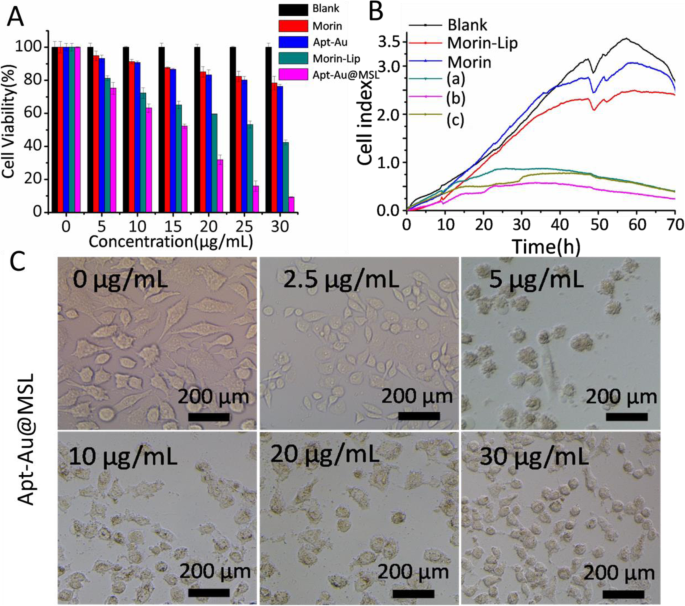
un Viabilidad celular de las células SGC-7901 incubadas con diferentes materiales (Morin, Au-Apt, Morin-liposoma y Apt-Au @ MSL) a diferentes concentraciones (0, 5, 10, 15, 20 y 30 μg / mL). La celda tratada con PBS se estableció como grupo en blanco. b La curva de proliferación celular de las células SGC-7901 se detectó mediante el sistema RT-CES. Los diferentes compuestos se agregaron a las 10 h. Las concentraciones de a , b y c son diferentes Apt-Au @ MSL (10, 20 y 30 μg / mL), respectivamente. c Las imágenes de células brillantes en las diferentes concentraciones (0, 2.5, 5, 10, 20 y 30 μg / mL)
Análisis de muerte celular apoptótica
El análisis cuantitativo de la apoptosis se realizó mediante citometría de flujo utilizando tinción con Annexin-FITC. Las células se tiñeron con PI y anexina V-FITC y luego se analizaron usando un citómetro de flujo CytoFLEX (Beckman Coulter). Se usó anexina V para detectar células apoptóticas tempranas unidas a la fosfatidilserina expuesta, y se usó marcaje con PI para teñir las células apoptóticas tardías. La tasa de apoptosis fue del 1,57% para los grupos en blanco. Las células tratadas con Morin mostraron una tasa de apoptosis del 3,51%. Apt-Au @ MSL a diferentes concentraciones exhibió una mayor capacidad de inducción con relaciones de apoptosis de 7,44%, 10,75%, 15,53% y 40,77% (Fig. 5). El aumento de la apoptosis también confirmó la destacada actividad anticancerosa inducida por Apt-Au @ MSL. La tasa de apoptosis de las células SGC-7901 aumentó con el aumento de la concentración de Apt-Au @ MSL.
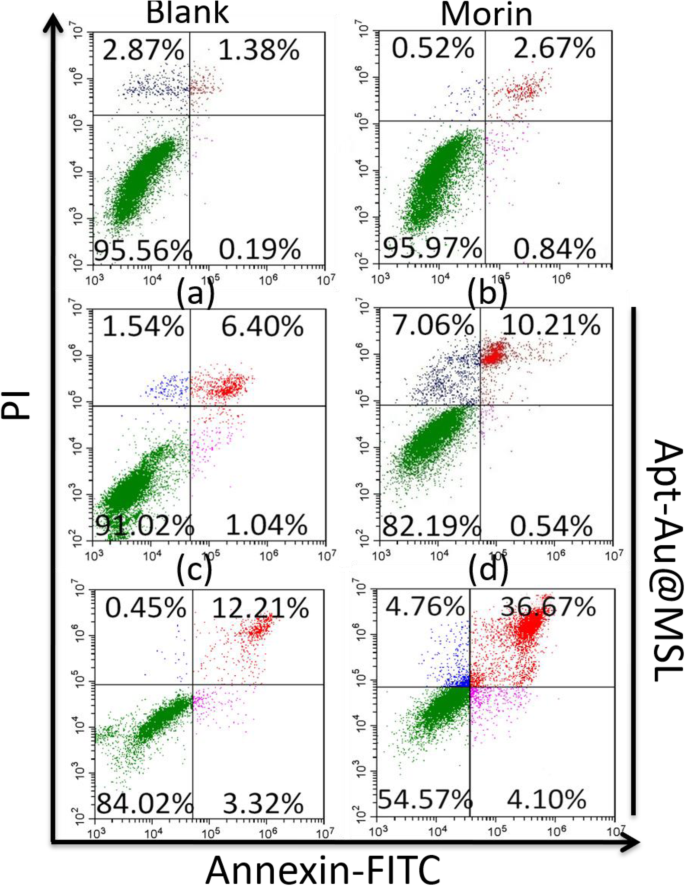
Análisis de citometría de flujo basado en tinción con anexina V-FITC / PI de la apoptosis SGC-7901 después del tratamiento con diferentes métodos. La concentración de a , b , c y d es de 5, 10, 20 y 30 μg / mL, respectivamente
Estudio de actividad anticancerígena mediante ensayo de fluorescencia
El efecto antitumoral sobre las células SGC-7901 inducido por Apt-Au @ MSL se evaluó intuitivamente mediante ensayos de fluorescencia LIVE / DEAD. Después de que las células se incubaron con Morin, liposomas de Morin y Apt-Au @ MSL a diferentes concentraciones, se tiñeron conjuntamente con el kit LIVE / DEAD durante 30 minutos en condiciones de oscuridad. En la Fig. 6, las células del grupo en blanco muestran que todas las células de fluorescencia verde representan células vivas. Los grupos de control, incluidos los liposomas de Morin y Morin, muestran el número de células rojas fluorescentes. Sin embargo, las células que se trataron con Apt-Au @ MSL a diferentes concentraciones exhibieron claramente un gran número de células apoptóticas. Con un aumento de la concentración, las células vivas disminuyeron gradualmente. El porcentaje de células muertas aumentó predominantemente y la densidad celular disminuyó. El resultado confirmó que Apt-Au @ MSL puede promover eficazmente la apoptosis tumoral.
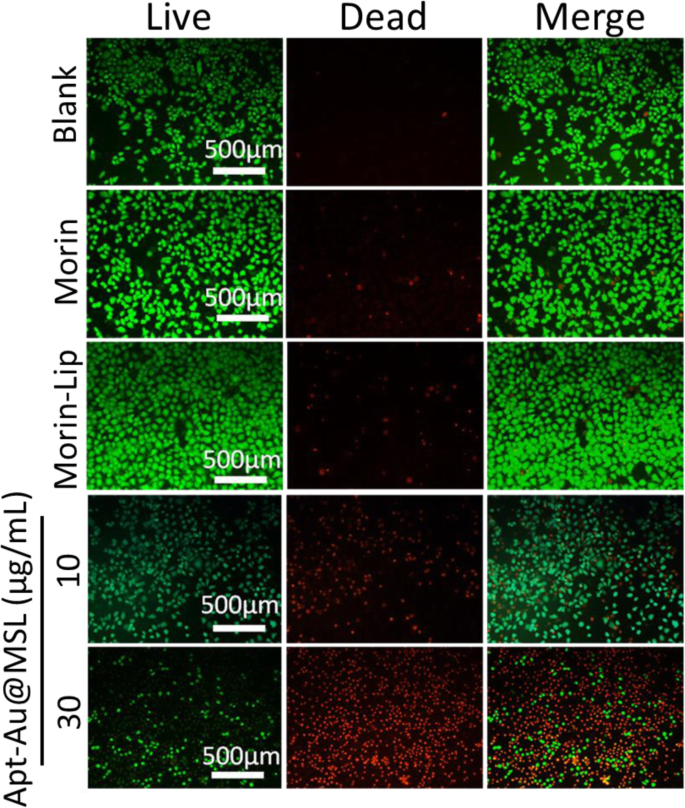
Imágenes microscópicas de fluorescencia de SGC-7901 incubadas con diferente concentración de Apt-Au @ MSL y posterior tinción breve. El grupo en blanco fue PBS. Los liposomas de Morin y Morin se establecieron como grupo de control
Estudio de integridad celular
Para confirmar la influencia de la captación y el transporte de Apt-Au @ MSL a la célula SGC-7901, realizamos el ensayo TEM. El cambio en la morfología celular fue observado por TEM. Se realizaron imágenes TEM para observar la estructura interna de las células y proporcionar una referencia para los mecanismos anticancerígenos. Como se muestra en la Fig. 7, las imágenes en blanco de las células SGC-7901 sin tratamiento exhibieron cambios significativos en la morfología y apariencia de las paredes celulares claras. En el grupo de control (Morin y Morin-liposomas), la morfología celular mostró daño parcial y la región nuclear se contrajo. Sin embargo, también se observaron cambios significativos en la pared celular y la estructura interna después de la exposición a Apt-Au @ MSL. El citoplasma se filtró y la estructura nuclear se volvió confusa. Se formaron muchos fragmentos de células alrededor de células huecas. Además, las paredes celulares se desintegraron o fueron destruidas. Los perfiles completos se volvieron confusos, las células se dañaron y el citoplasma se filtró. Las flechas rojas representan el área de Au NP. As the concentration of the Apt-Au@MSL increased, more Au NP regions appeared in the nucleus. This occurrence suggested the release of Morin after Apt-Au@MSL entered the cell interior, hence the appearance of a large amount of Au NPs. These aforementioned results suggest that antitumor activity was associated with compromised cell integrity and nuclear structure.
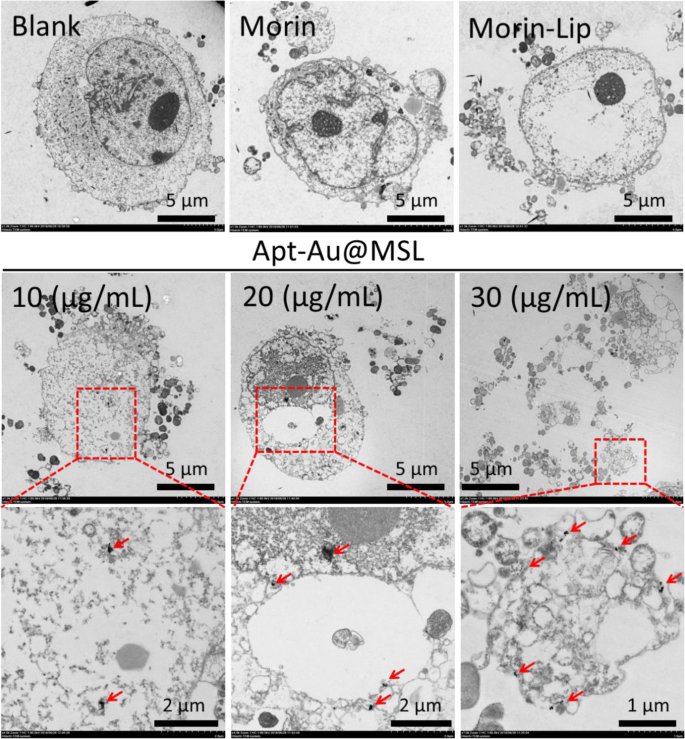
TEM images of SGC-7901 cells treated with different concentration of Apt-Au-MSL (10, 20, and 30 μg/mL). The blank group was PBS. The Morin and Morin–liposome were set as control group. The red square is the enlarge area. The red arrow point to Au NPs
Molecular Mechanism Induced by Apt-Au@MSL
To explore the molecular mechanism of Apt-Au@MSL-induced apoptosis, we detected the expression levels of caspases and PARP. Activation of caspase-3, -8, and -9 was first detected with specific substrates. As shown in Fig. 8a, Apt-Au@MSL treatment induces dose-dependent activation of caspase-3, -8, and -9. Caspase-9 promotes mitochondria-mediated apoptosis more than does caspase-8, indicating that the mitochondria-mediated apoptosis signaling pathway is dominant. Western blot analysis further confirmed the existence of Apt-Au@MSL-induced apoptosis at the protein level. Figures 8b and c show that after cells are treated with Apt-Au@MSL, activation of caspases and cleavage of PARP shows time and dose dependence (Figs. 8b, c). In Fig. 8d, e, the Western blot analysis confirmed our results. In conclusion, Apt-Au@MSL inhibits the growth of SGC-7901 cells mainly by inducing apoptosis.
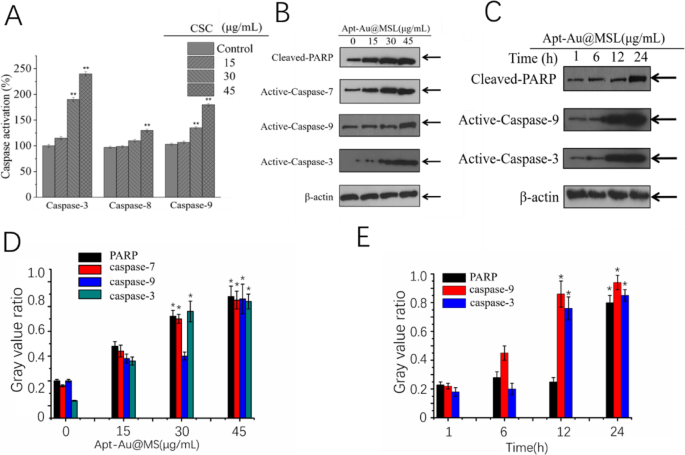
Apt-Au@MSL induced apoptosis in SGC-7901 cells. un SGC-7901 cells were treated with indicated concentrations of Apt-Au@MSL for 24 h. Then, the total protein was extracted and incubated with synthetic Apt-Au@MSL substrates for measuring caspase activities. Dose-dependent (b ) and time-dependent (c ) effects of Apt-Au@MSL on PARP and caspases expression. d , e Quantitative analysis of PARP, caspase-7, caspase-9, and caspase-3 expressions. Data are means ± SD, *P <0.05, ** P < 0.01
Apt-Au@MSL Inhibits Tumor Growth
In Vivo
The in vivo antitumor activities of Apt-Au@MSL were evaluated using an SGC-7901 tumor xenograft model. A comparison of the images of the tumors with those of the control group (Morin and Morin–liposomes) showed that mice treated with Apt-Au@MSL markedly reduced the weight and size of the tumor (Fig. 9a). The relative tumor volume curves and the mice weight curves indicate that the Apt-Au@MSL in vivo exhibits a higher anticancer efficiency (Fig. 9b) than those of the other treatment groups. No significant difference in average tumor volume was indicated between the control group (Morin and Morin–liposomes) and the blank group. The tumor volume of the Apt-Au@MSL group was only nearly a tenth of the blank group and nearly a sixth of the control group. The result indicated that raw Morin and Morin–liposomes at 40 mg/kg exerted no effect on the growth rate of tumors. However, Apt-Au@MSL could inhibit tumor growth. The body weight of mice in the different groups (PBS, Morin, Morin–liposomes, and Au-Apt groups) showed no marked fluctuation (Fig. 9c) during the treatment period. This result suggested that the treatment was tolerated and caused no acute side effects. Notably, we found that the mice with Apt-Au@MSL treatment showed markedly prolonged survival (Fig. 9d). The surviving mice in this group behaved normally, showing no apparent sign of unhealthy condition. These results demonstrated that the administration of Apt-Au@MSL could inhibit tumor growth in xenograft mouse models.
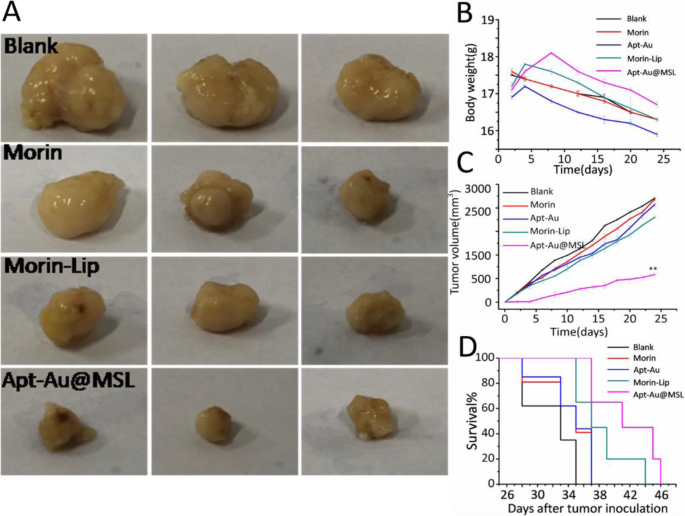
un In vivo applications of Apt-Au@MSL and photographs of the mice tumor taken 24 days. A dosage of 2 mg/kg was administrated intravenously for all mice (n = 6–8). b Tumor weight of mice in different groups after 24 days. c Tumor volume index for the different treatment groups. The tumor sizes were measured at the indicated time points. d Survival rate of the mice in different group after tumor inoculation. Data are means ± SD (n = 6-8). The intravenous injection of PBS was set as blank group (100 μL); the treated by Morin and Morin–liposome were set as control group. In vivo therapeutic effects of Apt-Au@MSL in SGC-7901-bearing mice. Data are means ± SD, *P <0.05, ** P < 0.01
Histological Analysis of Anticancer Activity
H&E staining of tumor tissue and organ samples was conducted after fixation and treatment. Treatment efficacy with respect to tumor cell death was also evaluated by H&E staining of tumor tissue from different groups. In Fig. 10a, the mice treated with Au-Apt, Morin, and Morin–liposomes show the same extent of thermal damage as that of the mice in the blank group. No apparent apoptosis was observed in the blank group. The tumor tissue sections consisted of tightly packed tumor cells. However, Apt-Au@MSL treatment exhibited the most significant damage to the tumor tissue, with moderate cell apoptosis in the tumor. The result suggested anticancer activity in the mouse models treated with Apt-Au@MSL. To further investigate the ratio of apoptotic cells in tumors tissue in vivo, TUNEL assay was performed for the detection of apoptotic cells. As shown in Fig. 10b, the apoptotic cells in tumors can be stained with green fluorescence to indicate apoptosis. The merged images show fewer green fluorescent regions in the blank group and the control group (Morin and Au-Apt), indicating the presence of fewer apoptotic cells. The cells of the mice treated with Morin–liposomes appear partly apoptotic. Moreover, a large number of green fluorescent regions were observed in the group treated with Apt-Au@MSL, indicating a large amount of apoptotic cells. The results were consistent with that of H&E staining, confirming that Apt-Au@MSL can promote tumor apoptosis in vivo.
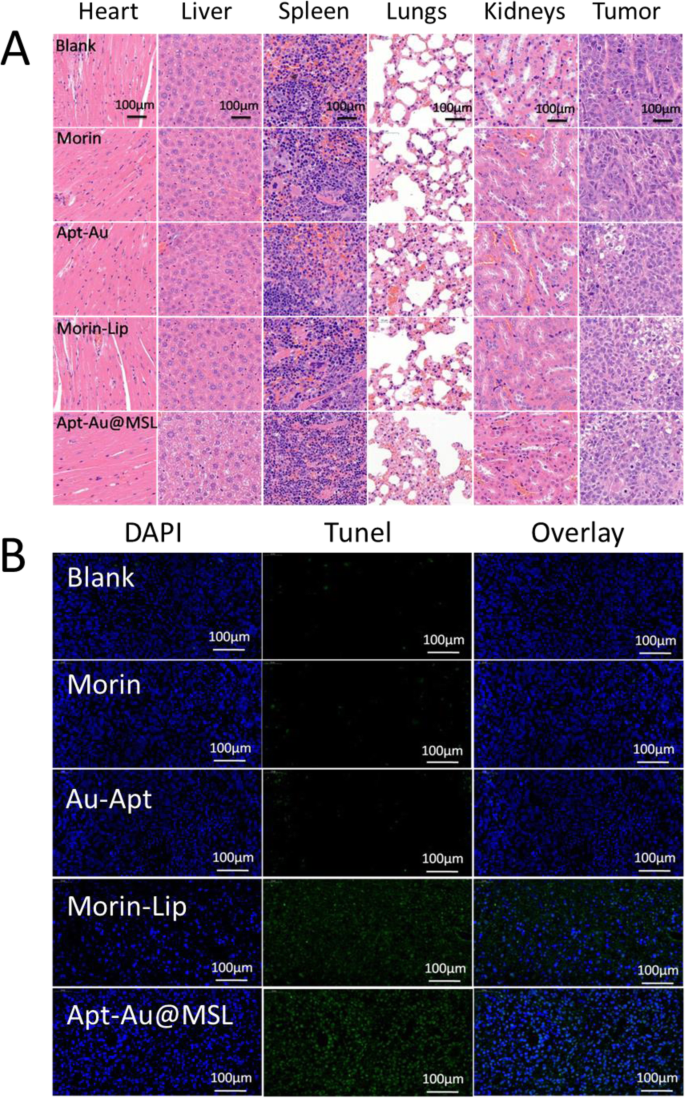
un H&E staining analysis of the tumors in mice. Histological analysis of the tumors in mice following different treatments as PBS, Morin, Morin–liposome, Au-Apt, and Apt-Au@MSL group. b Apoptotic cells were detected by a TUNEL assay (green) and co-stained by nuclear staining DAPI (blue)
In Vivo Toxicity Evaluation
The potential in vivo toxicity is often a significant concern for the clinical application of anticancer medicine. To verify the applicability of Apt-Au@MSL in vivo, the mice were evaluated under different treatments (Morin, Morin–liposomes, Au-Apt, and Apt-Au@MSL). Blood biochemical assays were also conducted to examine possible changes in the biochemistry of mice after treatment. As shown in Fig. 11a, the blood glucose index for blood function of the Apt-Au@MSL groups was similar to those of the blank and control groups. No difference in body weight was found in each group. A steady increase was observed, indicating that the drug exhibited no toxicity (Fig. 11b). H&E staining of organ sections (Fig. 11c) showed no sign of damage or inflammation in the group treated with Apt-Au@MSL, compared with the blank and control group. This finding indicated that PBS, Morin, Morin–liposomes, Au-Apt, and Apt-Au@MSL were negligible side effects in vivo. These results, as well those of H&E staining, further indicate safety in the use of Apt-Au@MSL for tumor treatment.
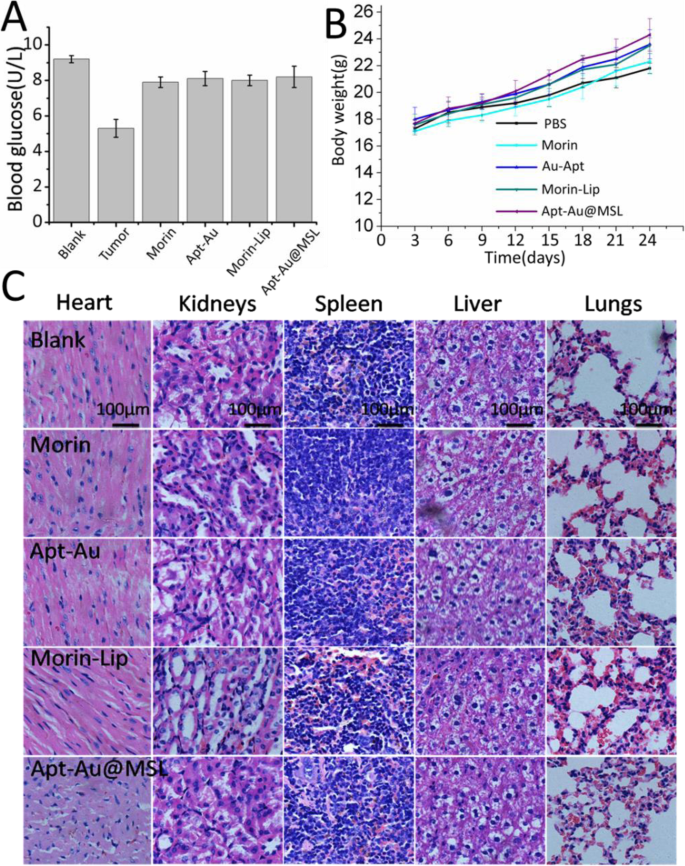
In vivo toxicity evaluation. un Blood glucose data detected in the mouse toxicity model. b Weight of mice in different groups after 24 days. c Images of H&E-stained major organs. Each value represents the mean ± SD (n =3)
Conclusions
In conclusion, this study presents the synthesis of an antitumor nanomaterial, Apt-Au@MSL. Apt-Au@MSL exhibited excellent monodispersity and tumor-targeting properties. The polarity of Morin was modified, and the antitumor activity was enhanced. The pH of the solution was 5.0, and the release rate of Morin from Apt-Au@MSL was the maximum in the characterization experiments. Apt-Au@MSL showed that the morphology of hybrid vesicles was attributable to Au-Apt modification. The diameter of 150 nm was consistent with the size determined by DLS. We screened our model cancer cell by MTT assay and found that SGC-7901 cells could effectively suppress proliferation. The IC50 of Apt-Au@MSL was 15.6 ± 1.5 μg/mL for the SGC-7901 cells. Fluorescent flow cytometric assays confirmed that Apt-Au@MSL could be used as an effective anticancer material and induced apoptosis in vitro. The Apt-Au@MSL found in the internal cell, as shown in the TEM images, suggested that Apt-Au@MSL could target the cancer cell. The administration of Apt-Au@MSL could inhibit tumor growth in xenograft mouse models, as determined from tumor weight testing. H&E staining and TUNEL assay further confirmed that Apt-Au@MSL could promote tumor apoptosis in vivo. Both blood biochemistry testing and H&E staining suggested that these materials exhibit negligible acute toxicity and good biocompatibility in vivo.
Disponibilidad de datos y materiales
The authors declare that the materials, data, and associated protocols are promptly available to the readers without undue qualifications in material transfer agreements. All data generated and analyzed during this study are included in this article.
Abreviaturas
- Apt:
-
Aptamers
- Apt-Au:
-
Aptamers and Au nanoparticle
- MSL:
-
Morin pH-sensitive liposome
- AuNPs:
-
Nanopartículas de oro
- ROS:
-
Especies reactivas de oxígeno
- Apt-Au@MSL:
-
Aptamers and Au nanoparticle-modified Morin pH-sensitive liposome
- PC:
-
L-α-Phosphatidylcholine
- Chol:
-
Cholesterol
- CHEMS:
-
Cholesteryl hemisuccinate
- PVP:
-
Polivinilpirrolidona
- PI:
-
Yoduro de propidio
- FT–IR:
-
Espectroscopía infrarroja por transformada de Fourier
- UV–Vis:
-
Ultraviolet–visible spectroscopy
- TEM:
-
Microscopía electrónica de transmisión
- SEM:
-
Microscopía electrónica de barrido
- DLS:
-
Dispersión de luz dinámica
- PDI:
-
Índice de polidispersidad
- ATCC:
-
American Type Culture Collection
- CLSM:
-
Microscopía de escaneo láser confocal
- TUNEL:
-
TdT-mediated dUTP Nick-End Labeling
- H&E staining:
-
Hematoxylin-eosin staining
- RTCA:
-
Real-time unlabeled cell analysis
Nanomateriales
- Los científicos de IBM son los primeros en hacer una demostración de los motores brownianos oscilantes para nanopartículas
- Nanopartículas de oro para sensores de quimioterapia
- Nanopartículas para la terapia del cáncer:avances y desafíos actuales
- Administración de medicamentos basados en células para aplicaciones de cáncer
- Nanopartículas cargadas de fármaco de donepezilo emulsionado 80 de polisorbato dirigido al cerebro para neuroprotección
- Nanofibras poliméricas electrohiladas decoradas con nanopartículas de metales nobles para detección química
- Nanopartículas de quitosano cargadas con genisteína y bioflavonoides dirigidas al receptor de folato para un efecto anticancerígeno mejorado en los cánceres de cuello uterino
- Método de postratamiento para la síntesis de nanopartículas de FePt-Fe3O4 binarias monodispersas
- Nanosensibilizador magnético modificado con aptámero para imágenes de resonancia magnética in vivo de cáncer que expresa HER2
- Entrega de ARNip catiónico basado en micelas para una terapia génica eficaz contra el cáncer de colon
- Nanopartículas de oro bioconjugadas compatibles con el medio ambiente como agentes de contraste eficaces para la obtención de imágenes de cáncer inducido por inflamación



