Nanocomposites a base de óxido de grafeno decorados con nanopartículas de plata como agente antibacteriano
Resumen
Uno de los métodos más prometedores contra las bacterias resistentes a los medicamentos pueden ser los materiales de superficie modificada con nanopartículas y nanocompuestos biocidas. A continuación, presentamos un nanocompuesto con nanopartículas de plata (Ag-NP) en la superficie de óxido de grafeno (GO) como un novedoso material multifuncional antibacteriano y antifúngico. Las tecnologías ultrasónicas se han utilizado como un método eficaz para recubrir láminas de poliuretano. Toxicidad en bacterias gramnegativas ( Escherichia coli ), bacterias grampositivas ( Staphylococcus aureus y Staphylococcus epidermidis ) y levadura patógena ( Candida albicans ) se evaluó mediante el análisis de la morfología celular, la evaluación de la viabilidad celular mediante el ensayo PrestoBlue, el análisis de la integridad de la membrana celular mediante el ensayo de lactato deshidrogenasa y la producción de especies reactivas de oxígeno. En comparación con los Ag-NP y GO, que se han utilizado ampliamente como agentes antibacterianos, nuestro nanocompuesto muestra una eficacia antimicrobiana mucho mayor frente a las bacterias y las células de levadura.
Antecedentes
El desarrollo de antibióticos ha jugado un papel importante en el control del número de infecciones bacterianas. Sin embargo, el uso inadecuado y excesivo de antibióticos ha llevado al desarrollo de multirresistencia en muchas especies bacterianas. Algunas cepas se han vuelto resistentes a prácticamente todos los agentes comúnmente disponibles:betalactámicos, tetraciclinas y aminoglucósidos [1]. Los principales patógenos resistentes son Staphylococcus aureus resistente a la meticilina. Enterococcus resistente a la vancomicina y Klebsiella pneumoniae productora de β-lactamasa de espectro extendido y Escherichia coli [2, 3]. Las bacterias, con sus poblaciones muy grandes y su tiempo de proliferación rápido, pueden desarrollar rápidamente mecanismos de resistencia a los antibióticos cuando un subconjunto de la población de bacterias sobrevive al tratamiento con antibióticos. Además, las bacterias resistentes a los antibióticos pueden transferir copias de ADN que codifican un mecanismo de resistencia a otras bacterias relacionadas lejanamente, que luego pueden transmitir los genes de resistencia a las generaciones posteriores. Por tanto, la aparición de bacterias resistentes a los antibióticos representa un problema grave que podría superarse mediante el desarrollo de nuevos agentes antimicrobianos. Los agentes antibacterianos son muy importantes en la industria textil, desinfección de agua, medicamentos y envasado de alimentos. Las nanopartículas y nanomateriales se pueden utilizar como alternativa a los antibióticos [4]. El mecanismo de actividad antibacteriana de las nanopartículas varía entre los diferentes tipos de nanopartículas. Si bien algunos mecanismos propuestos se relacionan con la estructura fisicoquímica de las nanopartículas, otros se relacionan con el aumento de la liberación de iones antibacterianos de las superficies de las nanopartículas. Múltiples mecanismos de acción simultáneos contra microbios requerirían una variedad de mutaciones de ADN sincrónicas en la misma célula microbiana para el desarrollo de resistencia; por lo tanto, es difícil que las células bacterianas se vuelvan resistentes a nanopartículas y nanomateriales. Los nanomateriales antimicrobianos, como la plata, el cobre, los fullerenos y los nanotubos de carbono de pared simple, pueden ofrecer varias ventajas debido a sus propiedades fisicoquímicas únicas y su gran superficie [5,6,7,8]. Los mecanismos exactos de la toxicidad de las nanopartículas (NP) contra varias bacterias no se comprenden completamente. Según la investigación actual, los principales procesos que subyacen a los efectos antibacterianos de las NP son la alteración de la membrana celular bacteriana, la liberación de iones metálicos, la generación de ROS, la penetración de la membrana celular bacteriana y la inducción de efectos antibacterianos intracelulares, incluidas las interacciones con el ADN y proteínas [9, 10]. Las NP pueden adherirse a la membrana de las bacterias mediante interacción electrostática y alterar la integridad de la membrana bacteriana. La carga positiva de la superficie de los NP es fundamental para la adhesión. La carga positiva permite la adición electrostática entre las NP y la membrana celular cargada negativamente de los microorganismos [11]. La conexión electrostática entre las NP con las proteínas que contienen azufre presentes en la superficie de las células bacterianas provoca cambios irreversibles en la estructura de la pared celular que provocan daños en la pared y la membrana celular [12]. La membrana bacteriana es crucial, independientemente del estado metabólico de la célula, ya que proporciona permeabilidad selectiva para la homeostasis celular y la transducción de energía metabólica. La segunda actividad antibacteriana y antifúngica de las NP se debe a su capacidad para producir ROS y especies de radicales libres [13]. Aumento del nivel de hiperoxidación inducida por ROS de lípidos, proteínas y ADN [14].
Además, las estructuras de muchos tipos de NP son adecuadas para transportar agentes antimicrobianos [15, 16]. Los portadores pueden ayudar a proteger los medicamentos de la resistencia de las bacterias objetivo. Un sistema de administración de fármacos basado en nanopartículas puede ayudar a dirigir los antibióticos a un sitio de infección y así minimizar los efectos secundarios sistémicos. Otras ventajas incluyen una mejor solubilidad de los fármacos hidrófobos, un tiempo de circulación sistémica prolongado y una vida media del fármaco y una liberación sostenida del fármaco [4].
Recientemente, se ha demostrado que el grafeno, un nuevo alótropo del carbono, tiene actividad antibacteriana. El grafeno es un material hecho de átomos de carbono que están unidos en un patrón repetido de hexágonos. Una característica única de las escamas de grafeno es la relación entre su espesor y la superficie. La superficie del grafeno está cubierta por una nube de electrones, lo que probablemente predispone a este material a ser un donante de electrones y le da la capacidad de formar enlaces especiales. Los bordes del grafeno tienen otros enlaces (característicos de los enlaces de tipo diamante sp3), y estos lugares pueden tener diferentes características fisicoquímicas [17]. Estas características sugieren que el grafeno puede estar expuesto a la adhesión plástica a diferentes estructuras intercelulares, incluidas las células bacterianas [18, 19, 20]. Además, debido a que tiene dos lados activos (superficie y bordes), el grafeno puede unir moléculas biológicas a sus bordes y adherirse a la superficie celular. Una forma oxidada de grafeno, el óxido de grafeno (GO), se dispersa fácilmente en agua y otros disolventes orgánicos debido a la presencia de funcionalidades de oxígeno. Los grupos oxigenados permiten la funcionalización química directa de las hojas de GO mediante interacciones covalentes y no covalentes. Se ha informado de la fuerte actividad antibacteriana de GO. La actividad antibacteriana de GO se ha asignado a la tensión de la membrana inducida por los bordes afilados de las nanohojas de óxido de grafeno, que pueden provocar daños físicos en las membranas celulares, lo que lleva a la pérdida de la integridad de la membrana bacteriana [21]. Recientemente, nanopartículas antimicrobianas funcionalizadas con grafeno se han utilizado como materiales antibacterianos prometedores [22, 23]. Los nanocomposites pueden superar las limitaciones de los componentes individuales. Por ejemplo, los nanomateriales antibacterianos adheridos al sustrato de grafeno son más estables y están bien dispersos [24]. Estos nanocompuestos podrían contener metales, óxidos metálicos y polímeros.
Uno de los métodos más prometedores contra las bacterias resistentes a los medicamentos pueden ser los materiales de superficie modificada con nanopartículas biocidas. Se ha confirmado que las tecnologías ultrasónicas son un método eficaz para recubrir diversos materiales con sustancias antibacterianas y fungicidas [25,26,27,28]. Muchos investigadores clasifican el método de ultrasonido como una “tecnología verde” [29, 30]. El método se basa en el uso de fenómenos de cavitación, que es la formación, crecimiento y colapso de burbujas de cavitación en el medio líquido [31, 32]. Las burbujas explosivas generan inmensas cantidades de energía en microrregiones de hasta 5000 K y presiones de hasta 2000 atm en un corto período de tiempo [33, 34]. En consecuencia, se generan ondas de choque y los denominados microchorros dirigidos hacia la superficie sólida [35]. Ubicados en un medio líquido, los NP son impulsados hacia arriba por el efecto de implosión y las corrientes en chorro a alta velocidad (> 100 m / s) sobre la superficie sólida forman una capa [36]. La cavitación acústica también puede provocar cambios en las propiedades físicas de los objetos sometidos a ultrasonidos, por ejemplo, el cambio de tamaño de las escamas GO [37, 38] .
Logramos resultados prometedores en nuestros estudios anteriores con Salmonella enterica y Listeria monocytogenes tratados con grafeno prístino, GO y GO reducido [20]. De los diferentes tipos de grafeno, también se encontró que el GO tiene la mayor actividad antibacteriana a baja concentración. Las células bacterianas se distribuyeron por toda la superficie del GO. En este estudio, planteamos la hipótesis de que el GO decorado con nanopartículas de plata (GO-Ag) tendrá una influencia tóxica más fuerte en las células microbianas que el GO desnudo o las nanopartículas de plata (Ag-NP). Debido a que tiene dos lados activos (superficie y bordes), el óxido GO puede unir Ag-NP a los bordes y adherirse a la superficie de la celda. La actividad antibacteriana de los nanocompuestos basados en grafeno puede deberse a la alteración de la membrana celular y al estrés oxidativo. El objetivo de este estudio fue evaluar la actividad antimicrobiana de nanocompuestos basados en GO decorados con Ag-NPs en comparación con GO desnudos y Ag-NPs utilizando bacterias gramnegativas ( Escherichia coli ), bacterias grampositivas ( Staphylococcus aureus y Staphylococcus epidermidis ) y levadura patógena ( Candida albicans ) utilizando un modelo in vitro. La investigación consistió en análisis estructural de nanocomposites mediante difracción de rayos X, transmisión de espectroscopía Raman, FT-IR, microscopía electrónica (TEM), microscopía electrónica de barrido (SEM) y microscopía de fuerza atómica (AFM), evaluación de la morfología celular microbiana, evaluación de viabilidad celular mediante el ensayo PrestoBlue ™, investigación de la integridad de la membrana celular mediante el ensayo de lactato deshidrogenasa (LDH) y evaluación de la producción de especies reactivas de oxígeno (ROS).
Métodos
Síntesis, modificación y caracterización del óxido de grafeno
En este estudio, un polvo de grafito disponible comercialmente (Acros Organics, Nueva Jersey, EE. UU.) Se oxidó mediante el método Hummers modificado [39]. Se mezclaron diez gramos de polvo de grafito con 230 ml de ácido sulfúrico concentrado (98%) por debajo de 10ºC. A continuación, se añadieron gradualmente 4,7 g de nitrato de sodio y 30 g de permanganato de potasio a la mezcla de ácido sulfúrico y grafito mientras se mantenía la temperatura por debajo de 10 ° C. Luego, la mezcla se calentó a 30ºC y se agitó durante 2 h. En el siguiente paso, se agregaron 100 ml de agua y la temperatura de la mezcla alcanzó ~ 100 ° C. Finalmente, la mezcla se trató con 10 mL de peróxido de hidrógeno. Para la purificación, la suspensión se filtró y se lavó con agua desionizada hasta que el pH del filtrado alcanzó 6,5.
Los patrones de difracción de rayos X de GO se recopilaron a temperatura ambiente dentro del rango de un ángulo de 2 theta de 10 ° a 100 ° con el paso de 0.02 ° utilizando el difractómetro de polvo de rayos X ( CuK α1 ) (X’Pert PRO, PANalytical, Almelo, Países Bajos).
El análisis del contenido de carbono, hidrógeno, nitrógeno y azufre en peso en GO se llevó a cabo utilizando el aparato Vario EL III producido por Elementar Analysensysteme GmbH (Langenselbold, Alemania). Antes de realizar mediciones de análisis químicos de GO, las muestras se sometieron a desorción de 24 h en una estación de desorción (VcPrep 061, Micromeritics, Norcross, GA, EE. UU.) Al vacío (0,05 mbar) a 50 ° C. El contenido de oxígeno se calculó restando el contenido determinado de carbono, hidrógeno, nitrógeno y azufre del 100% del peso.
La espectroscopía Raman se realizó utilizando un microscopio inVia Raman (Renishaw, Reino Unido). El óxido de grafeno se analizó con la longitud de onda del láser de 514 nm con el 5% de su potencia inicial. Los espectros se recogieron de cinco puntos diferentes de la muestra. El tiempo de exposición fue de 10 sy se recolectaron dos escaneos.
Las mediciones de FT-IR se realizaron utilizando un espectrómetro Nicolet iS10 (Thermo Fisher Scientific, EE. UU.) En modo de reflectancia total atenuada en un cristal de diamante. Se gotearon cinco microlitros de suspensión acuosa de óxido de grafeno sobre la superficie del cristal de diamante y se dejó secar. Después de que se secó, el espectro se recogió en el rango de 400 a 4000 cm −1 .
Las mediciones de tamaño de partícula promedio y potencial zeta se llevaron a cabo usando Zetasizer Nano-ZS ZEN 3600 producido por Malvern Instruments Ltd. (Malvern, Reino Unido) usando el modo de dispersión de luz dinámica (DLS) y electroforesis láser Doppler, respectivamente, a temperatura ambiente (23 ° C). C).
Análisis TEM / SEM / AFM de nanomateriales
La morfología de polvos y láminas se determinó utilizando el microscopio electrónico de transmisión (TEM; JEM-1220 JEOL, Tokio, Japón, voltaje de aceleración de 80 kV) y el microscopio electrónico de barrido (SEM; Zeiss, Ultra Plus, Oberkochen, Alemania). Las muestras para observaciones TEM se prepararon colocando gotas de hidrocoloides en rejillas TEM (Formvar en rejillas de malla Cu de 3 mm 200, Agar Scientific, Stansted, Reino Unido). Inmediatamente después de secar al aire las gotas, se insertaron las rejillas en el microscopio.
Para el análisis SEM, las muestras se recubrieron con una fina capa de carbón utilizando el recubridor por pulverización catódica (SCD 005 / CEA 035, BAL-TEC, Pfäffikon, Suiza). Se aplicó un procedimiento de medición de laboratorio interno (P5.10, edición 6 de 26.08.2015).
Las imágenes de microscopía de fuerza atómica (AFM) se llevaron a cabo utilizando el software Asylum Research MFP3D Bio (versión:Asylum Research MFP3D 15.106.09). La obtención de imágenes de topografía de superficie y la detección de GO en las superficies de la lámina probada se llevaron a cabo utilizando dos modos de imagen, el modo AC para imágenes de contraste de fase y la microscopía de fuerza lateral (LFM) para la detección de GO, ya que GO reduce las fuerzas de fricción [40] .
Preparación de láminas de poliuretano recubiertas con GO y Ag-NP
Para cubrir láminas de poliuretano se utilizaron suspensiones de Ag-NP (HydroSilver1000, Amepox, Łódź, Polonia) y GO. Las suspensiones de GO, Ag-NPs y GO-Ag (GO (200 μg / mL), Ag-NPs (100 μg / mL), GO (200 μg / mL) + Ag-NPs (100 μg / mL)) fueron preparado en agua desionizada (conductancia 0.09 μS / cm, desionizador:HLP 20UV, Hydrolab, Staszyn, Polonia). Las suspensiones se utilizaron sin purificación ni filtración adicionales.
El revestimiento ultrasónico de láminas de poliuretano (15 x 15 x 0,05 mm) tuvo lugar en un matraz de vidrio con un volumen de 50 ml. Las muestras de láminas se sujetaron en un soporte (teflón) y posteriormente se sumergieron en las suspensiones preparadas. El proceso de recubrimiento se realizó utilizando una bocina ultrasónica (bocina de Ti, Ø13 mm, 60% de eficiencia, 20 kHz, Sonics &Materials, Inc., Newtown, CT, EE. UU.) Colocada en escuadra con las muestras de lámina presentes en la suspensión. La temperatura del proceso fue de 30 ± 1 ° C. Las muestras cubiertas se lavaron con agua desionizada y se secaron en una cámara laminar y posteriormente se empacaron en paquetes estériles.
Energía libre de superficie
Las pruebas de humectabilidad se llevaron a cabo utilizando el goniómetro Data Physics OCA - 20 (DataPhysics Instruments GmbH, Filderstadt, Alemania). La energía libre de superficie (SFE) se calculó utilizando el método de Owens, Wendt, Rabel y Kaelble (OWRK) utilizando dos líquidos de prueba:agua desionizada y diyodometano [41].
Preparación y cultivo de bacterias y levaduras
Staphylococcus aureus (ATCC 25923) y Staphylococcus epidermidis (ATCC 14990), Escherichia coli (ATCC 25922) y Candida albicans (90028) se obtuvieron de LGC Standards (Lomianki, Polonia). Las cepas se almacenaron como suspensiones de esporas en un 20% ( v / v ) glicerol a -20 ° C. Antes de su uso en experimentos, las cepas se descongelaron y el glicerol se eliminó lavando las células bacterianas con agua destilada. A continuación, las bacterias y la levadura se cultivaron en los siguientes medios nutritivos:agar tríptico de soja para S . aureus y E . coli , agar cerebro-corazón para S . epidermidis y agar de Sabouraud para C . albicans (Merck Millipore, Darmstadt, Alemania). Las bacterias y levaduras cultivadas en placas de agar se recolectaron lavando suavemente las placas con solución salina destilada estéril. Para calcular el número de bacterias en la suspensión celular, la densidad óptica de las suspensiones a 600 nm (DO 600 ) se midió con un espectrofotómetro (Helios Epsilon, Unicam, Milwaukee, WI, EE. UU.). Se prepararon curvas de calibración para cada uno de los microorganismos realizando diluciones en serie diez veces (hasta 10 - 5 ) de suspensiones bacterianas y de levadura de densidad óptica conocida. Se esparció un mililitro de cada dilución en placas de Petri que contenían el medio nutritivo. Después de 24 h de incubación a 37 ° C, se enumeró el número de colonias formadas en las placas de Petri. Con base en los resultados de las enumeraciones (realizadas por triplicado), se calculó la densidad de la suspensión bacteriana original en unidades formadoras de colonias (UFC) / ml.
Ensayo antimicrobiano
El inóculo para el ensayo antibacteriano se preparó a partir de organismos en crecimiento activo (fase logarítmica). Los inóculos de todos los microorganismos se prepararon a partir de un cultivo durante la noche desarrollado aeróbicamente en caldo Mueller-Hinton (MH) a 37 ° C. La concentración de bacterias y levaduras se determinó midiendo la densidad óptica a 600 nm (DO 600 ). Brevemente, se prepararon suspensiones de bacterias y levaduras a partir de cultivos durante la noche y se ajustaron a 10 6 UFC / ml. El inóculo se inoculó uniformemente sobre la superficie del agar MH en placas de Petri mediante frotamiento. Se depositaron láminas estériles recubiertas con GO, Ag-NP y GO-Ag sobre la superficie del agar. Se utilizaron láminas sin nanopartículas como grupo de control. Se midió el crecimiento de bacterias y levaduras debajo de las láminas después de 24 h de incubación a 37 ° C.
Ensayo de viabilidad
La viabilidad celular se evaluó usando el ensayo de viabilidad celular PrestoBlue ™ (Life Technologies, Taastrup, Dinamarca). El reactivo PrestoBlue ™ se reduce rápidamente por las células metabólicamente activas, proporcionando una medida cuantitativa de viabilidad y citotoxicidad. Se cultivaron células bacterianas y de levadura en láminas recubiertas con GO, Ag-NP y GO-Ag ubicadas en insertos insertados en placas de 6 pocillos (200 μL de caldo MH con 5 × 10 3 células por hoja) y se incubó durante 24 h. En el siguiente paso, se transfirieron 90 μL de cada muestra a placas de 96 pocillos y se agregaron 10 μL de reactivo PrestoBlue ™ a cada pozo y se incubaron durante 2 h más a 37 ° C. La densidad óptica de cada pocillo se registró a 570 nm en un lector de ensayo inmunoabsorbente ligado a enzima (ELISA) (Infinite M200, Tecan, Durham, NC, EE. UU.). La viabilidad celular se expresó como porcentaje (DO test - OD en blanco ) / (OD control - OD en blanco ) × 100%, donde OD prueba es la densidad óptica de las células expuestas a láminas probadas, OD control es la densidad óptica de la muestra de control y la DO blanco es la densidad óptica de los pocillos sin células bacterianas ni de levadura.
Integridad de la membrana
Se utilizó una prueba de LDH (kit de ensayo de toxicología in vitro, basado en deshidrogenasa láctica, Sigma-Aldrich, Hamburgo, Alemania) para evaluar la integridad de la membrana celular. El NAD reducido resultante (NADH + ) se utilizó en la conversión estequiométrica de un tinte de tetrazolio. Cuando se ensayaron alícuotas libres de células del medio de cultivos, la cantidad de actividad LDH podría usarse como un indicador de la integridad de la membrana. Si la membrana estaba dañada, se liberaban moléculas de LDH intracelulares en el medio de cultivo. Se cultivaron células bacterianas y de levadura en láminas (GO, Ag-NP y GO-Ag) ubicadas en insertos insertados en placas de 6 pocillos (200 μL de caldo MH con 5 × 10 3 células por hoja) y se incubó durante 24 h. Como control se utilizaron células cultivadas sobre papel de aluminio sin nanopartículas. Pasado este tiempo, las muestras se transfirieron a tubos de microcentrífuga y se centrifugaron a 1200 rpm durante 5 min. Se transfirieron cien microlitros de sobrenadante a placas de 96 pocillos y se añadieron 100 µl de la mezcla de ensayo de LDH a cada pocillo. La placa se cubrió y se incubó durante 30 min a temperatura ambiente. La densidad óptica de cada pocillo se registró a 450 nm en un lector ELISA (Infinite M200, Tecan, Männedorf, Suiza). La fuga de LDH se expresó como el porcentaje {(OD test - OD en blanco ) - (OD control - OD en blanco ) / (OD control - OD en blanco )} × 100%, donde OD prueba es la densidad óptica de las células expuestas a láminas probadas, OD control es la densidad óptica de la muestra de control y la DO blanco es la densidad óptica de los pocillos sin células.
Análisis SEM de microorganismos
Antes del análisis SEM, se prepararon muestras de bacterias y levaduras incubadas en láminas con GO-Ag y bacterias no tratadas. Brevemente, una gota de cultivo bacteriano y de levadura (10 6 CFU / ml) se incubó en láminas con nanocompuesto GO-Ag, o se depositaron bacterias no tratadas en la superficie de un cubreobjetos estéril y se incubaron durante 24 ha 37 ° C dentro de una placa de Petri vacía. Todas las muestras se secaron y cubrieron con oro. Finalmente, se tomaron imágenes de las muestras con SEM (FEI Quanta 200, Tokio, Japón) a un voltaje de aceleración de 15 kV.
Producción de ROS
La producción de ROS se evaluó utilizando DCFDA, Cellular Reactive Oxygen Species Detection Assay Kit (Abcam, Cambridge, Reino Unido). DCFDA utiliza el reactivo permeante celular diacetato de 2 ', 7'-diclorofluoresceína, un colorante fluorogénico que mide el hidroxilo, peroxilo y otras actividades de ROS dentro de la célula. Después de la difusión en la célula, el DCFDA es desacetilado por las esterasas celulares a un compuesto no fluorescente, que luego es oxidado por ROS en 2 ′, 7′-diclorofluoresceína (DCF). Se cultivaron células bacterianas y de levadura en láminas (GO, Ag-NP y GO-Ag) ubicadas en insertos insertados en placas de 6 pocillos (200 μL de caldo MH con 5 × 10 3 células por hoja) y se incubó durante 24 h. Como control se utilizaron células cultivadas sobre papel de aluminio sin nanopartículas. Pasado este tiempo, las muestras se transfirieron a tubos de microcentrífuga y se centrifugaron a 1200 rpm durante 5 min. Se transfirieron cien microlitros de sobrenadante a placas de 96 pocillos y se agregaron 100 µl de DCFDA diluido a cada pocillo y se incubaron durante 45 min más a 37 ° C en la oscuridad. La producción de DCF se midió mediante espectroscopia de fluorescencia con una longitud de onda de excitación a 485 nm y una longitud de onda de emisión a 535 nm en un lector ELISA (Infinite M200, Tecan, Durham, NC, EE. UU.).
Resultados
Características de GO y Ag-NPs
El análisis químico reveló la presencia de nitrógeno, carbono, azufre, hidrógeno y oxígeno (Tabla 1).
El análisis de fase de la muestra de GO (Fig. 1) reveló la presencia de impurezas provenientes de trazas de grafito, nitrato de sodio y probablemente una forma reducida de óxido de grafeno.
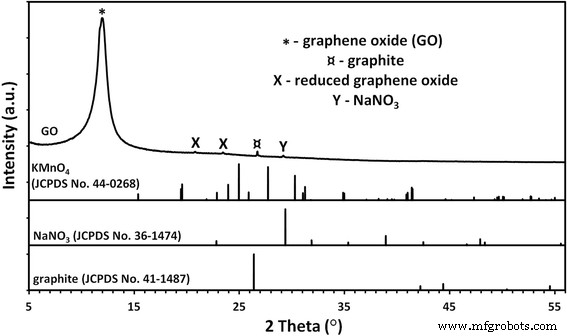
Patrones de difracción de rayos X de polvos GO. El análisis de fase de la muestra de GO reveló la presencia de impurezas provenientes de trazas de grafito, nitrato de sodio y probablemente una forma reducida de óxido de grafeno
La espectroscopia Raman puede proporcionar información sobre las características estructurales del óxido de grafeno. La banda D se atribuye al desorden estructural, mientras que la banda G proviene del estiramiento del enlace del carbono sp 2 átomos [42]. Las bandas adicionales (incluidas D ', 2D y D + G) surgen de los defectos presentes en la estructura grafítica del material de carbono. yo D / Yo G La relación (calculada a partir de la intensidad de las bandas D y G) se puede utilizar para caracterizar el desorden de la estructura grafítica en los materiales de carbono. Como puede verse en la Fig. 2, GO tiene una estructura muy desordenada debido a muchos grupos funcionales en la estructura formados durante la oxidación del polvo de grafito. La posición de la banda D es 1351 cm −1 y la banda G 1590 cm −1 ; el yo D / Yo G la proporción es 1,15.
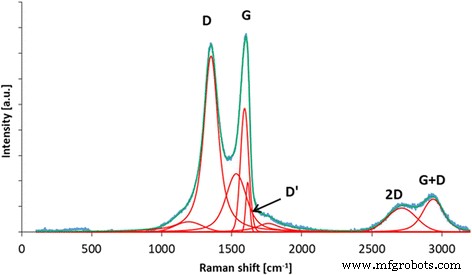
Espectro Raman de óxido de grafeno con deconvolución propuesta de las bandas D, G, D ', 2D y D + G. GO tiene una estructura muy desordenada debido a muchos grupos funcionales en la estructura formada durante la oxidación del polvo de grafito. La posición de la banda D es 1351 cm −1 y la banda G 1590 cm −1 ; el yo D / Yo G la proporción es 1,15
El espectro FT-IR del óxido de grafeno recogido en el modo ATR reveló que GO tiene muchos grupos funcionales presentes en la estructura. El pico más notable se puede observar a ~ 3500 cm −1 , que se asigna principalmente al agua y a los grupos hidroxilo (Fig. 3). Un pico muy intenso alrededor de 1080 cm −1 también se puede atribuir a grupos hidroxilo. El pico alrededor de 1600 cm −1 generalmente se asigna a enlaces C =C presentes en el carbono grafítico. Sin embargo, nuestros estudios anteriores de XPS muestran que hay algunos enlaces C =C en el óxido de grafeno [43]; por lo tanto, atribuimos este pico a la mayor parte del agua todavía presente en el óxido de grafeno. Otros picos observados en el espectro FT-IR muestran que GO es rico en grupos que contienen enlaces C =O (principalmente grupos carboxilo), pico alrededor de 1720 cm −1 , epoxi (C – O – C) con el pico visible alrededor de 1200 cm −1 y enlaces C – H (pico alrededor de 2800 cm −1 ). El análisis FT-IR está de acuerdo con las mediciones de XPS realizadas para el óxido de grafeno, donde también se identificaron grupos hidroxilo, carboxilo, epoxi y carbonilo [44]. Se compararon GO y GO después de una homogeneización ultrasónica de 10 minutos (Figs. 4 y 5), y de manera similar, se compararon Ag-NPs con Ag-NPs después de una homogeneización ultrasónica de 10 min (Figs. 4 y 6). Para evitar cambios en la morfología de los compuestos, todos los compuestos se enfriaron rápidamente con nitrógeno líquido y se secaron en un liofilizador. La Figura 5a, b presenta las escamas GO, mientras que la Fig. 5c, d muestra los efectos de los ultrasonidos sobre las escamas GO, que experimentan plegamiento y fragmentación parciales. La Figura 6 también muestra un efecto similar para Ag-NP, donde es visible un cambio en la morfología del material. La Figura 6a, b muestra poli (alcohol vinílico) seco, que se utilizó para estabilizar la suspensión acuosa de Ag-NP. El efecto destructivo de la homogeneización ultrasónica fue notable ya que la estructura del alcohol polivinílico se descompuso en partes largas y heterogéneas con pequeñas aberturas esféricas (Fig. 6c, d).
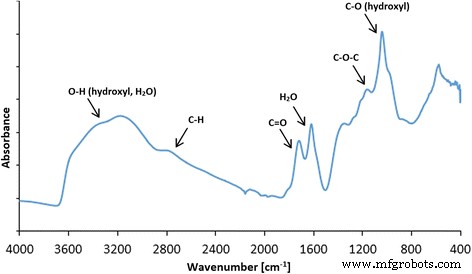
Espectro FT-IR (ATR, reflectancia total atenuada) de óxido de grafeno con asignación propuesta de grupos funcionales presentes en GO. Los picos más notables se observaron a ~ 3500 cm −1 , (atribuido al agua y a los grupos hidroxilo), ~ 1080 cm −1 (grupos hidroxilo), ~ 1600 cm −1 (asignado a los enlaces C =C presentes en el carbono grafítico). Otros picos observados en el espectro FT-IR muestran que GO es rico en grupos que contienen C =O (principalmente grupos carboxilo), pico alrededor de 1720 cm −1 , epoxi (C – O – C) con el pico visible alrededor de 1200 cm −1 y enlaces C – H (pico alrededor de 2800 cm −1 )
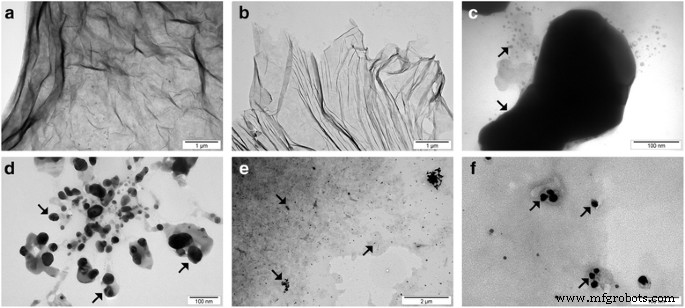
Imágenes TEM de escamas GO aglomeradas ( a ), GO escamas después del tratamiento ultrasónico ( b ), Ag-NP aglomerados ( c ), Ag-NP después del tratamiento ultrasónico ( d ) y GO-Ag ( e , f ). La disminución del tamaño de partícula promedio de GO después del tratamiento ultrasónico fue causada por la desfragmentación o el plegado de las escamas de GO. La disminución del tamaño medio de Ag después del tratamiento ultrasónico fue causada por la desfragmentación de los aglomerados de Ag. Nota:las flechas apuntan a Ag-NP / aglomerados

Comparación de la morfología de las escamas de GO liofilizadas ( a , b ) y escamas GO después del tratamiento ultrasónico ( c , d ) utilizando microscopía electrónica de barrido. La disminución del tamaño de partícula promedio de GO después del tratamiento ultrasónico fue causada por la desfragmentación o el plegado de las escamas de GO

Comparación de la morfología de la mezcla de Ag-NP liofilizada ( a , b ) y mezcla de Ag-NP después del tratamiento ultrasónico ( c , d ) utilizando microscopía electrónica de barrido
Tamaño promedio y potencial Zeta
Los resultados del tamaño medio de partícula / aglomerado en suspensiones de agua se presentan en la Tabla 2. Se llevaron a cabo análisis del tamaño medio para suspensiones concentradas que no se sometieron a homogeneización ultrasónica (como se recibieron) y para suspensiones diluidas. Las suspensiones diluidas antes del ensayo se sometieron a homogeneización ultrasónica, con parámetros de homogeneización idénticos a los utilizados durante el recubrimiento ultrasónico de la lámina con capas de nanomateriales (Ag-NPs, GO). Para la suspensión de Ag-NP, la acción de los ultrasonidos provocó un aumento del tamaño medio de partícula de 80 a 218 nm. La principal causa del aumento en el tamaño de partícula promedio después de la homogeneización ultrasónica en la suspensión (además del proceso de aglomeración de Ag-NP) fue que las Ag-NP se introdujeron en el poli (alcohol vinílico) que se usó para la estabilización de la suspensión. The large standard deviation of the Ag-NP sample homogenized by ultrasound resulted from the presence of both loose Ag-NPs and Ag-NPs driven into the poly(vinyl alcohol) in the suspension. In the case of GO suspension, the average particle size of the sample subject to ultrasonic homogenization was 263 nm and was ca 7.7 times smaller than the average particle size of the sample that was not subject to homogenization. The obtained results are convergent with the SEM tests (Fig. 5), which show the destructive effect of ultrasounds on GO flakes. The decrease of the average GO particle size was caused by defragmentation or folding of the GO flakes. However, it should be emphasized that the results of the average particle size of GO suspension samples involve an error related to the nanomaterial shape. The results obtained by the DLS method are a hydrodynamic average that is calculated based on the shape of a sphere that has the same diffusion coefficient as the measured particles; however, the shape of GO was flakes, which was confirmed by SEM images.
Test results of the zeta potential analysis of samples are provided in Table 3. The zeta potential of Ag-NPs in a water suspension was merely − 5.9 mV, which resulted in a lack of electrostatic stability of the sample. The sample of Ag-NP suspension was stabilized sterically by preserving Ag-NP distances through poly(vinyl alcohol) addition, which prevented agglomeration/aggregation of Ag-NPs. The zeta potential of the GO suspension sample, in turn, was − 41 mV, which gave a moderate electrostatic stability to the sample. A moderate electrostatic stability of a sample is characterized by slow sedimentation with virtually negligible change of particle size in the period of declared fitness of the suspension. The zeta potential result of the mixture of Ag-NPs and GO was − 7.1 mV, which potentially means that during the action of the ultrasounds, the GO flakes were coated by poly(vinyl alcohol) and Ag-NPs. The obtained zeta potential result of the mixture of Ag-NPs and GO sample in the water suspension implied that electrostatic stability was not present.
Foil Characteristics
In order to determine the morphology of the created layers, four types of foil samples were compared (Fig. 7):pure polyurethane foil (A, B), GO-coated polyurethane foil (C, D), Ag-NP-coated polyurethane foil (E, F), and GO-Ag mixture-coated polyurethane foil (G, H).

Scanning electron microscopy images of a , b non-coated polyurethane foil with a smooth surface with single impurities; c , d foil coated with GO, the broken-down GO flakes deposited on the polyurethane foil surface; e , f foil coated with Ag-NPs on which grid structures composed of polyvinyl alcohol and Ag-NPs are observed; and g , h foil coated with GO-Ag, which was mixed under the influence of ultrasounds and deposited on the foil surface
Figure 7a, b shows an uncoated polyurethane foil with a smooth surface with single impurities. In Fig. 4c, d, the broken-down GO flakes deposited on the polyurethane foil surface are noticeable. Figure 7e, f shows the foil surface coated with Ag-NPs on which grid structures composed of polyvinyl alcohol and Ag-NPs are observable. Figure 7g, h presents a mixture of GO-Ag composition, which was mixed under the influence of ultrasounds and deposited on the foil surface.
AFM Analysis and Surface Free Energy
AFM and LFM were used to complement the information about the surface morphology investigated by SEM. The investigation confirmed evolution of surface morphology by sonication of the polyvinyl alcohol with Ag-NP, GO, and GO-Ag NP solutions on the foils. Pure polyurethane foil was used as a reference foil in relation to foils coated by the ultrasonic method. The images in Fig. 8 are the AFM phase contrast images made in AC; additionally, cross sections of the GO flakes are attached under the corresponding images. Figure 8a is an image of pure polyurethane film; Fig. 7b depicts the Ag-NP-coated film, where characteristic and homogeneous grid structures are observable, being similar to those in Fig. 8e, f. Figure 8c, d shows GO-Ag-NP-coated film. Figure 8e shows the surface of the foil almost entirely covered with GO flakes; the phase contrast image helps to observe these two phases, the darker area is GO and the lighter area is polymer foil. It was noticed that the morphology of the foils has changed after Ag-NP coating comparing to the not-coated foils. The GO-Ag-NP coating differs from the previous one because it contains also small amounts of GO flakes seen as small black spots on the image, as it was mentioned earlier. Figure 8f depicts magnification of one GO flake made in LFM. The reduced friction confirms that it is, in fact, a GO flake.
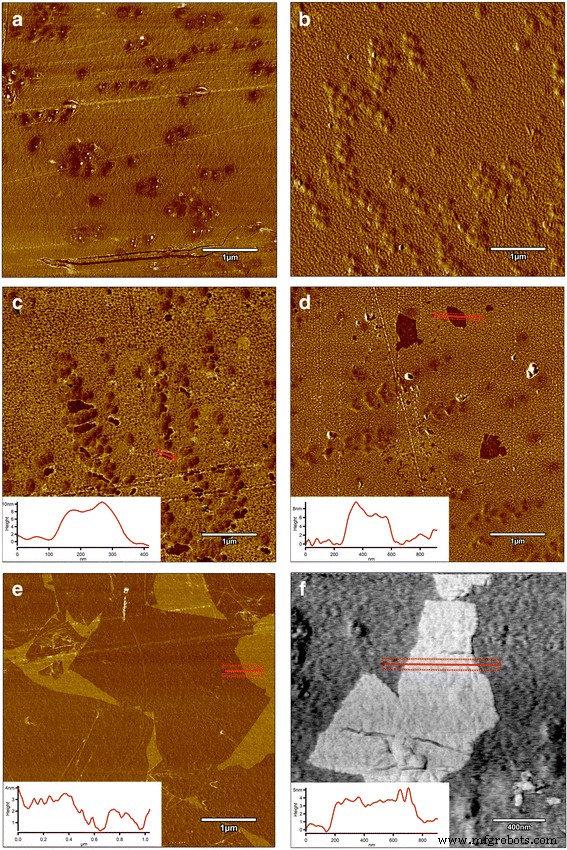
AFM phase contrast images and cross sections topographic images of graphene flakes:a non-coated foil polyurethane foil; b Ag-NPs coated foil where characteristic and homogeneous grid structures are observed; c , d GO-Ag-coated foil; e GO-coated foil, the surface of the foil almost entirely covered with GO flakes; the phase contrast image helps to observe these two phases, the darker area is GO and the lighter area is polymer foil; f LFM image of graphene flake. Red marks, area of cross section
The polar component for the GO-coated foil increased in relation to pure foil, from 2.3 ± 0.6 to 68.9 ± 2.8 mJ/m 2 , while the dispersion component decreased from 34.4 ± 1.3 to 8.2 ± 1.2 mJ/m 2 . SFE increased from 36.7 ± 1.4 to 77.0 ± 3.4 mJ/m 2 . A similar effect was not observed on foil surfaces coated with Ag-NPs and GO-Ag mixture. SFE of foil samples coated with Ag-NPs and GO-Ag mixture does not differ statistically (Table 4).
Antibacterial Properties
The antibacterial activity of the different foils coated with GO, Ag-NPs, and GO-Ag were tested with E . coli , S . aureus , S . epidermidis y C . albicans. Results showed that after co-incubation with bacteria at 37 °C for 24 h, foils inhibited the growth of all tested microorganisms but to various degrees. The maximum antibacterial effect against all tested microorganisms was with foil coated with the GO-Ag nanocomposite. The bacterial growth of the cells treated with foils coated with GO and Ag-NPs was slightly lower than that of cells in the control group whereas the growth of bacterial cells treated with foils coated with GO-Ag was greatly inhibited, 88.6% of E . coli , 79.6% of S . aureus , 76.5% of S . epidermidis , and 77.5% of C . albicans (Figs. 9, 10, and 11).
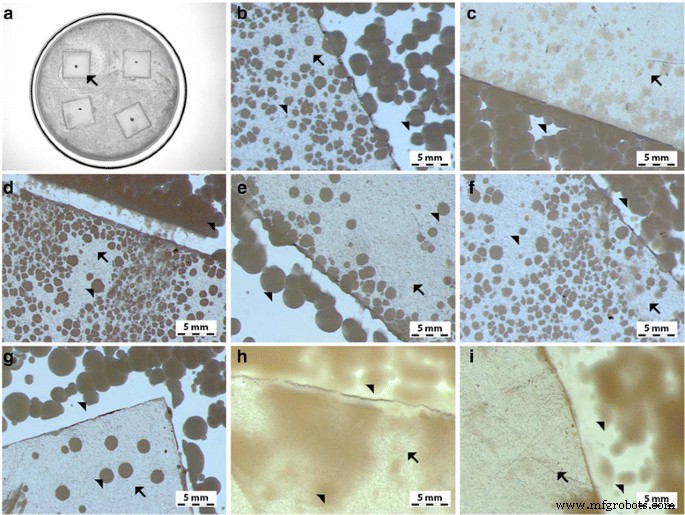
Antimicrobial properties of GO-Ag coated foils. The growth of E . coli ( b , c ), S . aureus (c , d ), S . epidermidis ( e , f ), and C . albicans (g - yo ) colonies is reduced after co-incubation with GO-Ag-coated foils at 37 °C for 24 h. un Representative agar plate with GO-Ag-coated foils. Notes:Black arrows point to GO-Ag coated foils; arrowheads point to colonies of microorganisms

Morphology of microorganisms after co-incubation with GO-Ag-coated foils. Scanning electron microscopy images of bacteria and yeast in the control foils (a , c , e , g ) and foils coated with GO-Ag (b , d , f , h ) after incubation at 37 °C for 24 h. E . coli ( a , b ), S . aureus (c , d ), S . epidermidis ( e , f ), and C . albicans (g , h ) show decreased growth and deformed morphology after co-incubation with GO-Ag-coated foils
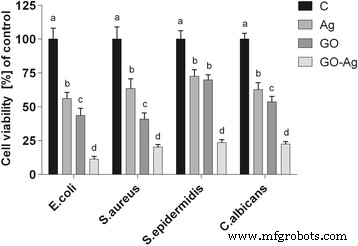
Foils coated with nanomaterials decrease E . coli , S . aureus , S . epidermidis y C . albicans viability. Viability of bacteria and yeast after incubation on foils coated with Ag-NPs, GO, and GO-Ag at 37 °C for 24 h was assessed with Presto Blue assay. C control group (foil without nanoparticles), Ag foil coated with silver nanoparticles, GO foil coated with graphene oxide, GO-Ag foil coated with composite of graphene oxide and silver nanoparticles. Note:The columns with different letters (a–d) indicate significant differences between the concentrations (P = 0.001); error bars are standard deviations
Membrane Integrity
In cases where the cell membrane is damaged, intracellular LDH molecules could be released into the culture medium. The LDH level outside the cells demonstrates the cell membrane integrity. Foils coated with GO, Ag-NPs, and GO-Ag disrupted cell membrane functionality and integrity with significant differences between control groups and the Ag-NPs and GO-Ag groups (Fig. 12). The highest disruption of cell membranes was observed in the GO-Ag groups, 66.3% of E . coli , 59.4% of S . aureus , 54.8% of S . epidermidis , and 48.5% of C . albicans .
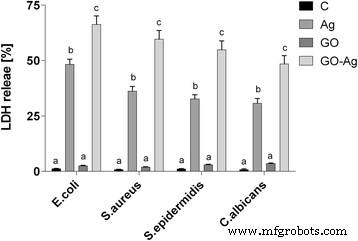
Foils coated with nanomaterials decreased E . coli , S . aureus , S . epidermidis y C . albicans membrane integrity. Membrane integrity of bacteria and yeast after incubation on foils coated with Ag-NPs, GO, and GO-Ag at 37 °C for 24 h was assessed with LDH assay. C control group (foil without nanoparticles), Ag foil coated with silver nanoparticles, GO foil coated with graphene oxide, GO-Ag foil coated with composite of graphene oxide and silver nanoparticles. Note:The columns with different letters (a–c) indicate significant differences between the concentrations (P = 0.000); error bars are standard deviations
ROS Production
Low levels (or optimum levels) of ROS play an important role in signaling pathways. However, when ROS production increases and overwhelms the cellular antioxidant capacity, it can induce macromolecular damage (by reacting with DNA, proteins, and lipids) and disrupt thiol redox circuits. Foils coated with Ag-NPs and GO-Ag (P < 0.05) increased the ROS production of all tested microorganisms compared to the control group. Foils coated with GO only increased the ROS production of C . albicans . The highest ROS production was observed in the GO-Ag group (Fig. 13).
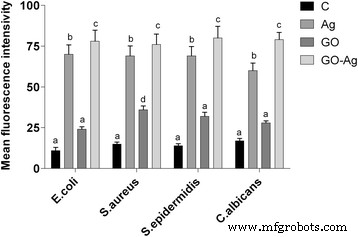
Effect of foils coated with nanomaterials on the production of reactive oxygen species. E . coli , S . aureus , S . epidermidis y C . albicans were cultured on foils coated with Ag-NPs, GO, and GO-Ag at 37 °C for 24 h. Production of reactive oxygen species was assessed with DCFDA, Cellular Reactive Oxygen Species Detection Assay Kit. C control group (foil without nanoparticles), Ag foil coated with silver nanoparticles, GO foil coated with graphene oxide, GO-Ag foil coated with composite of graphene oxide and silver nanoparticles. Note:The columns with different letters (a–d) indicate significant differences between the concentrations (P = 0.000); error bars are standard deviations
Discusión
The discovery of antibiotics, natural products produced by microorganisms that are able to prevent the growth of bacteria and thus cure infectious diseases, revolutionized medical therapy; however, the overuse and misuse of antibiotics have been key factors contributing to antibiotic resistance. Now, the era of antibiotics is coming to an end, and new antibacterial agents are needed. In recent years, studies have reported nanoparticles as a promising alternative to antibacterial reagents because of their antibacterial activity in several biomedical applications [19, 45]. Nanoparticles can be an effective way to control many pathogenic and antibiotic-resistant microorganisms. Among many metal nanoparticles, Ag-NPs have been intensely studied because of the distinct properties of their antibacterial activity [7]. Ag-NPs have been proved effective against over 650 microorganisms including bacteria (both gram-positive and negative), fungi, and viruses; however, the precise mechanism of antimicrobial action is not understood completely [46]. Ag-NP exposure to microorganisms could cause adhesion of nanoparticles to the peptidoglycan and the cell membrane [47], penetration inside the cell [48], induction of ROS [49], and damaging of intracellular structures [50]. However, bare Ag-NPs aggregate when they come into contact with bacteria; thus, they lose their active surface area and show weaker antibacterial activity [51]. To overcome this problem, nanocomposites composed of graphenic materials and Ag-NPs or other metal nanoparticles could be fabricated. GO with oxygen-containing functional groups is water soluble and therefore more biocompatible than pristine graphene. As a result, Ag-based GO nanocomposites may be used as antibacterial agents. However, the information about antimicrobial properties of graphene-based composites is limited, and mechanisms of toxicity or lack of toxicity are not fully explained.
The aim of this work was to study the action of graphene oxide-based nanocomposites decorated with Ag nanoparticles on S . aureus , S . epidermidis , E . coli y C . albicans growth; membrane integrity; and ROS production. After co-incubation with the bacterial and yeast cells for 24 h, foils coated with GO-Ag nanocomposite inhibited the growth of all tested microorganisms with varying degrees, 88.6% of E . coli , 79.6% of S . aureus , 76.5% of S . epidermidis , and 77.5% of C . albicans . This action is most probably due to an increase in cell membrane and wall penetration by the nanoparticles. Some researchers suggest that the antimicrobial activity of graphene-based nanocomposites may be due to the disruption of cell membrane integrity and oxidative stress [52].
Foils coated with GO, Ag-NPs, and GO-Ag disrupted cell membrane functionality and integrity with significant differences between the control group and the Ag-NPs and GO-Ag groups. The highest disruption of cell membranes was observed in the GO-Ag groups, 66.3% of E . coli , 59.4% of S . aureus , 54.8% of S . epidermidis , and 48.5% of C . albicans . However, foils coated with bare Ag-NPs also disrupted cell membranes. It has been proposed that Ag-NPs are able to interact with bacterial membranes by increasing permeability and changing the structure of membranes, which finally leads to cell death [50]. Ag-NPs can cause direct damage to the bacterial cell membrane. Bacteria may be killed by the combined bactericidal effects of the released Ag + ions and Ag nanoparticles. Additionally, the antimicrobial potential of Ag-NPs is also influenced by the thickness of the cell wall of the microorganisms [53]. The wall of gram-positive cells contains a thick layer (20–80 nm) of peptidoglycan, which is attached to teichoic acids. In gram-negative bacteria, the cell wall comprises a thin (7–8 nm) peptidoglycan layer and contains an outer membrane. The thicker peptidoglycan layer in gram-positive bacteria, such as S . aureus and S . epidermidis , may explain why these bacteria are more resistant to the antibacterial effects of GO-Ag.
Many studies have sought to establish a mechanism of action of antibacterial activity exhibited by silver in both its colloidal and ionic form. A disruption of membrane functionality from an interaction between released Ag + ions and the cell membrane and extensive cell membrane damage caused by the formation of ROS ultimately causes damage to the cell due to oxidative stress. Additionally, Ag + ions could cause dysfunction of the respiratory electron transport chain by uncoupling it from oxidative phosphorylation by inhibiting respiratory chain enzymes [54]. Foils coated with Ag-NPs and GO-Ag increased the ROS production of all tested microorganisms compared to the control group. The biological targets are DNA, RNA, proteins, and lipids. Lipids are one major target during oxidative stress. Free radicals can directly attack polyunsaturated fatty acids in bacterial and yeast membranes and activate peroxidation of lipids. A fundamental effect of lipid peroxidation is a decrease in membrane fluidity, which can significantly disrupt membrane-bound proteins. DNA is also a main target. Mechanisms of DNA damage involve abstractions and addition reactions by free radicals leading to carbon-centered sugar radicals and OH- or H-adduct radicals of heterocyclic bases. The sugar moieties producing single- and double-strand breaks in the backbone, adducts of base and sugar groups, and cross-links to other molecules can block replication. Foils coated with GO increased the ROS production at very low levels. However, Hu et al. [55] demonstrated that GO had a detrimental effect on E . coli due to decreased production of ATP and increased ROS production. Zhao et al. [56] reported the antibacterial activity of GO and reduced GO. Also, Gurunathan et al. [57] presented that GO and reduced GO showed significant antibacterial activity in a concentration- and time-dependent manner. Their results demonstrated that oxidative stress is a key mechanism for the antibacterial activity of GO and reduced GO through ROS generation. Nanda et al. [53] reported the effect of cystamine-conjugated GO against E . coli , S . typhimurium , E . faecalis , and B . subtilis with ROS production and high antibacterial activity.
Kurantowicz et al. [20] confirmed that bacteria could adhere to the GO surface, which results in the highest antibacterial activity. GO is characterized by a high degree of oxygenated functional groups:carbonyl, carboxylate, and hydroxyl. We hypothesize that these groups can be attractive groups for bacterial and yeast attachment. These groups are present on a large range of nutrients (amino acids, fatty acids) which are commonly recognized by microorganisms. In the present study, foils coated with GO induced membrane disruption and ROS production at a lower level than the Ag-NP and Ag-GO groups; however, cell viability was decreased, which is likely connected to the smaller active surface of GO after ultrasonic modifications.
Conclusions
Ag-NPs, GO, and Ag-GO nanocomposites demonstrated the antibacterial activity that is stronger against gram-negative bacteria (E . coli ) versus gram-positive bacteria (S . aureus and S . epidermidis ) and yeast (C . albicans ). The results showed that the decoration of GO with Ag-NPs promotes a synergistic effect and reduces dramatically the concentrations required to inhibit all tested bacterial and yeast strains. The antimicrobial potential of Ag-GO is also influenced by the thickness of the cell wall of the microorganisms. The thicker peptidoglycan layer in gram-positive bacteria, such as S . aureus and S . epidermidis , may explain why these bacteria are more resistant to the antibacterial effects of GO-Ag. A disruption of membrane functionality from an interaction between released Ag nanoparticles/Ag + ions and the cell membrane and extensive cell membrane damage caused by the formation of ROS ultimately caused damage to the cell due to oxidative stress. In order to explain the mechanism of ROS production, additional studies are needed. Our research indicates the potential applicability of GO-Ag as an antimicrobial agent.
Abreviaturas
- AFM:
-
Microscopía de fuerza atómica
- Ag-NPs:
-
Silver nanoparticles
- DLS:
-
Dispersión de luz dinámica
- GO:
-
Óxido de grafeno
- GO-Ag:
-
Graphene oxide decorated with silver nanoparticles
- LDE:
-
Laser Doppler electrophoresis
- LDH:
-
Lactate dehydrogenase
- ROS:
-
Reactive oxygen species
- SEM:
-
Microscopía electrónica de barrido
- XRD:
-
Difracción de rayos X
Nanomateriales
- Nanofibras poliméricas electrohiladas decoradas con nanopartículas de metales nobles para detección química
- Nanotubos de titanato Nanocompuestos de óxido de grafeno decorados:preparación, retardo de llama y fotodegradación
- Nuevos nanocompuestos de poliestireno con polianilina dopado con ácido lauril sulfúrico
- Dirigirse a las células endoteliales con nanopartículas multifuncionales de GaN / Fe
- Bioseguridad y capacidad antibacteriana del grafeno y el óxido de grafeno in vitro e in vivo
- Efectos sinérgicos de nanopartículas de Ag / BiV1-xMoxO4 con actividad fotocatalítica mejorada
- Nanocompuestos magnéticos de poli (N-isopropilacrilamida):efecto del método de preparación sobre las propiedades antibacterianas
- Promoción del crecimiento celular SH-SY5Y mediante nanopartículas de oro modificadas con 6-mercaptopurina y un péptido penetrante de neuronas
- Actividad antibacteriana de la solución de nanopartículas de plata / quitosano preparada in situ contra cepas de Staphylococcus aureus resistentes a la meticilina
- Avances recientes en métodos sintéticos y aplicaciones de nanoestructuras de plata
- Toxicidad de nanopartículas de CoFe2O4 recubiertas de PEG con efecto de tratamiento de curcumina



