Toxicidad de nanopartículas de CoFe2O4 recubiertas de PEG con efecto de tratamiento de curcumina
Resumen
En este trabajo, CoFe 2 O 4 Las nanopartículas recubiertas con polietilenglicol (PEG) se sintetizaron con éxito mediante una técnica hidrotermal. Los estudios morfológicos de las muestras confirmaron la formación de PEG-CoFe 2 de fase pura policristalina O 4 nanopartículas con tamaños de aproximadamente 24 nm. Toxicidad inducida por CoFe 2 O 4 Se investigaron nanopartículas y se realizaron ensayos biológicos para comprobar los efectos de toxicidad de CoFe 2 O 4 nanopartículas. Además, se estudió el efecto curativo de la toxicidad inducida en organismos vivos utilizando curcumina y se encontró que los índices bioquímicos se desintoxicaron y mejoraron para alcanzar su nivel normal después de la administración de curcumina. Por lo tanto, CoFe 2 recubierto de PEG O 4 sintetizado mediante un método hidrotermal se puede utilizar en aplicaciones biomédicas y la curcumina, que es una sustancia química natural sin efectos secundarios, se puede utilizar para el tratamiento de la toxicidad inducida por las nanopartículas en organismos vivos.
Antecedentes
El uso de nanopartículas (NP) ofrece muchas ventajas debido a sus propiedades químicas y físicas únicas que son sustancialmente diferentes de sus contrapartes a granel [1]. Ferrita de cobalto (CoFe 2 O 4 ) como uno de los materiales magnéticos más importantes ha despertado un inmenso interés a nanoescala debido a sus diversas aplicaciones en tecnologías recientes [2, 3, 4, 5]. Es considerado como uno de los candidatos competitivos por su amplia gama de aplicaciones, principalmente en la industria médica, debido a su capacidad para poseer las propiedades físicas y químicas deseadas a nanoescala. Además, CoFe 2 O 4 es fácil y rentable de fabricar con una composición, forma y tamaño controlados necesarios para una aplicación en particular. En este sentido, el diámetro de CoFe 2 O 4 Las nanopartículas para aplicaciones biológicas por debajo de 100 nm pueden influir en gran medida en las propiedades fisicoquímicas y la farmacocinética de los organismos vivos. Las partículas más grandes con un diámetro superior a 100 nm se utilizan como agente de contraste para la formación de imágenes por resonancia magnética del tracto gastrointestinal, mientras que las partículas más pequeñas, por debajo de ~ 20 nm, se utilizan como vehículos para tratamientos de tumores. Para la aplicación clínica de nanopartículas de ferrita de cobalto, es muy importante investigar la bioseguridad tanto in vivo como in vitro [6, 7]. Muchas nanopartículas que se ingieren por vía oral o intravenosa en el cuerpo se distribuyen principalmente en el hígado, los riñones y los pulmones para provocar diversas inflamaciones en estos órganos. En comparación con otros materiales, la ferrita de cobalto no se ha estudiado extensamente para explorar su toxicidad en organismos vivos y luego su efecto curativo usando curcumina, aunque se han informado pocos otros trabajos sobre la investigación de la toxicidad y bioseguridad de la ferrita de cobalto recubierta con polietilenglicol (PEG). nanopartículas.
Desde el punto de vista de la toxicidad, la principal preocupación es la exposición excesiva que requiere la eliminación de las nanopartículas acumuladas en los órganos biológicos, así como el tratamiento urgente de los trastornos inflamatorios. Algunos investigadores han intentado estudiar varios fármacos antiinflamatorios sobre el tratamiento de la toxicidad de las nanopartículas in vivo, y encontraron que estos fármacos antiinflamatorios podrían promover la excreción de nanopartículas que se acumulan en el cuerpo en cierta medida con el fin de reducir o eliminar los efectos inflamatorios de los tejidos [8, 9]. Curcuma longa (cúrcuma) es una hierba medicinal tradicional con una historia bastante larga de su uso como tratamiento para enfermedades inflamatorias en el sudeste asiático. Se han informado numerosos estudios sobre las propiedades antioxidantes, los efectos antimutación y antitumoral y las características cancerígenas de la curcumina [10, 11]. La curcumina tiene la capacidad de curar heridas, así como de tratar las dolencias del hígado, las enfermedades del tracto urinario y la hepatitis [11]. Alivia el estrés oxidativo y la inflamación en enfermedades crónicas a través de la vía Nrf2-keap1. La curcumina puede suprimir las vías proinflamatorias relacionadas con la mayoría de las enfermedades crónicas y bloquea tanto la producción de TNF como la señalización celular mediada por TNF en varios tipos de células. Además, la curcumina también puede actuar como un bloqueador del TNF in vitro e in vivo al unirse directamente al TNF [12].
En este estudio, hemos preparado con éxito CoFe 2 recubierto con PEG O 4 nanopartículas de forma controlada y tamaño de unos 25 nm mediante técnica hidrotermal. Después de administrar diferentes exposiciones (dosis) de CoFe 2 O 4 nanopartículas, hemos examinado análisis de sangre, tinción HE y biodistribución, así como el efecto del tratamiento de la curcumina sobre la toxicidad causada por PEG-CoFe 2 O 4 nanopartículas. Este estudio presenta un nuevo enfoque para investigar el efecto de toxicidad de CoFe 2 O 4 nanopartículas y luego el tratamiento de la toxicidad causada por PEG-CoFe 2 O 4 nanopartículas in vivo utilizando curcumina.
Métodos
Preparación de nanopartículas de ferrita de cobalto
Las nanopartículas de ferrita de cobalto se sintetizaron mediante una técnica hidrotermal. Para ello, se disolvió una cantidad adecuada de nitrato férrico y cloruro de cobalto en agua desionizada y luego se mezcló con soluciones acuosas de PEG e hidróxido de sodio (NaOH). Se utilizó agua desionizada bidestilada como disolvente para evitar la presencia de impurezas en las nanopartículas finales. La mezcla se agitó durante aproximadamente 30 min usando un agitador magnético y luego se vertió en el autoclave y se calentó durante 6 ha 180ºC para realizar la reacción hidrotermal. Una vez completada la reacción, el producto se enfrió a temperatura ambiente y luego se lavó dos veces con agua desionizada y luego con etanol para eliminar el exceso de PEG y otras sales no disueltas, si estaban presentes en la solución. Finalmente, el producto se secó a 80 ° C durante la noche y luego se molió en polvo para obtener las nanopartículas de ferrita de cobalto deseadas. En esta etapa, las nanopartículas se encontraron amorfas, lo que fue confirmado por la XRD mostrada en la Fig. 2a. Para obtener las nanopartículas en forma cristalina, las muestras se recocieron a 500 ° C durante 6 h y el producto final se obtuvo en forma de PEG-CoFe 2 cristalino. O 4 nanopartículas que fue confirmado por la XRD que se muestra en la Fig. 2b.
Etiquetado de 99mTc de PEG-CoFe 2 O 4 Nanopartículas
Radiomarcaje de CoFe 2 recubierto con PEG O 4 Las nanopartículas se realizaron con 99mTc utilizando cloruro estannoso (SnCl 2 ) como agente reductor y disolvió las nanopartículas en agua desionizada en condiciones de ultrasonidos durante aproximadamente 0,5 h. SnCl 2 , ácido ascórbico y 99mTcO 4 luego se añadieron a la suspensión de nanopartículas (con ferrita de cobalto de ~ 0,4% en peso). Para obtener datos precisos, los recuentos radiactivos se midieron en 24 h debido a la corta vida útil del 99mTc (~ 6 h). El pH de la mezcla se ajustó en el rango de 5 a 10 usando NaHCO 3 1.0 M solución; luego, suspensión de PEG-CoFe 2 O 4 se le añadió y la mezcla resultante se agitó luego a 10.000 durante 25 min a 80ºC. Después de la centrifugación, se decantó el sobrenadante y se identificó que el material restante era 99mTc PEG-CoFe 2 O 4 . Se usó un cromatograma de papel (bajo las soluciones cromatográficas de solución salina normal y acetona) para medir los rendimientos de los compuestos marcados. Se descubrió que el rendimiento del etiquetado radiactivo de las nanopartículas ronda el 70%, lo que refleja la distribución real y el metabolismo in vivo.
Biodistribución de PEG-CoFe 2 O 4 Nanopartículas
Los ratones Kunming que pesaban entre 15 y 18 g fueron proporcionados por el Centro de Laboratorio de Ciencias Médicas de la Universidad de Lanzhou, Gansu, República Popular de China. Todos los animales se alojaron en jaulas individuales con un sistema de temperatura controlada (21 a 22 ° C) y las luces se encendieron de 08:00 a 20:00 horas. Se les dio a los ratones comida y agua adecuadas según lo recomendado de acuerdo con los protocolos para animales de la Directiva del Consejo de las Comunidades Europeas del 24 de noviembre de 1986 (86/609 / EEC), y aprobados por los Comités Institucionales de Cuidado y Uso de Animales del Centro Médico de Animales de la provincia de Gansu. y las Directrices de los comités de animales de la Universidad de Lanzhou (China). Los ratones se dividieron al azar en siete grupos (cinco ratones / grupo), inyectados por vía intravenosa con 99mTc-PEG-CoFe 2 O 4 solución, y luego se mató a las 1, 6, 16 y 24 h después de la inyección. Se disecaron inmediatamente tejidos del corazón, pulmón, hígado, bazo y riñón y luego se extrajo una cantidad sustancial de sangre. Cada tejido se envolvió en papel de aluminio, se pesó adecuadamente y se contó para 99mTc. Los puntos de datos se corrigieron por la desintegración física de la radiactividad. La distribución del tejido se presentó en porcentaje de dosis inyectada por gramo de tejido húmedo (% DI / g), que podría calcularse mediante el porcentaje inyectado (actividad tisular / dosis de actividad total) por gramo de tejido húmedo.
Efecto de la dosis sobre la toxicidad de PEG-CoFe 2 O 4 en ratones
En este experimento, 21 ratones se dividieron en siete grupos (tres ratones / grupo). PEG-CoFe 2 O 4 Se inyectaron nanopartículas en ratones por vía intravenosa a diferentes dosis de 125, 250 y 350 μg / ratón (0,2 ml) con el grupo de control que se trató con solución salina normal al 0,9%. En el grupo de tratamiento, también se inyectaron por vía intravenosa en ratones diferentes dosis de 125, 250 y 350 μg / ratón de curcumina. Los grupos dañados se sacrificaron después de 24 h, mientras que los grupos de tratamiento se sacrificaron después de 3 días. Se recogió sangre de los ratones y se centrifugó durante aproximadamente 10 minutos para obtener el suero. Se midieron los contenidos séricos de bilirrubina total (TB), alanina aminotransferasa (ALT), aspartato transaminasa (AST), nitrógeno ureico en sangre (BUN), creatinina (CREA) y cistatina C (Cys-C). Al mismo tiempo, se extrajeron inmediatamente el hígado, los pulmones, el bazo, los riñones y el corazón. Estos tejidos se fijaron en formalina tamponada al 10% y se procesaron para la histología de rutina con hematoxilina y eosina. La observación microscópica de los tejidos se realizó utilizando un microscopio Olympus Microphot-CX41 junto con una cámara digital.
Resultados y discusión
Análisis de TEM y XRD
La caracterización morfológica se realizó utilizando un microscopio electrónico de transmisión JEOL JEM-1400 y un difractómetro de rayos X (Shimadzu XRD-7000) con cobre K α como fuente de radiación. La Figura 1 muestra las imágenes TEM de nanopartículas de ferrita de cobalto recubiertas con PEG con diferentes resoluciones (Fig. 1a, b), lo que confirma la formación exitosa de nanopartículas de ferrita de cobalto recubiertas con PEG en fase pura con un tamaño de partícula de aproximadamente 24 nm. La Figura 2 muestra el análisis de difracción de rayos X de las nanopartículas preparadas. La Figura 2a indica los resultados de XRD de las muestras preparadas, que muestran que las nanopartículas están en su mayoría en forma amorfa. Sin embargo, cuando las muestras se recocieron a alta temperatura (es decir, 500 ° C) durante 6 h, se encontró que las nanopartículas se convirtieron en forma cristalina, lo que se puede ver en la imagen XRD presentada en la Fig. 2b. El tamaño medio de cristalito se calculó a partir del ensanchamiento de la línea del pico más fuerte en el análisis XRD (Fig. 2b) utilizando la ecuación de Debye-Scherrer ( D = Kλ / β porque θ ) [13], que resulta ser ~ 22 nm. Las posiciones e intensidades relativas de todos los picos observados en el patrón XRD indican que la estructura cristalina favorece la formación de la estructura de espinela cúbica de las nanopartículas según la tarjeta JCPDF (tarjeta nº 20-1086) mostrada en el recuadro de la Fig. 2b. Todos los picos están indexados correctamente y no se ven picos adicionales en el patrón XRD, lo que indica que no hay impurezas presentes en las muestras. Los resultados de TEM y XRD confirman la formación exitosa de nanopartículas cristalinas de aproximadamente 22-25 nm.

un , b Imágenes de microscopía electrónica de transmisión (TEM) de nanopartículas de ferrita de cobalto recubiertas con PEG recogidas en diferentes resoluciones
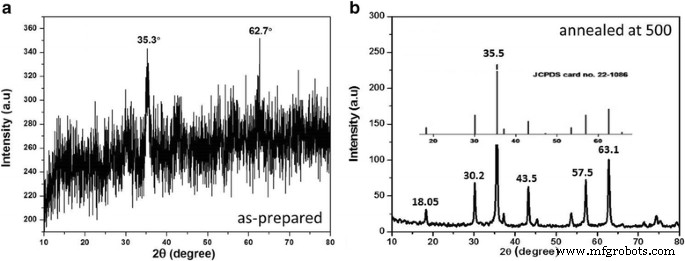
Resultados XRD de las muestras a tal como está preparado y b recocido a 500 ° C. El recuadro muestra la tarjeta JCPDF para ferrita de cobalto. No se pueden ver picos adicionales en los datos XRD obtenidos
Espectroscopia infrarroja por transformada de Fourier, análisis Raman y TG
Se empleó la espectroscopia infrarroja por transformada de Fourier (FTIR) para investigar las propiedades estructurales y la distribución de cationes de las nanopartículas de ferrita de cobalto. La figura 3 muestra el espectro infrarrojo de las muestras tomadas a temperatura ambiente. Generalmente, la ferrita de cobalto tiene dos bandas de absorción fuertes, ʋ 1 y ʋ 2 , que aparecen en el rango de 400 a 600 cm −1 [14,15,16], que son bastante obvias en nuestro caso. Banda superior ( ʋ 1 ) corresponde a las vibraciones de estiramiento intrínsecas del metal (M – O) en los sitios de la red tetraédrica mientras que la banda inferior ( ʋ 2 ) representa las vibraciones de estiramiento de los iones metálicos en los sitios octaédricos [14, 15, 16]. Estos resultados revelan la formación exitosa de nanopartículas de ferrita de cobalto de estructura cúbica. A partir de los datos de FTIR, el pico se muestra a ~ 3400 cm −1 indica claramente el pico de PEG, que confirma la unión exitosa de PEG con nanopartículas de ferrita de cobalto.
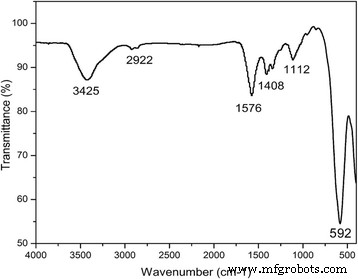
Espectroscopía infrarroja por transformada de Fourier (FTIR) empleada en el rango de 500 a 4000 cm −1 para investigar las propiedades estructurales de las muestras. Los datos confirman las nanopartículas de ferrita de cobalto recubiertas con PEG
El espectro Raman a temperatura ambiente de las muestras se muestra en la Fig. 4, que representa diferentes picos en el rango de 190 a 684 cm −1 . El pico principal a alta frecuencia (684 cm −1 ) es el pico característico de la ferrita de espinela atribuido a A 1g modo que corresponde al estiramiento simétrico de los iones de oxígeno a lo largo de los enlaces Fe-O en los sitios tetraédricos [17]. Los picos de frecuencia más baja también pertenecen a la ferrita de cobalto estructurada con espinela. La aparición de todos estos picos en el espectro Raman a energías apropiadas confirma la formación exitosa de CoFe 2 cúbico recubierto de PEG O 4 nanopartículas.
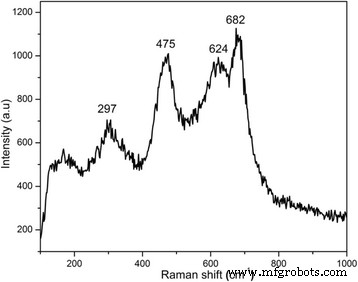
Espectro Raman a temperatura ambiente de las muestras recolectadas en 190-1000 cm −1 rango de frecuencia
Análisis termogravimétrico (TGA) de las muestras (CoFe 2 O 4 , PEG y PEG-CoFe 2 O 4 ) se realizó entre 50 y 600 ° C, y los resultados se muestran en la Fig. 5. Estos termogramas muestran que CoFe 2 O 4 las nanopartículas pierden su peso en el rango de 200 a 300 ° C, el PEG pierde su peso a una temperatura por debajo de los 400 ° C, mientras que el PEG-CoFe 2 O 4 pierde su peso en el rango de temperatura 200–400 ° C. Se ve que la estabilidad térmica del PEG es relativamente pobre (mostrado en el lado derecho de la figura); sin embargo, la estabilidad térmica de PEG-CoFe 2 O 4 parece ser más del 80%. Las nanopartículas de ferrita de cobalto puro son insolubles en agua; sin embargo, se puede disolver fácilmente en agua después de recubrir con PEG debido a su naturaleza hidrofílica como se muestra en la Fig. 6. Se ve en la figura que con el paso del tiempo, las partículas se depositan en el fondo de la botella, lo que probablemente se deba a la gravedad de las nanopartículas. La Figura 6 muestra el tiempo de evolución de la disolución de nanopartículas de ferrita de cobalto recubiertas con PEG. En nuestro caso, dispersamos completamente las nanopartículas en solución salina antes de inyectarlas en el cuerpo de los ratones para asegurar su correcta entrega en los diferentes órganos de los ratones.
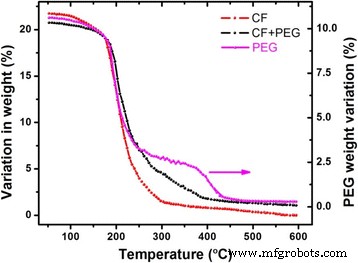
Análisis termogravimétrico (TGA) de CoFe puro 2 O 4 , PEG y CoFe 2 recubierto con PEG O 4 tomado en el rango de temperatura 50–600 ° C

Solubilidad de PEG-CoFe 2 O 4 nanopartículas en agua desionizada a diferentes intervalos (5, 10, 30 y 60 min) de tiempo
Estudios de biodistribución
Para cuantificar con precisión la cantidad de nanoportador en cada órgano después de la administración en un organismo vivo, biodistribución del 99mTc PEG-CoFe 2 O 4 se realizó en ratones normales. Se ve que la captación de PEG-CoFe 2 O 4 es mayor en el hígado y el bazo como se muestra en la Fig. 7 y estos resultados son los mismos con la referencia [18] donde la captación de ferrita de cobalto radiomarcada 1 h después de la inyección es tres veces mayor en el hígado y el bazo que la de otros nanopartículas. La razón es que los tejidos que se unen a los sistemas reticuloendoteliales, como el hígado y el bazo, absorben en gran medida estas partículas extrañas, ya que estos órganos tienen células de Kupffer, que actúan como una función de limpieza y juegan un papel importante en la eliminación de nano y micromateriales del tejido. Circulación corporal por fagocitosis [19]. En este trabajo, se observa que la distribución de PEG-CoFe 2 O 4 en los tejidos disminuye con el paso del tiempo, lo que significa que PEG-CoFe 2 O 4 Las nanopartículas se excretan con el tiempo a través del proceso de micción. El riñón es el sistema excretor de las nanopartículas a través de la orina. En la figura 7, se observa la máxima biodistribución en el riñón en 1 h [20]. La acumulación de sangre fue alta solo inmediatamente después de la inyección, lo que indica una eliminación relativamente rápida de radiactividad de la reserva de sangre del cuerpo, como se muestra en la Figura 7, que es similar al caso de las nanopartículas de óxido de hierro que llevan cadenas de PEG que tienen una presencia prolongada en la sangre. piscina [21, 22]. Además, se encontró que la biodistribución en el corazón es muy baja, que es la misma que se informa en la referencia [23]. Es notable que el bazo es un sitio primario para la destrucción de glóbulos rojos viejos y el subsecuente reciclaje de FE unida a hemoglobina [18, 24]. Se ha observado que con el tiempo se activan procesos más lentos pero más eficientes en el bazo y son más capaces de eliminar las nanopartículas de la circulación, dando como resultado el aumento de las concentraciones de radiactividad tisular después de 1 h después de la inyección. Captación pulmonar de PEG-CoFe 2 O 4 fue insignificante a lo largo de nuestro estudio, como se muestra en la Fig. 7. Se ha informado un trabajo similar en la referencia [23]. Esto indica que ningún microagregado puede quedar atrapado irreversiblemente en los capilares de los pulmones [23, 25, 26].
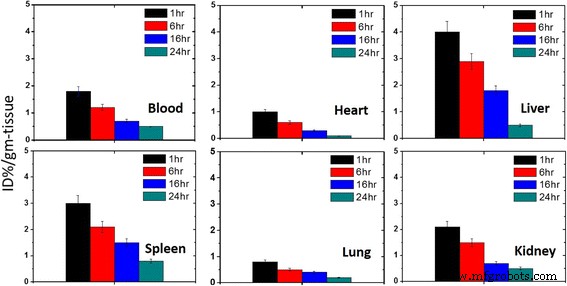
Biodistribución de PEG-CoFe 2 O 4 nanopartículas en sangre, corazón, hígado, bazo, pulmones y riñón después de diferentes intervalos (1, 6, 16 y 24 h) de exposición a ratones. Las barras de error en los datos obtenidos se muestran en la figura
Efecto de la dosis de PEG-CoFe 2 O 4 sobre toxicidad
Para revelar cualquier efecto tóxico potencial de PEG-CoFe 2 O 4 , realizamos la prueba de bioquímica en ratones in vivo. Para ello, inyectamos una solución mixta de suero fisiológico y PEG-CoFe 2 O 4 de diferentes cantidades (150, 250 y 350 μg) y sacrificaron a los ratones después de 24 h. Para el análisis de sangre, la sangre se recogió y se centrifugó durante aproximadamente 10 minutos para obtener el suero. Se probaron varios parámetros centrándose en marcadores de función hepática y renal, incluidos Cys-C, CREA, ALT, AST, TB y BUN. Luego, estos parámetros se compararon con los grupos de control utilizando el software SPSS ( p <0,05 indica una diferencia significativa), y los resultados se muestran en la Fig. 8. Se puede ver una diferencia significativa en ALT, BUN y CREA-A entre los grupos de exposición y control. Se observa que la TB y Cys-C, que son los principales responsables de un biomarcador del contenido de la función renal, disminuyeron significativamente para la exposición de 150 μg por ratón de PEG-CoFe 2 O 4 y se encontró que aumentaba a 250 μg por dosis de ratón, mientras que llega al nivel normal de 350 μg por ratón. Esto sugiere que, hasta cierto punto, la función renal se ve afectada por la exposición de PEG-CoFe 2 O 4 pero no dañó los tejidos de manera significativa. AST, que es un biomarcador para la salud del hígado, disminuyó significativamente por la exposición a todas las dosis, lo que indica que puede afectar más la función hepática en comparación con los ratones del grupo de control. De todos estos resultados, queda claro que un PEG-CoFe 2 O 4 la dosis de 250 μg / ratón presenta un daño relativamente mayor. Por lo tanto, para análisis y pruebas adicionales en nuestro experimento, usamos 250 μg / ratón de PEG-CoFe 2 O 4 dosis.
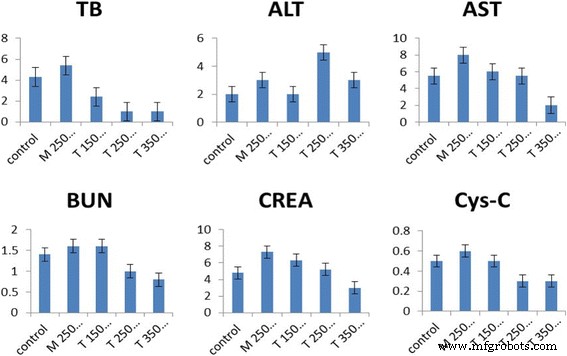
Contenido de índices bioquímicos en suero después de diferentes dosis (en μg) de PEG-CoFe 2 O 4 exposición a ratones con barras de error que se muestran en la figura
Efecto de la curcumina sobre la toxicidad de PEG-CoFe 2 O 4
En este estudio, se utilizó curcumina para reducir la inflamación debido al efecto dañino de PEG-CoFe 2 O 4 . Para investigar el efecto de la curcumina sobre la toxicidad de PEG-CoFe 2 O 4 , se midieron los índices bioquímicos y la histología de tejidos de ratones. Estos índices bioquímicos incluyen BUN, CREA, Cys-C, ALT, AST y TB en el suero de los ratones del grupo de tratamiento. Se ve que BUN, CREA, Cys-C y AST muestran una disminución significativa en diferentes dosis de curcumina en comparación con el grupo de exposición, mientras que en una dosis de 150 μg / ratón de curcumina, ALT, AST y CREA llegan a el nivel normal en comparación con el grupo de control como se muestra en la Fig. 9. En los contenidos de TB y ALT, todas las dosis de curcumina muestran una disminución significativa en comparación con el grupo de exposición de PEG-CoFe 2 O 4 . En la Fig. 9, los resultados indican que la curcumina exhibe un efecto de tratamiento positivo sobre el daño de PEG-CoFe 2 O 4 en ratones y diferentes dosis de curcumina muestran un mejor efecto de tratamiento. Este trabajo investiga el efecto protector de la curcumina contra el nivel sérico de enzimas hepáticas (ALT y AST) y enzimas renales (BUN, CREA, Cys-C y TB). En este estudio, PEG-CoFe 2 O 4 aumentó significativamente el nivel sérico de las enzimas ALT, AST, BUN, CREA, Cys-C y TB en comparación con el grupo de control, que en su mayoría se acercó al nivel normal después de la administración de curcumina. La necrosis o el daño de la membrana celular pueden provocar la liberación de estas enzimas en la sangre. Sin embargo, el nivel sérico de estas enzimas está asociado con el funcionamiento del hígado y los riñones. En los grupos que recibieron curcumina, la cantidad de estas enzimas se redujo, lo que indica los efectos protectores de la curcumina contra la toxicidad de PEG-CoFe 2 O 4 nanopartículas. Esto se debe al efecto antioxidante de la curcumina que reduce el estrés oxidativo. Además, el TNF-α y la IL-1 juegan un papel en la inducción de la necrosis hepática. Por tanto, la curcumina puede reducir el efecto de la toxicidad inhibiendo la secreción de TNF-α e IL-1 por los macrófagos [11]. Estos hallazgos concuerdan con otros resultados informados en la referencia [27].
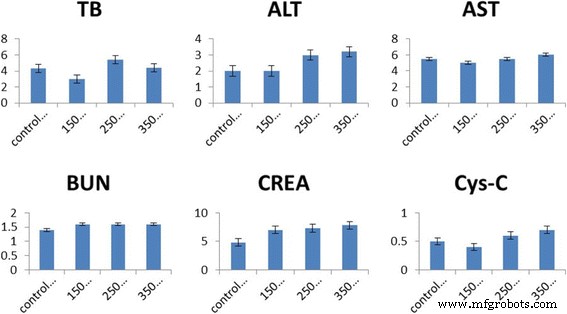
Contenido de índices bioquímicos en suero en los ratones del grupo de tratamiento con curcumina con barras de error indicadas en el gráfico
También se realizó el análisis histopatológico de hígado, riñones y bazo con el fin de verificar los posibles efectos tóxicos inducidos por la administración de nanopartículas. Se extrajeron los órganos de cada ratón, se trataron con formalina al 10% y se incluyeron en parafina. Se tiñeron secciones de cinco micrómetros con hematoxilina-eosina (H&E) y se examinaron microscópicamente. Los resultados muestran que no se registraron cambios histopatológicos relevantes en los órganos analizados que se muestran en la Fig. 10. Los exámenes de hígado y bazo mostraron que la arquitectura del órgano no se vio afectada por la administración de nanopartículas de ferrita de cobalto. Esto se debe a dos posibles razones:en primer lugar, el tamaño de las nanopartículas es relativamente mayor (es decir, 24 nm), y en segundo lugar, administramos una pequeña dosis de nanopartículas de ferrita de cobalto (es decir, 150, 250 y 350 μm) y las matamos. los ratones después de 24 h. Entonces, esto solo afecta la función de los órganos, pero posiblemente no afectó su arquitectura. Esto es similar al caso reportado por los autores en la referencia [28], donde dieron 20 mg / kg (más alto que nuestro caso) durante 7 días. De manera similar, en otro caso reportado en la referencia [29], no se monitorearon cambios histopatológicos en los órganos.
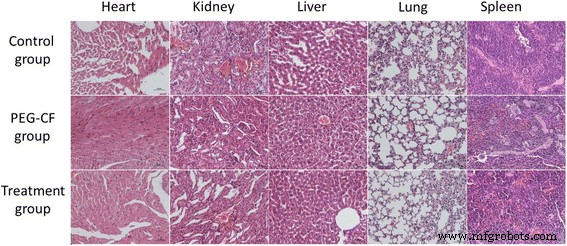
Secciones de histología de tejidos después de la exposición de PEG-CoFe 2 O 4 o curcumina a los ratones
Conclusión
En este trabajo, fabricamos con éxito nanopartículas de ferrita de cobalto recubiertas con PEG de 24 nm utilizando una técnica hidrotermal. Se exploró en detalle la toxicidad inducida en varios órganos de ratones utilizando diferentes dosis de nanopartículas de ferrita de cobalto PEG y luego se estudió su efecto curativo utilizando curcumina. Se realizaron ensayos biológicos para comprobar la toxicidad de CoFe 2 O 4 nanopartículas. Se controlaron los cambios positivos en los índices bioquímicos después del tratamiento con curcumina, que llegaron al nivel normal o disminuyeron sustancialmente. Este estudio indica que CoFe 2 recubierto de PEG O 4 sintetizada mediante una técnica hidrotermal es un buen modelo para un portador de fármacos y la curcumina, que es una sustancia química natural y no posee efectos secundarios, podría utilizarse para el tratamiento de la toxicidad, así como para otras enfermedades en organismos vivos.
Abreviaturas
- ALT:
-
Alanina aminotransferasa
- AST:
-
Aspartato transferasa
- BUN:
-
Nitrógeno ureico en sangre
- CREA:
-
Creatinina
- Cys-C:
-
Cistatina C
- FTIR:
-
Espectroscopía infrarroja por transformada de Fourier
- H&E:
-
Hematoxilina-eosina
- NP:
-
Nanopartículas
- Nrf2:
-
Factor 2 relacionado con el factor nuclear eritroide 2
- PEG:
-
Polietilenglicol
- TB:
-
Bilirrubina total
- TEM:
-
Microscopía electrónica de transmisión
- TGA:
-
Análisis termogravimétrico
- TNF:
-
Factor de necrosis tumoral
- XRD:
-
Difracción de rayos X
Nanomateriales
- Control de un efecto con sensores reales
- Nanopartículas como bomba de eflujo e inhibidor de biopelícula para rejuvenecer el efecto bactericida de los antibióticos convencionales
- Nanofibras poliméricas electrohiladas decoradas con nanopartículas de metales nobles para detección química
- Síntesis fácil de compuesto de CuSCN coloreado y conductor recubierto con nanopartículas de CuS
- Dirigirse a las células endoteliales con nanopartículas multifuncionales de GaN / Fe
- Efectos sinérgicos de nanopartículas de Ag / BiV1-xMoxO4 con actividad fotocatalítica mejorada
- Mecanismo de conducción y resistencia mejorada en RRAM basado en HfO2 con tratamiento de nitruración
- Efecto del método de síntesis de nanopartículas de manganita La1 - xSr x MnO3 en sus propiedades
- Estudio del efecto de la dirección de impacto en el proceso de corte nanométrico abrasivo con dinámica molecular
- Efecto de nanopartículas de ingeniería en la liberación de sustancias exopoliméricas del fitoplancton marino
- Profundos efectos interfaciales en CoFe2O4 / Fe3O4 y Fe3O4 / CoFe2O4 Core / Shell Nanoparticles



