Un nuevo fotocatalizador de heterounión Bi4Ti3O12 / Ag3PO4 con rendimiento fotocatalítico mejorado
Resumen
En este trabajo, integramos Ag 3 PO 4 con Bi 4 Ti 3 O 12 para formar Bi 4 Ti 3 O 12 / Ag 3 PO 4 nanocompuestos de heterounión por un método de intercambio iónico. El Bi 4 preparado Ti 3 O 12 / Ag 3 PO 4 Los compuestos se caracterizaron sistemáticamente por medio de XRD, SEM, TEM, BET, XPS, UV-vis DRS, EIS, espectroscopía PL y respuesta de fotocorriente. Los resultados de SEM, TEM y XPS demuestran la creación de Bi 4 Ti 3 O 12 / Ag 3 PO 4 heterounión con interacción interfacial obvia entre Bi 4 Ti 3 O 12 y Ag 3 PO 4 . Los espectros PL, los espectros EIS y las respuestas de fotocorriente revelan que los compuestos muestran una eficiencia de separación mejorada de pares de electrones y huecos fotogenerados, que se debe a la transferencia de carga entre Bi 4 Ti 3 O 12 y Ag 3 PO 4 . Se eligió rodamina B (RhB) como el contaminante orgánico objetivo para evaluar su comportamiento de degradación sobre Bi 4 Ti 3 O 12 / Ag 3 PO 4 compuestos bajo irradiación solar simulada. Comparado con Bi 4 desnudo Ti 3 O 12 y Ag 3 PO 4 nanopartículas, los compuestos exhiben una actividad fotocatalítica significativamente mejorada. La actividad fotocatalítica más alta se observa para el 10% de Bi 4 Ti 3 O 12 / Ag 3 PO 4 compuesto con 10% Bi 4 Ti 3 O 12 contenido, que es aproximadamente 2,6 veces mayor que el de Ag 3 PO 4 . El mecanismo fotocatalítico involucrado fue investigado y discutido en detalle.
Antecedentes
Con el rápido desarrollo de la economía, la contaminación ambiental se ha convertido en uno de los problemas más graves para los humanos. Particularmente, una gran cantidad de aguas residuales que contienen diversos tintes y pigmentos orgánicos se genera anualmente a partir de industrias químicas como fabricantes de papel, textiles, pinturas y cosméticos en todo el mundo. Antes de descargar las aguas residuales al río, esos contaminantes orgánicos deben eliminarse, ya que la mayoría de ellos no son biodegradables y cancerígenos y representan una inmensa amenaza para el medio ambiente y la salud humana. La fotocatálisis de semiconductores se ha considerado una de las tecnologías de tratamiento de aguas residuales más prometedoras [1, 2, 3, 4, 5, 6, 7, 8, 9]. Esta tecnología puede utilizar energía solar como fuente de energía para la descomposición de contaminantes orgánicos. Para utilizar la energía solar de forma más eficaz en la fotocatálisis, es muy deseable desarrollar fotocatalizadores que respondan a la luz visible, ya que la luz visible representa el 45% de la energía solar. Además, para lograr una buena actividad fotocatalítica del fotocatalizador, el agujero de electrones fotogenerado (e - -h + ) los pares deben estar efectivamente separados porque la reacción fotocatalítica está asociada con los electrones y huecos fotogenerados [10, 11].
Recientemente, el ortofosfato de plata (Ag 3 PO 4 ) con una energía de banda prohibida de ~ 2,4 eV se ha estudiado ampliamente como un fotocatalizador de luz visible prometedor [12,13,14,15,16,17,18,19,20,21,22,23,24,25,26, 27,28,29,30,31]. Los primeros cálculos del principio basados en la teoría funcional de la densidad sugirieron que Ag 3 PO 4 tiene una estructura de banda altamente dispersiva del mínimo de banda de conducción resultante de Ag s -Ag s hibridación sin d localizado afirma [32], lo que es ventajoso para la separación de pares de huecos de electrones, así como para la transferencia de electrones. Además, Ag 3 PO 4 tiene una eficiencia cuántica mucho más alta que los valores reportados para otros semiconductores (~ 90% a λ> 420 nm) [12, 13]. Estos hacen Ag 3 PO 4 una excelente actividad fotocatalítica para la descomposición de contaminantes orgánicos así como O 2 Evolución de la división del agua bajo irradiación de luz visible. Sin embargo, todavía existen algunas limitaciones en el Ag 3 PO 4 fotocatalizador. Se observa que el potencial de la banda de conducción de Ag 3 PO 4 es más positivo que el del electrodo de hidrógeno [12]. Esto significa que si no hay aceptores de electrones de sacrificio involucrados en el sistema fotocatalítico, los electrones fotogenerados podrían reducir la red Ag + en Ag 3 PO 4 en Ag metálico durante el proceso fotocatalítico. Este fenómeno auto-fotocorrosivo conduce a una disminución en la estabilidad fotocatalítica de Ag 3 PO 4 . Además, Ag 3 PO 4 es ligeramente soluble en solución acuosa, lo que también podría disminuir su estabilidad estructural durante el proceso fotocatalítico. Para mejorar aún más el rendimiento fotocatalítico, así como la estabilidad fotocatalítica de Ag 3 PO 4 , se ha dedicado mucho trabajo reciente a los compuestos de heterounión construidos a partir de Ag 3 PO 4 y otros semiconductores, como AgX / Ag 3 PO 4 ( X =Cl, Br, I), Fe 3 O 4 / Ag 3 PO 4 , Ag 3 PO 4 / SnO 2 , Ag 3 PO 4 / TiO 2 , Ag 3 PO 4 / Bi 2 MoO 6 , g-C 3 N 4 / Ag 3 PO 4 , Ag 3 PO 4 / Director ejecutivo 2 , Ag 3 PO 4 / SrTiO 3 , Ag 3 PO 4 / BiPO 4 , Ag 3 PO 4 / MoS 2 y Ag 3 PO 4 / g-C 3 N 4 [33,34,35,36,37,38,39,40,41,42,43,44,45,46]. En estos fotocatalizadores compuestos, los electrones y huecos fotogenerados tienden a migrar de un semiconductor a otro, lo que conduce a una separación eficiente de los pares de huecos de electrones. Como resultado, hay más electrones y / o huecos fotogenerados disponibles para participar en reacciones fotocatalíticas. Se ha demostrado que los compuestos de heterounión exhiben un rendimiento fotocatalítico mejorado en comparación con los semiconductores individuales. Además, los comportamientos de fotocorrosión y solubilidad de Ag 3 PO 4 puede inhibirse hasta cierto punto por la construcción de compuestos de heterounión.
En este trabajo, reportamos la integración de Ag 3 PO 4 con Bi 4 Ti 3 O 12 para formar Ag 3 PO 4 / Bi 4 Ti 3 O 12 compuestos de heterounión. Bi 4 Ti 3 O 12 tiene una estructura en capas compuesta de alternativas (Bi 2 Ti 3 O 10 ) 2− bloques y (Bi 2 O 2 ) 2+ capas a lo largo de la c -orientación del eje [47]. El cálculo de la teoría funcional de la densidad ha demostrado que la banda de conducción (CB) y la banda de valencia (VB) de Bi 4 Ti 3 O 12 consisten en orbitales Ti 3d + Bi 6p y orbitales híbridos O 2p + Bi 6 s, respectivamente [48]. Debido a su estructura única de cristal en capas y su estructura de banda electrónica, Bi 4 Ti 3 O 12 exhibe una actividad fotocatalítica pronunciada hacia la degradación de contaminantes orgánicos [49,50,51,52,53]. Se sabe que Ag 3 PO 4 es un semiconductor de tipo p y Bi 4 Ti 3 O 12 es un semiconductor de tipo n. Las estructuras de bandas superpuestas bien emparejadas sugieren que Ag 3 PO 4 y Bi 4 Ti 3 O 12 se puede utilizar para construir un excelente fotocatalizador compuesto de heterounión p-n con un rendimiento super fotocatalítico.
Métodos
Síntesis de Bi 4 Ti 3 O 12 y Ag 3 PO 4 nanopartículas
Bi 4 Ti 3 O 12 Las nanopartículas se sintetizaron a través de una ruta de gel de poliacrilamida como se describe en la literatura [54]. Todas las materias primas y reactivos químicos eran de calidad analítica y se utilizaron sin purificación adicional. Cinco miligramos de HNO 3 se añadió a 20 ml de agua destilada para preparar una solución diluida de ácido nítrico. 0,00857 mol de Bi (NO 3 ) 3 · 5H 2 Se disolvió O en la solución de ácido nítrico diluido anterior (designada como solución A). 0,00643 mol de C 16 H 36 O 4 Se disolvió Ti en 25 ml de etanol (designado como solución B). La solución B se añadió lentamente a la solución A para obtener una solución de mezcla. A continuación, se añadieron sucesivamente a la solución de mezcla 0,0225 moles de ácido cítrico, 20 g de glucosa y 0,135 moles de acrilamida. Durante la adición de reactivos químicos, la solución se agitó mediante agitación magnética para hacer que los aditivos se disolvieran completamente. La solución resultante se calentó en un baño de agua a 80 ° C para iniciar la reacción de polimerización. Después de secar a 120 ° C durante 24 h en un secador de termostato, el xerogel formado se trituró en polvo y se sometió a calcinación en un horno tubular a 300 ° C durante 3 hy luego a 500 ° C durante 8 h. Después de que el horno tubular se enfrió naturalmente a temperatura ambiente, Bi 4 Ti 3 O 12 se obtuvieron nanopartículas.
Ag 3 PO 4 Las nanopartículas se sintetizaron mediante un método de intercambio iónico. 0,003 mol de AgNO 3 y 0,001 mol de Na 2 HPO 4 se disolvieron en 30 y 20 mL de agua destilada con la ayuda de agitación magnética, respectivamente. El Na 2 HPO 4 La solución se agregó gota a gota al AgNO 3 solución con agitación continua. A continuación, la solución de mezcla se agitó continuamente mediante un agitador magnético durante 5 h, tiempo durante el cual Ag 3 PO 4 se formaron nanopartículas. Las partículas producidas se recolectaron y lavaron varias veces con agua destilada y etanol absoluto, seguido de secado a 60 ° C durante 10 h.
Preparación de Bi 4 Ti 3 O 12 / Ag 3 PO 4 nanocompuestos
Una cantidad estequiométrica del Bi 4 preparado Ti 3 O 12 Se agregaron nanopartículas a 30 mL de agua destilada y se sometieron a un tratamiento ultrasónico durante 1 h para que las partículas se dispersaran uniformemente. En la suspensión se disolvieron 0,003 mol de AgNO 3 . 0,001 mol de Na 2 HPO 4 se disolvió en 20 ml de agua destilada, que luego se añadió gota a gota a la suspensión anterior. La solución de mezcla resultante se agitó magnéticamente durante 5 h, tiempo durante el cual Ag 3 PO 4 Las nanopartículas se cultivaron e integraron con Bi 4 Ti 3 O 12 nanopartículas para formar Bi 4 Ti 3 O 12 / Ag 3 PO 4 composicion. Los compuestos producidos se recogieron, se lavaron varias veces con agua destilada y etanol absoluto y se secaron a 60 ° C durante 10 h. Variando el Bi 4 Ti 3 O 12 contenido de 5 a 15%, varias muestras compuestas de 5% Bi 4 Ti 3 O 12 / Ag 3 PO 4 , 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 y 15% Bi 4 Ti 3 O 12 / Ag 3 PO 4 fueron preparados.
Caracterización de la muestra
Se utilizó difracción de rayos X en polvo (XRD) con radiación Cu Kα para determinar la estructura cristalina de las muestras. Se utilizaron microscopía electrónica de barrido de emisión de campo (SEM) y microscopía electrónica de transmisión de emisión de campo (TEM) para investigar la morfología y microestructura de las muestras. La absorción óptica y la energía de banda prohibida de las muestras se investigaron mediante espectroscopía de reflectancia difusa ultravioleta visible (UV-vis DRS) en un espectrofotómetro UV-vis con un accesorio de esfera integradora. La composición química y las energías de enlace de electrones para los elementos se midieron mediante espectroscopia de fotoelectrones de rayos X (XPS) en un espectrómetro de fotoelectrones de rayos X multifuncional PHI-5702, donde la escala de energía de enlace de los datos de XPS se calibró contra el pico adventicio de C 1s. a la energía de enlace de 284,8 eV. El espectro de fotoluminiscencia (PL) de las muestras se midió utilizando un espectrofotómetro de fluorescencia (longitud de onda de excitación 315 nm).
Medición fotoelectroquímica
Las propiedades fotoelectroquímicas de los fotocatalizadores se midieron mediante espectroscopia de impedancia electroquímica (EIS) y respuesta de fotocorriente en una estación de trabajo electroquímica CST 350 utilizando una configuración de celda de tres electrodos [55]. Se usó una hoja de platino como contraelectrodo, y se usó un electrodo de calomelanos estándar (SCE) como electrodo de referencia. El electrodo de trabajo se preparó como sigue:se mezclaron 15 mg de los fotocatalizadores y 0,75 mg de fluoruro de polivinilideno (PVDF) usando 1-metil-2-pirrolidiona (NMP) como disolvente para formar una suspensión. La suspensión se revistió uniformemente sobre un sustrato de vidrio de óxido de estaño dopado con flúor (FTO) con un área de 1 cm x 1 cm y luego se sometió a secado a 60ºC durante 5 h en un horno de secado con termostato. Na 2 SO 4 solución acuosa con concentración de 0,1 mol L −1 se utilizó como electrolito. La medición del EIS se realizó mediante el uso del pulso de voltaje sinusoidal con amplitud de 5 mV y en el rango de frecuencia de 10 −2 - 10 5 Hz. La respuesta de fotocorriente transitoria se midió a un potencial de polarización de 0,2 V. Durante las mediciones fotoelectroquímicas, el electrodo de trabajo se irradió con una lámpara de xenón de 200 W.
Evaluación fotocatalítica
Se eligió rodamina B (RhB) como contaminante orgánico objetivo para evaluar su comportamiento de degradación sobre las muestras irradiadas por una lámpara de xenón de 200 W (simulador solar). Se disolvió RhB en agua destilada para hacer 5 mg L −1 Solución acuosa de RhB. Se cargaron veinte miligramos del fotocatalizador en 100 ml de solución de RhB. La suspensión mixta se agitó en primer lugar mediante un agitador magnético durante 20 min en la oscuridad y luego se sometió a fotocatálisis. Durante el proceso de fotocatálisis, el reactor se enfrió con un sistema de enfriamiento de agua para mantener la solución de reacción a temperatura ambiente. A intervalos de tiempo dados, se sacó del reactor una pequeña porción de la solución de reacción para examinar la concentración de RhB, que se determinó midiendo la absorbancia de la solución a λ =554 nm en un espectrofotómetro UV-vis. Antes de la medición de la absorbancia, el fotocatalizador se eliminó mediante centrifugación. El porcentaje de degradación de RhB se define como ( C 0 - C t ) / C 0 × 100%, donde C 0 es la concentración inicial de RhB y C t es la concentración de RhB restante después de la fotocatálisis durante el tiempo t .
Detección de hidroxilo
La espectroscopia PL es una técnica importante que se puede utilizar para detectar radicales hidroxilo (• OH) formados sobre el fotocatalizador irradiado por luz solar simulada. En este caso, se utilizó ácido tereftálico (TPA) como eliminador de • OH para examinar los radicales • OH. Solución de NaOH con una concentración de 1.0 mmol L −1 se preparó disolviendo NaOH en agua destilada. Se disolvió una cantidad estequiométrica de TPA en la solución de NaOH anterior para obtener 0,25 mmol de L -1 Solución de TPA. Se cargaron veinte miligramos del fotocatalizador en 100 ml de la solución de TPA. La mezcla se agitó magnéticamente durante 20 min en la oscuridad y luego se irradió con una lámpara de xenón de 200 W. Una pequeña porción de la solución se sacó del reactor después de la reacción durante un cierto período de tiempo y se sometió a centrifugación para eliminar el fotocatalizador. El espectro PL de la solución transparente se midió en un espectrofotómetro de fluorescencia (longitud de onda de excitación 315 nm).
Resultados y discusión
Análisis XRD
La Figura 1 muestra los patrones XRD de Bi 4 Ti 3 O 12 , Ag 3 PO 4 , 5% Bi 4 Ti 3 O 12 / Ag 3 PO 4 , 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 y 15% Bi 4 Ti 3 O 12 / Ag 3 PO 4 muestras. Los patrones de línea XRD estándar para Bi 4 Ti 3 O 12 estructura ortorrómbica (tarjeta JCPDS n. ° 035-0795) y Ag 3 PO 4 La estructura cúbica (tarjeta JCPDS n. ° 006-0505) también se muestra en la Fig. 1. Para Bi 4 Ti 3 O 12 muestra, todos los picos de difracción concuerdan bien con los de la tarjeta JCPDS no. 035-0795, que indica que la muestra cristaliza en un Bi 4 puro Ti 3 O 12 fase ortorrómbica [54]. Para Ag 3 PO 4 muestra, todos los picos de difracción se pueden indexar de acuerdo con las líneas de difracción estándar en la tarjeta JCPDS no. 006-0505, lo que implica la formación de Ag 3 puro PO 4 fase cúbica [31]. Para los compuestos, los patrones de XRD se pueden indexar en dos conjuntos de picos de difracción correspondientes a Bi 4 Ti 3 O 12 y Ag 3 PO 4 etapas. La intensidad máxima de Bi 4 Ti 3 O 12 La fase aumenta con el aumento de su contenido, lo que se ve claramente en el Bi 4 Ti 3 O 12 (171) pico de difracción a 30,1 o . No se detectan picos de difracción asignables a otras fases de impurezas, lo que indica que Bi 4 Ti 3 O 12 y Ag 3 PO 4 no sufrir ningún cambio estructural en los compuestos.
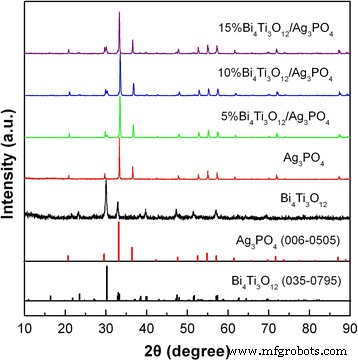
Patrones XRD de Bi 4 Ti 3 O 12 , Ag 3 PO 4 y Bi 4 Ti 3 O 12 / Ag 3 PO 4 compuestos
Análisis SEM
La Figura 2a – c muestra las imágenes SEM de Ag 3 PO 4 , Bi 4 Ti 3 O 12 y 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 muestras, respectivamente. La imagen SEM que se muestra en la Fig. 2a muestra que el Ag 3 PO 4 las partículas tienen una morfología en forma de esfera con un tamaño que varía de 300 a 600 nm. La imagen SEM que se muestra en la Fig. 2b revela que el Bi 4 Ti 3 O 12 las partículas presentan una morfología en forma de esfera o elipsoide y tienen un rango de distribución de tamaño de 60 a 90 nm. En la imagen SEM de la Fig. 2c, se puede ver que Bi 4 de tamaño pequeño Ti 3 O 12 las partículas se ensamblan en la superficie de Ag 3 de gran tamaño PO 4 partículas para formar Bi 4 Ti 3 O 12 / Ag 3 PO 4 heteroestructura, como lo indican las flechas.

Imágenes SEM de a Ag 3 PO 4 , b Bi 4 Ti 3 O 12 y c 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4
Análisis TEM
TEM se utilizó para investigar más a fondo la microestructura de Bi 4 Ti 3 O 12 / Ag 3 PO 4 composicion. La Figura 3a muestra la imagen TEM de 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 . Las partículas de gran tamaño se identifican como Ag 3 PO 4 partículas, que tienen una morfología esférica con un tamaño de varios cientos de nanómetros. Partículas de tamaño mucho más pequeño con un diámetro de varias decenas de nanómetros, que se identifican como Bi 4 Ti 3 O 12 nanopartículas, se ve que se ensamblan en Ag 3 PO 4 partículas, como lo indican las flechas. La observación TEM indica la formación de Bi 4 Ti 3 O 12 / Ag 3 PO 4 heteroestructura, que concuerda con lo observado en la imagen SEM. La Figura 3b muestra la imagen TEM (DF-STEM) de exploración de campo oscuro de Bi 4 al 10% Ti 3 O 12 / Ag 3 PO 4 . Las correspondientes imágenes de mapeo elemental de la región indicada en la Fig. 3b se muestran en la Fig. 3c-g. Se ve que las partículas de gran tamaño presentan la distribución elemental de Ag y P y por lo tanto se confirma que son Ag 3 PO 4 partículas. Las partículas de pequeño tamaño ancladas en Ag 3 PO 4 las partículas muestran la distribución elemental de Bi y Ti, lo que confirma que son Bi 4 Ti 3 O 12 partículas. Las imágenes de mapeo elemental revelan aún más la integración de Bi 4 Ti 3 O 12 con Ag 3 PO 4 para formar Bi 4 Ti 3 O 12 / Ag 3 PO 4 heteroestructura. Además, los elementos Ag y P, así como Bi y Ti, tienen una distribución idéntica, lo que implica que no hay segregación de composición química en el Ag 3 PO 4 y Bi 4 Ti 3 O 12 etapas. La distribución del elemento O se observa a través de todos los compuestos. La espectroscopia de rayos X de dispersión de energía (EDS) se utilizó además para analizar la composición química de Bi 4 al 10% Ti 3 O 12 / Ag 3 PO 4 . Como se muestra en la Fig. 3h, las señales de los elementos constituyentes del compuesto están claramente incluidas en el espectro. Las señales de C y Cu observadas podrían derivar de la microrred que se utiliza para soportar la muestra. Cabe señalar que el EDS se utiliza adecuadamente para la determinación cuantitativa del contenido de elementos pesados (por ejemplo, Bi, Ti y Ag), pero no elementos ligeros (por ejemplo, P y O) [56]. La relación atómica de Bi a Ti se obtiene como 4/3 del espectro EDS, que concuerda bien con la relación atómica Bi / Ti de Bi 4 Ti 3 O 12 fase. La relación atómica de Ti / Ag está muy cerca de 1/9, lo que implica que Bi 4 Ti 3 O 12 La fase representa aproximadamente el 10% del contenido molar total del compuesto.
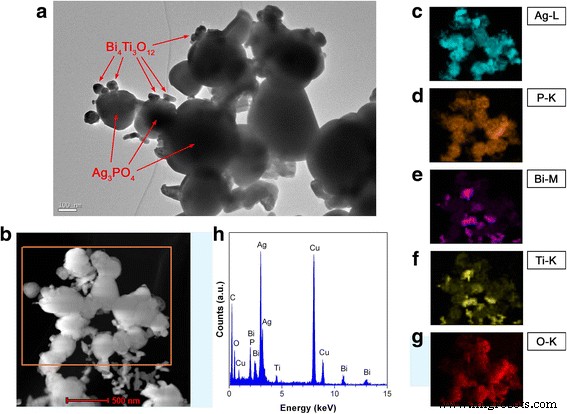
un Imagen TEM de 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 . b Imagen DF-STEM de 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 . c - g Las imágenes de mapeo elemental correspondientes de la región indicada en b . h Espectro EDS de 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4
Análisis de superficie BET
La Figura 4 muestra el N 2 isoterma de adsorción-desorción de 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 . Este tipo de isoterma es muy similar a la isoterma de adsorción de tipo II según la clasificación IUPAC. La curva de desorción coincide casi con la curva de adsorción sin un bucle de histéresis obvio, lo que implica la ausencia de mesoporos en el compuesto. El inserto de la Fig. 4 muestra el gráfico de área de superficie de Brunauer-Emmett-Teller (BET) del material compuesto, a partir del cual se calcula que el área de superficie BET es de 2,08 m 2 g −1 .
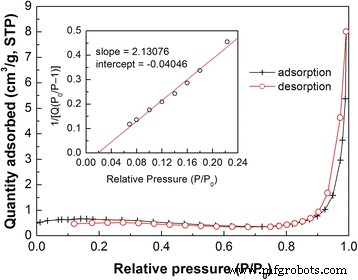
N 2 isoterma de adsorción-desorción y gráfico de área de superficie BET de 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4
Análisis XPS
La composición química y el estado de oxidación elemental de Ag 3 PO 4 , Bi 4 Ti 3 O 12 y 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 también fueron investigados por XPS. La Figura 5a muestra los espectros de exploración de la encuesta XPS de las muestras, revelando que las muestras incluyen claramente sus propios elementos constituyentes y no se encuentran otros elementos de impureza. La Figura 5b muestra los espectros XPS de O 1s de las muestras. Para Bi 4 desnudo Ti 3 O 12 , la señal XPS de O 1s se puede ajustar en tres picos a 529,6, 531,6 y 533,4 eV. La energía de enlace a 529,6 eV se atribuye a la contribución del oxígeno de la red cristalina. Los picos a energías de enlace más altas de 531,6 y 533,4 eV podrían surgir debido a defectos superficiales y especies de oxígeno quimisorbidas [55]. Para Ag 3 desnudo PO 4 , el espectro de O 1s XPS se deconvoluciona en dos picos a 530,8 y 532,6 eV, que se atribuyen al oxígeno de la red cristalina y al oxígeno adsorbido en la superficie, respectivamente. Por 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 , la energía de enlace de O 1 del oxígeno de la red cristalina en Bi 4 Ti 3 O 12 y Ag 3 PO 4 se observa en 529,5 y 530,6 eV, respectivamente. Se observa un ligero cambio descendente de los picos de energía de enlace de O 1s en el compuesto, lo que implica la posible unión química entre Bi 4 Ti 3 O 12 y Ag 3 PO 4 . La Figura 5c, d muestra los espectros XPS de Ag 3d y P 2p, respectivamente. Los picos a 368.0 y 374.0 eV pertenecen a las energías de enlace para Ag 3d 5/2 y Ag 3d 3/2 , respectivamente, lo que sugiere la presencia de Ag + estado de oxidación. La presencia de Ag 0 El estado del metal en las muestras puede excluirse porque no son visibles picos adicionales en los espectros de Ag 3d XPS [37]. La observación de la energía de enlace de P 2p a 133,2 eV es indicativa de la presencia de P 5+ estado de oxidación [37]. Las señales Ag 3d y P 2p XPS no sufren cambios en la composición. La Figura 5e, f muestra los espectros XPS de Bi 4f y Ti 2p, respectivamente. Para Bi 4 desnudo Ti 3 O 12 , el espectro de Bi 4f presenta dos picos agudos a 159,0 y 164,3 eV, que corresponden a las energías de enlace de Bi 4f 7/2 y Bi 4f 5/2 , respectivamente [52]. Esto implica que Bi existe en el estado de oxidación + 3. En el espectro de Ti 2p, los picos a 458,0 y 465,8 eV se asignan a las energías de enlace para Ti 2p 3/2 y Ti 2p 1/2 , respectivamente, lo que indica que Ti tiene la forma de Ti 4+ estado de oxidación [52]. Para el compuesto, los picos de Bi 4f y Ti 2p exhiben un ligero cambio hacia energías de enlace más altas, lo que podría surgir debido al enlace químico entre Bi 4 Ti 3 O 12 y Ag 3 PO 4 .
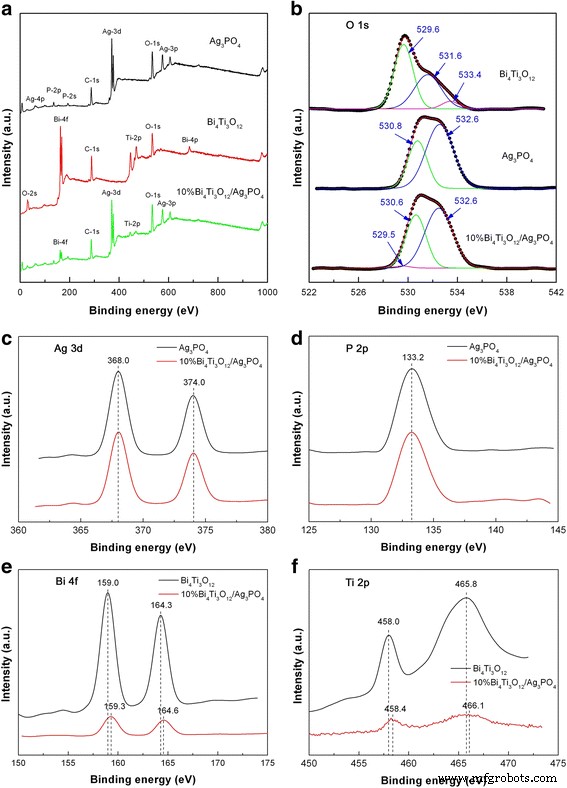
Espectros XPS de Bi 4 Ti 3 O 12 , Ag 3 PO 4 y 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 . un Espectros de exploración de levantamientos XPS. b Espectros XPS de O 1s. c Espectros Ag 3d XPS. d Espectros P 2p XPS. e Espectros Bi 4f XPS. f Espectros Ti 2p XPS
Espectros DRS UV-vis
La Figura 6a muestra los espectros DRS UV-vis de Bi 4 Ti 3 O 12 , Ag 3 PO 4 y Bi 4 Ti 3 O 12 / Ag 3 PO 4 compuestos, y la Fig. 6b da la primera derivada correspondiente de los espectros. El borde de absorción de las muestras se puede derivar de los picos en los espectros de la primera derivada. Se ve que Bi 4 Ti 3 O 12 tiene un borde de absorción a 376,9 nm y Ag 3 PO 4 tiene un borde de absorción a 498,5 nm. Los bordes de absorción surgen debido a la transición de electrones de la banda de valencia a la banda de conducción de los semiconductores, a partir de la cual las energías de banda prohibida ( E g ) de Bi 4 Ti 3 O 12 y Ag 3 PO 4 se obtienen 3,29 y 2,49 eV, respectivamente. Para los composites, los bordes de absorción de Bi 4 Ti 3 O 12 y Ag 3 PO 4 exhiben un ligero cambio hacia la longitud de onda corta, que podría deberse a su efecto mutuo de absorción de luz entre sí. Las energías de banda prohibida de Bi 4 Ti 3 O 12 y Ag 3 PO 4 se espera que sufran un cambio insignificante en los compuestos.
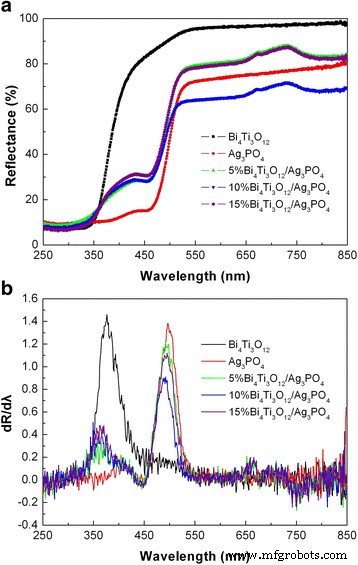
un Espectros UV-vis DRS de Bi 4 Ti 3 O 12 , Ag 3 PO 4 y Bi 4 Ti 3 O 12 / Ag 3 PO 4 composicion. b Los correspondientes espectros de la primera derivada
Espectros PL
La espectroscopia PL se utiliza para evaluar el comportamiento de recombinación de pares de electrones-huecos fotogenerados en los fotocatalizadores. La intensidad de PL es proporcional a la tasa de recombinación de electrones y huecos fotogenerados. La Figura 7 muestra los espectros PL de Ag 3 PO 4 y 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 medido a una longitud de onda de excitación de 315 nm. Para Ag 3 PO 4 partículas, se observan tres picos de emisión de PL a alrededor de 430, 490 y 525 nm. Por el contrario, la intensidad de la emisión de PL alcanza un máximo del 10% de Bi 4 Ti 3 O 12 / Ag 3 PO 4 compuesto está claramente disminuido, lo que implica una disminución en la recombinación de los huecos de electrones. La separación eficiente de pares de electrones y huecos se atribuye a la transferencia de carga entre Bi 4 Ti 3 O 12 y Ag 3 PO 4 . Como resultado, los electrones fotogenerados y los huecos en Bi 4 Ti 3 O 12 / Ag 3 PO 4 los compuestos están cada vez más disponibles para las reacciones fotocatalíticas.
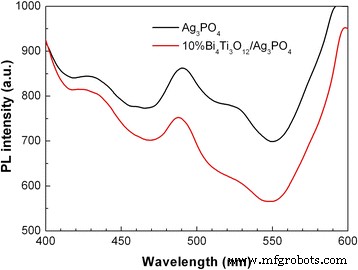
Espectros PL de Ag 3 PO 4 y 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4
Propiedades fotoelectroquímicas
La EIS y la respuesta de fotocorriente también se pueden utilizar para investigar el comportamiento de separación y transferencia de electrones fotogenerados y huecos en los fotocatalizadores. La Figura 8a muestra los gráficos de Nyquist de los espectros EIS para Ag 3 PO 4 y 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 electrodos, que presentan un semicírculo típico. El diámetro del semicírculo está relacionado con la resistencia de transferencia de carga en la interfaz electrodo / electrolito. Es obvio que la gráfica de Nyquist de 10% Bi 4 Ti 3 O 12 / Ag 3 PO 4 muestra un diámetro de semicírculo mucho más pequeño que el de Ag 3 desnudo PO 4 , lo que indica que el material compuesto tiene una resistencia de transferencia de carga relativamente menor bajo la irradiación solar simulada. La observación de una menor resistencia de transferencia de carga implica una mayor eficiencia de separación de pares de electrones-huecos fotogenerados y una rápida transferencia de carga de interfaz que se produce en el 10% de Bi 4 Ti 3 O 12 / Ag 3 PO 4 compuesto. Figure 8b shows the transient photocurrent responses of Ag3 PO 4 and 10%Bi4 Ti3 O12 /Ag3 PO 4 recorded for several switch-on and switch-off cycles under intermittent irradiation of simulated sunlight. It is seen that the transient photocurrent responses are highly reproducible when the light is repeatedly switched between on and off. During the irradiation period, the photocurrent density of 10% Bi4 Ti3 O12 /Ag3 PO 4 is obtained as ~ 24 μA cm −2 , which is much higher than that of bare Ag3 PO 4 (~ 4 μA cm −2 ), indicating a more efficient separation of photogenerated electron-hole pairs in the composite due to the carrier transfer between Bi4 Ti3 O12 and Ag3 PO 4 .
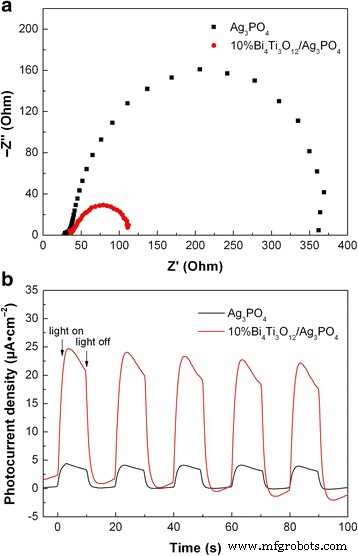
un Nyquist plots of the EIS spectra for Ag3 PO 4 and 10% Bi4 Ti3 O12 /Ag3 PO 4 . b Transient photocurrent responses of Ag3 PO 4 and 10% Bi4 Ti3 O12 /Ag3 PO 4
Photocatalytic performances
Figure 9a shows the time-dependent photocatalytic degradation of RhB over Bi4 Ti3 O12 , Ag3 PO 4 , and Bi4 Ti3 O12 /Ag3 PO 4 composites under simulated sunlight irradiation, along with the blank experiment result. Without loading the photocatalyst, RhB exhibits a good stability under simulated sunlight irradiation and its percentage degradation is only about 1.7% after 30 min of irradiation. When Ag3 PO 4 is used as the photocatalyst, RhB undergoes a substantial degradation with increasing the irradiation time, while a relatively weak degradation of the dye is observed for Bi4 Ti3 O12 . More importantly, when Ag3 PO 4 is integrated with Bi4 Ti3 O12 , the formed Bi4 Ti3 O12 /Ag3 PO 4 heterojunction composites exhibit significantly enhanced photocatalytic activity compared to bare Ag3 PO 4 or Bi4 Ti3 O12 . The highest photocatalytic activity is observed for 10% Bi4 Ti3 O12 /Ag3 PO 4 , where the percentage degradation of RhB after 30 min of photocatalysis reaches 99.5%, as shown in Fig. 9c. To further reveal the photocatalytic activity of the samples, the photocatalytic degradation kinetics of RhB is investigated. Figure 9b shows the plots of Ln(C t / C 0 ) versus irradiation time (t ) for the samples. It is seen that the dye degradation conforms well to the first-order kinetic equation Ln(C t / C 0 ) = − k aplicación t , donde k aplicación is the apparent first-order reaction rate constant (min −1 ) [57]. The obtained rate constants for the samples are shown in Fig. 9d. The rate constant k aplicación for 10% Bi4 Ti3 O12 /Ag3 PO 4 is obtained as 0.17891 min −1 , compared to 0.06764 min −1 for Ag3 PO 4 . This implies that the photocatalytic activity of 10% Bi4 Ti3 O12 /Ag3 PO 4 is about 2.6 times higher than that of bare Ag3 PO 4 .
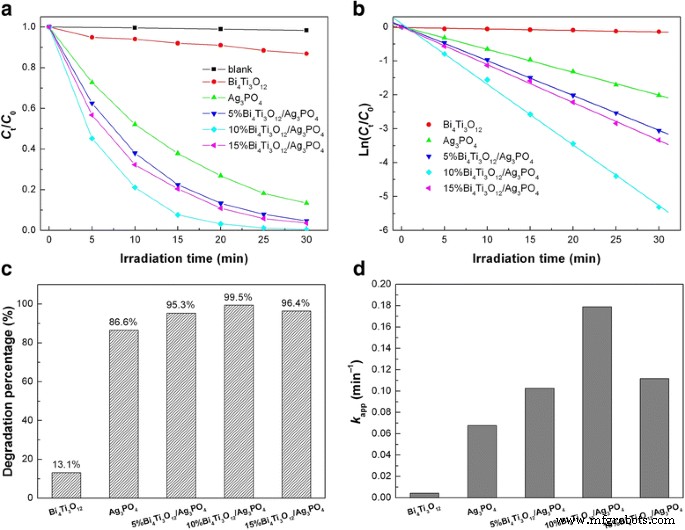
un Time-dependent photocatalytic degradation of RhB over Bi4 Ti3 O12 , Ag3 PO 4 , and Bi4 Ti3 O12 /Ag3 PO 4 composicion. b Plots of Ln(C t / C 0 ) versus irradiation time t for the samples. c Degradation percentages of RhB after 30 min of photocatalysis over the samples. d Apparent first-order reaction rate constants k aplicación for the samples
In most of the photocatalytic systems, the dominant active species responsible for the dye degradation include •OH, superoxide (•O2 - ), and h + [58]. It is known that •OH, •O2 - , and h + can be scavenged by ethanol, benzoquinone (BQ), and ammonium oxalate (AO), respectively [56]. Therefore, the role of the active species in the photocatalysis can be verified by investigating the effect of ethanol, BQ, and AO on the photocatalytic degradation of the dye. Five milligrams of ethanol, 0.0011 g of BQ, and 0.0142 g of AO are separately added in 100 mL reaction solution, and then, the photocatalytic experiments are carried out under the same conditions. Figure 10a shows the effect of the scavengers on the degradation of RhB over 10% Bi4 Ti3 O12 /Ag3 PO 4 . The degradation percentages of RhB after 30 min of photocatalysis and the rate constants are shown in Fig. 10b. It is found that the addition of ethanol to the reaction solution has a negligible effect on the degradation of RhB, implying that •OH plays little or no role in the dye degradation. However, the addition of BQ or AO leads to an obvious suppression on the dye degradation. Particularly, only 17.9% of RhB is observed to be degraded with the addition of AO. This suggests that h + and •O2 - are the dominant and secondary reactive species causing the dye degradation, respectively.
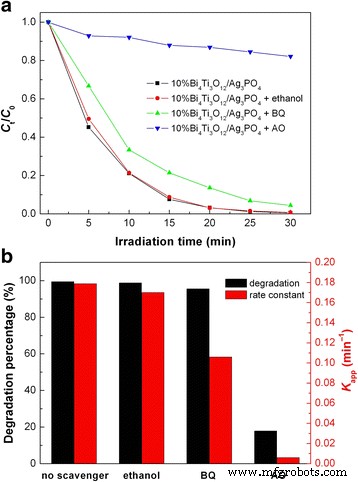
Effect of ethanol, BQ, and AO on the RhB degradation over 10% Bi4 Ti3 O12 /Ag3 PO 4 . un Time-dependent photocatalytic degradation of RhB. b Degradation percentages of RhB after 30 min of photocatalysis and first-order reaction rate constants k aplicación
Information of •OH radicals
We further examine whether there are •OH radicals formed over the simulated sunlight-irradiated 10% Bi4 Ti3 O12 /Ag3 PO 4 by PL spectroscopy using TPA as the scavenger of •OH. It is known that TPA will react with •OH to produce 2-hydroxyterephthalic acid (TAOH) that can emit photoluminescence having a wavelength of 429 nm [59]. The PL emission intensity is proportional to the amount of •OH radicals. Figure 11 shows the PL spectra of the TPA solution after reaction for 30 min over 10% Bi4 Ti3 O12 /Ag3 PO 4 and P25. It is well established that •OH is easily generated over the irradiated P25 (a mixed-phase TiO2 photocatalyst) in water solution. As a result, the TPA reaction solution shows a strong PL signal at 429 nm when P25 is used as the photocatalyst. However, when 10% Bi4 Ti3 O12 /Ag3 PO 4 is used as the photocatalyst, the TPA reaction solution is very similar to the blank TPA solution, showing no obvious PL signal at 429 nm. This indicates that no •OH radicals are produced in the 10% Bi4 Ti3 O12 /Ag3 PO 4 photocatalytic system.
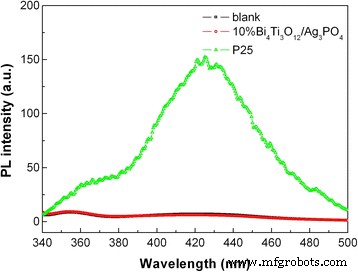
PL spectra of the TPA solution reacted for 30 min over 10% Bi4 Ti3 O12 /Ag3 PO 4 and P25
Discussion of photocatalytic mechanism
The CB and VB edge potentials of Bi4 Ti3 O12 and Ag3 PO 4 are determined according the method described in the literature [60], as schematically shown in Fig. 12a. It is seen that the CB potential of Bi4 Ti3 O12 is negative to that of Ag3 PO 4 , and moreover, Bi4 Ti3 O12 is intrinsically an n-type semiconductor and Ag3 PO 4 behaves as a p-type semiconductor. This indicates that when the two semiconductors are integrated to form p-n heterojunction, electrons will migrate from Bi4 Ti3 O12 to Ag3 PO 4 , leaving behind positive charge centers at the interface of Bi4 Ti3 O12 and negative charge centers at the interface of Ag3 PO 4 . Simultaneously, an internal electric field is created at the interface region of the Bi4 Ti3 O12 /Ag3 PO 4 heterojunction, as shown in Fig. 12b. The direction of the internal electric field is from Bi4 Ti3 O12 to Ag3 PO 4 . Under the action of the internal electric field, photogenerated electrons will migrate from Ag3 PO 4 to Bi4 Ti3 O12 and conversely the photogenerated holes will migrate from Bi4 Ti3 O12 to Ag3 PO 4 . Due to the carrier transfer process, the recombination of electron-hole pairs can be effectively inhibited. As a result, more photogenerated holes and electrons are able to participate in the photocatalytic reactions, thus leading to an increased photocatalytic performance of the Bi4 Ti3 O12 /Ag3 PO 4 heterojunction composites. It is noted that the photocatalytic performance of the composite photocatalysts is highly associated with the number of formed heterostructures. Generally, a proper proportion between two semiconductors is required for the creation of a large number of heterostructures in the composites. In the Bi4 Ti3 O12 /Ag3 PO 4 composites, the optimum content of Bi4 Ti3 O12 is about 10%, and at this Bi4 Ti3 O12 content, the formed composite (i.e., 10%Bi4 Ti3 O12 /Ag3 PO 4 ) exhibits the highest photocatalytic activity.
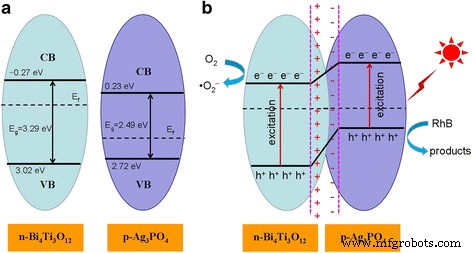
Schematic illustration of the energy band structures for a separate Bi4 Ti3 O12 and Ag3 PO 4 y b Bi4 Ti3 O12 /Ag3 PO 4 heterojunction
Conclusions
Bi4 Ti3 O12 /Ag3 PO 4 heterojunction composites were prepared by an ion-exchange method. Compared to bare Bi4 Ti3 O12 and Ag3 PO 4 particles, the as-prepared Bi4 Ti3 O12 /Ag3 PO 4 composites exhibit an enhanced photocatalytic activity toward the degradation of RhB under simulated sunlight irradiation. The highest photocatalytic activity is observed for the composite with Bi4 Ti3 O12 fraction of 10%, which is about 2.6 times higher than that of bare Ag3 PO 4 . The enhanced photocatalytic activity of the composites can be explained by the efficient separation of photogenerated electron-hole pairs due to the migration of the carriers between Bi4 Ti3 O12 and Ag3 PO 4 . As a result, more photogenerated holes and electrons are available for participation in the photocatalytic reactions. The reactive species are determined by investigating the effect of ethanol, BQ and AO on the RhB degradation, and it is concluded that h + is the dominant reactive species and •O2 - is the secondary reactive species in the present Bi4 Ti3 O12 /Ag3 PO 4 photocatalytic system.
Abreviaturas
- BET:
-
Brunauer-Emmett-Teller
- CB:
-
Conduction band
- EIS:
-
Electrochemical impedance spectroscopy
- FTO:
-
Fluorine-doped tin oxide
- NMP:
-
1-Methyl-2-pyrrolidione
- PL:
-
Photoluminescence
- PVDF:
-
Polyvinylidene fluoride
- RhB:
-
Rhodamine B
- SCE:
-
Standard calomel electrode
- SEM:
-
Microscopía electrónica de barrido
- TEM:
-
Microscopía electrónica de transmisión
- TPA:
-
Terephthalic acid
- UV-vis DRS:
-
Ultraviolet-visible diffuse reflectance spectroscopy
- VB:
-
Valence band
- XPS:
-
X-ray photoelectron spectroscopy
- XRD:
-
X-ray powder diffraction
Nanomateriales
- Oxinitruro de boro y carbono como nuevo fotocatalizador sin metales
- Compuesto mecánico de LiNi0.8Co0.15Al0.05O2 / Nanotubos de carbono con rendimiento electroquímico mejorado para baterías de iones de litio
- Actividades fotocatalíticas mejoradas por nanopartículas au-plasmónicas en un fotoelectrodo de nanotubos de TiO2 recubierto con MoO3
- Rendimiento fotocatalítico de luz visible de nanocompuestos de ZnO / g-C3N4 dopado con N
- Preparación y rendimiento fotocatalítico de fotocatalizadores LiNb3O8 de estructura hueca
- Rendimiento mejorado de un nuevo catalizador anódico de PdAu / VGCNF para la electrooxidación en una pila de combustible de glicerol
- Efectos sinérgicos de nanopartículas de Ag / BiV1-xMoxO4 con actividad fotocatalítica mejorada
- Fabricación y propiedad fotocatalítica de nuevos nanocompuestos SrTiO3 / Bi5O7I
- Propiedades fotovoltaicas mejoradas en la celda solar de heterounión plana Sb2S3 con un enfoque de selección rápida
- Síntesis fácil y actividad fotocatalítica de luz visible mejorada de nuevos compuestos de heterounión p-Ag3PO4 / n-BiFeO3 para la degradación del tinte
- Rendimiento fotovoltaico de células solares de matriz de nanoconos de unión de clavijas con absorción óptica eficaz mejorada



