Entrega novedosa de mitoxantrona con nanopartículas de pululano modificadas hidrofóbicamente para inhibir las células cancerosas de la vejiga y el efecto del tamaño de los nanofármacos en la eficacia de la inhibición
Resumen
Reducir la dosis de fármacos quimioterapéuticos mediante la mejora de la eficacia de la administración mediante el uso de nuevas nanopartículas tiene un gran potencial para el tratamiento del cáncer. Aquí, nos enfocamos en mejorar la entrega de mitoxantrona mediante el uso de polímeros de pululano sustituidos con colesterol (CHP) y seleccionamos un tamaño de nanofármaco adecuado para inhibir el crecimiento de células cancerosas de vejiga. Sintetizamos tres tipos de CHP, denominados CHP-1, CHP-2, CHP-3. Sus estructuras químicas se identificaron por RMN y el grado de sustitución del colesterol fue del 6,82%, 5,78% y 2,74%, respectivamente. Sus diámetros fueron 86,4, 162,30 y 222,28 nm. Probamos la tasa de liberación de mitoxantrona en solución salina tamponada con fosfato durante 48 h:la tasa de liberación fue 38,73%, 42,35% y 58,89% para los tres CHP. El grado de sustitución hidrófoba en el polímero se asoció con el proceso de autoensamblaje de las nanopartículas, lo que afectó su tamaño y, por lo tanto, la velocidad de liberación del fármaco. La liberación de las tres nanopartículas cargadas con fármaco se aceleró significativamente en medios de liberación de ácido. Cuanto más grande es la nanopartícula, mayor es la velocidad de liberación del fármaco. A las 24 h, el IC 50 El valor fue de 0,25 M, para la mejor inhibición de mitoxantrona en las células cancerosas de la vejiga.
Los experimentos con bromuro de 3- (4,5-dimetil-2-tiazolil) -2,5-difenil-2-H-tetrazolio (MTT) demostraron que las nanopartículas de CHP-3 cargadas con fármaco con el tamaño más grande eran las más tóxicas para el cáncer de vejiga células. La inmunofluorescencia y la citometría de flujo revelaron que las nanopartículas de CHP-3 cargadas con fármaco con el tamaño más grande tenían el efecto más fuerte en la promoción de la apoptosis de las células cancerosas de vejiga. Además, las tres nanopartículas cargadas con fármaco podrían inhibir la migración de las células MB49, y las nanopartículas de CHP-3 de gran tamaño tienen la inhibición más poderosa.
Antecedentes
La quimioterapia es un tratamiento común para los tumores. Sin embargo, debido a la falta de especificidad del tejido, el efecto terapéutico de la quimioterapia es limitado y, a menudo, tiene fuertes efectos secundarios [1, 2]. Por lo tanto, ha aumentado la investigación sobre el uso de preparaciones de nanopartículas (NP) para aumentar la capacidad diana de los fármacos quimioterapéuticos [3, 4, 5].
Después de apuntar pasivamente a los tejidos tumorales a través del efecto de permeabilidad y retención mejoradas (EPR), los nanofármacos, como los fármacos antitumorales de molécula pequeña cargados con NP, ejercen principalmente su eficacia de dos maneras:(1) al ser liberados en los tejidos tumorales y entrar células en forma libre para ejercer eficacia y (2) al ser absorbidas por las células en forma de micropartículas y liberadas en la célula para ejercer efectos farmacodinámicos [6, 7]. Cuando un agente nanofarmacéutico se dirige pasivamente a un tumor, cuál de los dos métodos juega un papel importante o si ambos juegan un papel importante al mismo tiempo y si hay otros factores involucrados es un tema complejo. Debido a la actividad metabólica de los tejidos tumorales, la isquemia y la hipoxia y la acumulación de ácido láctico y debido a que el líquido extracelular de los tejidos tumorales muestra una acidez débil, muchos nanofármacos muestran una mayor liberación en ambientes ácidos, para una mayor eficacia [8]. La eficacia de liberación de fármacos de los nanofármacos en un entorno ácido está estrechamente relacionada con las propiedades fisicoquímicas de los nanomateriales y también se ve afectada por el tamaño de las NP [9,10,11]. Después de que las NP se dirigen pasivamente al tejido tumoral, debido a que las células tumorales tienen una función de fagocitosis, la preparación nanofarmacéutica ingresa a las células principalmente a través de pinocitosis y procesos complejos mediados por las proteínas de la membrana celular [12, 13]. Bajo la degradación de las lisozimas intracelulares, los nanofármacos liberan fármacos y ejercen eficacia [14].
La eficiencia de absorción de las células diana en el tejido diana está estrechamente relacionada con las propiedades de los nanomateriales, la modificación de la superficie, la morfología, la carga y el tamaño de NP [15,16,17,18]. La captación celular depende en gran medida del tamaño de NP. La internalización (endocitosis) de las NP de Her-gold depende en gran medida del tamaño, y la absorción más eficaz se produce en las NP en el rango de 25 a 50 nm [19]. Los NP extremadamente pequeños o grandes tendrán una absorción ineficaz. El tamaño de 40 a 50 nm es el punto crítico para la endocitosis mediada por receptores [20]. Además, el tamaño de NP afecta la citotoxicidad. Al comparar NP de 45 y 90 nm, el tamaño de las NP de polímero está inversamente relacionado con la citotoxicidad [21]. El tamaño de las NP afecta la liberación del fármaco en el tejido tumoral y también la eficiencia de absorción de las células y, en última instancia, juega un papel importante en la eficacia del fármaco.
La adhesión local de polisacáridos mejora la función de localización y focalización. El ambiente ácido de las células cancerosas externas conduce a una liberación parcial de nanofármacos polisacáridos, lo que desencadena el doble efecto terapéutico de los NP cargados con el fármaco y los fármacos libres después de la selección pasiva de los tejidos tumorales [22, 23].
El pululano, que no es tóxico, se degrada fácilmente en el organismo y su colesterol es una sustancia intrínseca del organismo, por lo que es seguro y adecuado como portador de fármacos [24, 25]. Los polímeros de pululano (CHP) modificados hidrofóbicamente con colesterilo, que tienen grupos colesterilo hidrofóbicos y cadenas de azúcar hidrofílicas, pueden autoensamblarse en estructuras tipo nanoesferas con núcleos centrales hidrofóbicos y conchas hidrofílicas [26, 27]. Los polímeros anfifílicos se autoensamblan en NP en estructuras esferoides, con el núcleo hidrófobo formado por grupos hidrófobos como los grupos colesterilo [28].
La mitoxantrona, un antibiótico antraciclina activo contra el cáncer de amplio espectro que puede intercalar el ADN e inhibir la topoisomerasa II, es un fármaco antitumoral clásico. Sin embargo, debido a su cardiotoxicidad, el uso de mitoxantrona es limitado. La mitoxantrona se carga en el centro hidrófobo de las NP de CHP mediante interacción hidrófoba para formar preparaciones nanométricas de CHP que tienen un efecto de direccionamiento pasivo a través del efecto EPR. En comparación con los fármacos libres, los NP de CHP cargados con fármaco muestran efectos tóxicos reducidos de los fármacos y una mayor eficacia contra el cáncer [29, 30]. El grupo hidrofóbico colesterilo en el polímero CHP impulsa la formación de la estructura del núcleo del NP, y dentro de un cierto rango, cuanto mayor es el grado de sustitución del grupo hidrofóbico, menor es el tamaño del NP [31, 32]. La estabilidad de los CHP fue superior al menos 2 meses sin cambios significativos de tamaño y potencial zeta, y las nanopartículas de pululano pueden dirigirse al tejido tumoral para matar las células cancerosas mediante el efecto EPR [33, 34].
En este estudio, utilizamos NP de pululano (CHP) modificadas hidrofóbicamente con colesterol como portadores de fármacos antitumorales para cargar mitoxantrona. Se generaron diferentes tamaños de NP de pululano cargadas con mitoxantrona sintetizando polímeros de CHP en diferentes proporciones de carga de éster de colesterol de anhídrido succínico (CHS) para estudiar el efecto del tamaño de NP en la liberación sostenida de un fármaco, liberación de fármaco en un entorno ácido, toxicidad para el cáncer de vejiga células, eficiencia de absorción celular y migración celular. Este experimento evaluó el rango de tamaño de los NP con orientación pasiva para seleccionar un NP adecuado como portador de fármacos y para una mayor eficacia del fármaco.
Materiales y métodos
Reactivos e instrumentos
La mitoxantrona era de Aladdin Chemistry (Shanghai); la bolsa de diálisis (BioSharp, EE. UU., 8000 ~ 12000 Da) era de Tianjin Junyao Biotechnology. Otros reactivos eran de Beijing Xinze Technology.
Utilizamos el espectrofotómetro de fluorescencia Japan F-4500, el cromatógrafo de dicroísmo circular J-810 (Jasco Co., Japón), el analizador de tamaño de partículas (MALVERN, Nano 2S-90, Japón) y un microscopio electrónico de proyección (JEM-100CXII, Japón) .
Síntesis y caracterización del polímero CHP y cálculo del grado de sustitución del colesterol
La síntesis de CHS anhídrido succínico se informó anteriormente [35]. Se disolvió una cantidad de 0,5 g de muestra de pululano en 15 ml de dimetilsulfóxido deshidratado como reserva. CHS (unidad de azúcar / CHS =0,20, 0,15, 0,05 mmol / mmol), 4-dimetilpiridina (DMAP ∕ CHS =1 mmol / mmol) y clorhidrato de 1- (3-dimetilaminopropil) -3-etilcarbodiimida (EDC ∕ CHS =1,2 mmol / mmol) se disolvieron por separado en 10 ml de DMSO, se agitaron a temperatura ambiente y se activaron durante 1 h; la reacción de activación se vertió en la solución de pululano; y la reacción se detuvo después de 48 h. La reacción se vertió en 200 ml de etanol absoluto y luego se formó un precipitado blanco. Se filtró por succión y el producto se lavó con cantidades apropiadas de etanol, tetrahidrofurano y éter dietílico y luego se secó a 80ºC. Se obtuvieron tres tipos de polímeros de CHP con diferentes grados de sustitución del colesterol:CHP-1, CHP-2 y CHP-3 [36]. Se disolvieron 10-20 mg de polisacárido de pululano y polímero de CHP con DMSO-d6 en condiciones ultrasónicas, y 1 Se examinaron los espectros de H RMN. El grado de sustitución del colesterol en el polímero de CHP se determinó sobre la base de los enlaces glicosídicos α-1,4 y α-1,6 y el área debajo del pico de metileno.
Preparación y caracterización de NP de CHP cargadas con fármacos
Síntesis de NP de CHP cargadas con mitoxantrona como se describe [37, 38], las NP cargadas de fármaco se obtuvieron mediante diálisis con 40 mg de cada una de las tres NP de CHP sustituidas con varios grados de colesterol y 4 mg de mitoxantrona como respaldo. Las NP cargadas con fármaco recién preparadas o las NP cargadas con fármaco dispersas en agua destilada después de la liofilización se gotearon sobre una rejilla de cobre con una película de soporte de carbón y se drenó el papel de filtro. Las rejillas se colocaron en un desecador, luego al 2% ( w / w ) se añadió ácido fosfotúngstico (2%), que resultó negativo después del secado natural, y se observó mediante microscopía electrónica de transmisión (TEM) [38]. La solución de NP cargadas con fármaco recién preparadas o NP cargadas con fármaco dispersas en agua destilada después de la liofilización se vertió en cubetas y se colocó en un analizador de tamaño de partícula para su detección. Cada muestra se procesó tres veces para obtener un tamaño uniforme y un potencial uniforme de NP.
Medición de la carga de fármaco y la eficacia de encapsulación de NP de CHP cargadas de fármaco
El contenido de carga de fármaco (LC%) y la eficiencia de encapsulación (EE%) de las NP de CHP cargadas con mitoxantrona se midieron como se describe [31, 39] de la siguiente manera:
$$ \ mathrm {EE} =\ frac {\ mathrm {La} \ \ mathrm {cantidad} \ \ mathrm {de} \ \ mathrm {droga} \ \ mathrm {en} \ \ mathrm {la} \ \ mathrm { NPs}} {\ mathrm {Total} \ \ mathrm {cantidad} \ \ mathrm {de} \ \ mathrm {Medicamento}} $$ $$ \ mathrm {LC} =\ frac {\ mathrm {El} \ \ mathrm { cantidad} \ \ mathrm {de} \ \ mathrm {Droga} \ \ mathrm {en} \ \ mathrm {el} \ \ mathrm {NPs}} {\ mathrm {El} \ \ mathrm {cantidad} \ \ mathrm {de } \ \ mathrm {NPs} \ \ mathrm {peso}} $$Estudio de liberación de fármacos
Los tres tipos de NP cargadas de mitoxantrona se colocaron en solución salina tamponada con fosfato (PBS) y en medios de liberación de pH =6,8 y 4,0. La liberación de mitoxantrona se estudió in vitro mediante diálisis y el porcentaje de liberación acumulada (Q%) se calculó como se describe [40].
Líneas celulares y condiciones de cultivo
La línea celular MB49 de cáncer de vejiga murina proporcionada por el Dr. P Guo (Instituto de Urología, Universidad de Xi'an Jiaotong, Xi'an, Shaanxi, China) se cultivó en DMEM (Lonza) complementado con suero bovino fetal al 10% (Hyclone, Logan , UT, EE. UU.) Y penicilina-estreptomicina al 1% a 37 ° C en aire humidificado que contiene 5% de CO 2 .
Ensayo de viabilidad celular
La viabilidad celular se evaluó mediante un ensayo basado en tetrazolio. Brevemente, las células se sembraron a 2 × 10 4 por pocillo en placas de cultivo de 96 pocillos y se dejaron adherir durante 24 h. Se optimizaron diferentes densidades de siembra al comienzo de los experimentos. Las células se trataron con diferentes concentraciones de mitoxantrona durante 24 h en una incubadora. Se disolvió mitoxantrona a 0,0078, 0,0156, 0,03125, 0,0625, 0,125, 0,25, 0,5 y 1 µM en DMEM complementado con suero bovino fetal al 1%. Se añadió a cada pocillo una cantidad de 50 μL de sal de tetrazolio MTT (Sigma) disuelta en solución equilibrada de Hank a 2 mg / mL con el tratamiento indicado y se incubó en un CO 2 incubadora durante 5 h. Finalmente, se aspiró el medio de cada pocillo y se agregaron 150 μL de DMSO (Sigma) para disolver los cristales de formazán. La absorbancia de cada pocillo se obtuvo utilizando un lector de placas Dynatech MR5000 a una longitud de onda de prueba de 490 nm y una longitud de onda de referencia de 630 nm.
IC 50 los valores de mitoxantrona se determinaron mediante curvas de dosis-respuesta. Las tres concentraciones de NP (0,0625, 0,125, 0,25 µM) con tres grados de sustitución se compararon mediante MTT. El procedimiento experimental fue el mismo que para la mitoxantrona.
Evaluación de la apoptosis
La tasa de apoptosis celular se determinó mediante citometría de flujo con anexina V-FITC / yoduro de propidio (PI). Brevemente, las células tratadas se lavaron dos veces con PBS frío, luego se resuspendieron en tampón de unión a 2 x 10 6 células / mL de acuerdo con las instrucciones del fabricante. Luego, se agregaron 5 μL de anexina V-FITC y 5 μM de PI a una suspensión celular de 100 μL y se incubaron durante 30 minutos a temperatura ambiente en la oscuridad. Después de agregar 300 μL de tampón de unión, las células marcadas se detectaron mediante citometría de flujo en 1 h.
Todas las células apoptóticas tempranas (Anexina V-FITC-positivas [teñidas en verde], PI-negativas), células necróticas (Anexina V-FITC-negativas, PI-positivas), células apoptóticas tardías (doble positivo), así como células vivas ( doble negativo) se detectaron mediante citometría de flujo (FCM) y se analizaron utilizando el software Cell Quest (Becton Dickinson). La longitud de onda de excitación del láser de argón fue de 488 nm y la longitud de onda de emisión de 530 nm (canal FL-1) para isotiocianato de fluoresceína (FITC) y 670 nm (canal FL-3 c3) para PI. Además, la apoptosis se examinó mediante microscopía de fluorescencia. Primero, 1.0 × 10 5 las células se sembraron en placas de cultivo de 96 pocillos y después de 24 h, las células se trataron como se indicó anteriormente, luego 24 h más tarde, se agregaron 100 μL de tampón de unión, 1 μL de anexina V-FITC y 1 μLPI a las células a temperatura ambiente en la oscuridad durante 15 min, mantenido a baja temperatura y observado por microscopía de fluorescencia.
Ensayo de migración celular
Un total de 8 × 10 5 las células se sembraron en placas de seis pocillos y se dejó que alcanzaran la confluencia total. La monocapa se hirió utilizando un palillo de cóctel. Las células se incubaron con DMEM sin suero como se indica. Se tomaron imágenes digitales a las 0, 6, 12, 24 y 48 h. El área media se calculó utilizando la Imagen J y los experimentos se repitieron tres veces.
Resultados y discusión
Conjugados de CHP y grado de sustitución del colesterol
El 1 El valor de H NMR para CHP (DMSO-d6 con TMS, ppm) fue de 2,53 ppm (2 grupos metileno, –OCH 2 CH 2 O–). La figura 1 muestra 1 Espectros de RMN H, que confirman que el colesterol se unió químicamente a la cadena larga del pululano mediante un brazo espaciador succínico. Los espectros para los tres NP de CHP sintetizados en diferentes proporciones de alimentación (a, b, c) mostraron los picos característicos del pululano; Los enlaces glicosídicos α-1-4 y α-1,6 fueron ∂ 4.68 (1Hα 1–6 ), ∂ 5.05 (1Hα 1–4 ) y ∂ 2.53 (2 grupos metileno, –OCH 2 CH 2 O–), respectivamente, que también fue fácil de distinguir. Aparecieron nuevos picos característicos de 0,40 a 2,40 (hidrógeno en el esqueleto colestérico), lo que confirmó que los tres polímeros de CHP se sintetizaron con éxito. El área debajo del pico refleja el número de átomos y el grado de sustitución colestérica se puede calcular de la siguiente manera [41]:
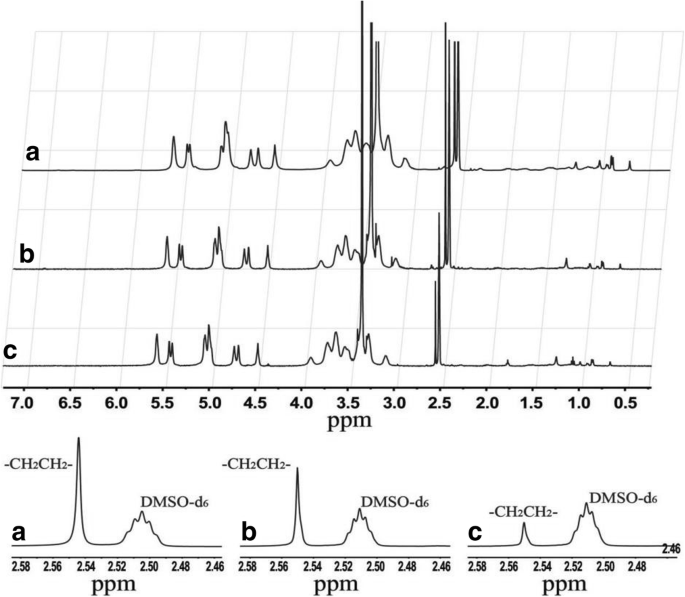
Espectros de RMN para CHP-1 ( a ), CHP-2 ( b ) y CHP-3 ( c )
donde la suma de A ∂4.68 y A ∂5.05 representa el número de unidades de azúcar, A ∂ 2.53 es el número de átomos de hidrógeno en –OCH 2 CH 2 O– del colesteril succínico y A ∂ 2.53 / 4 es el número de –OCH 2 CH 2 O–, es decir, el número de colesteroles en el anhídrido succínico CHS. Por tanto, la fórmula anterior representa el grado de sustitución colestérica en la molécula de CHP como el número de grupos colesterilo por 100 unidades de glucosa. Las proporciones de alimentación calculadas y las proporciones molares de unidades de azúcar colesterilo y pululano fueron 1/5, 3/20 y 1/20, respectivamente, y el grado de sustitución de los tres CHP-1, CHP-2 y CHP-3 sintetizados polímeros fue del 6,82%, 5,78% y 2,74%, respectivamente. El grado de sustitución del colesterol en la cadena del pululano aumentó al aumentar la proporción de alimento. Sin embargo, el grado real de sustitución fue menor que ambas proporciones de alimento.
La cadena de pululano puede existir como una cadena enrollada flexible en el disolvente, y después de la adición de una cierta cantidad de colesterol, el colesterol injertado muestra un impedimento estérico molecular más grande, que afecta la reacción de esterificación directa adicional del succinil colesterol y el grupo hidroxilo. en la cadena pululana. La dificultad de la reacción aumentó significativamente, por lo que el grado de sustitución se redujo.
NP de cogeneración con fármacos y su tamaño
Los tamaños de las tres NP de CHP en blanco para CHP-1, CHP-2 y CHP-3 fueron 79,1, 104,9 y 166,8 nm. Con un cierto grado de sustitución, la hidrofobicidad se fortaleció con el grado creciente de sustitución del colesterol. Cuanto más fuerte es la hidrofobicidad, mejor las NP autoagregadas de CHP forman un núcleo hidrofóbico más compacto, lo que reduce el tamaño de las NP [42]. La Figura 2 muestra el tamaño de las NP de CHP cargadas con fármaco. Los tamaños de partícula para CHP-1, CHP-2 y CHP-3 fueron 86,4, 162,30 y 222,28 nm, respectivamente. En la misma proporción de fármacos y materiales, el tamaño de partícula del NP cargado con fármaco con un alto grado de sustitución del grupo hidrófobo del polímero era pequeño, pero el diámetro de partícula del NP cargado con fármaco era mayor que el del fármaco no encapsulado. -que contiene NP en blanco con el mismo grado de sustitución. A medida que la mitoxantrona entra en el núcleo hidrófobo, aumenta el tamaño de partícula de las NP. En la Fig. 2d, el potencial zeta de los NP de CHP cargados con fármaco es -1,12 mV. La Fig. 2e es una imagen TEM que muestra que los NP cargados con fármaco son esféricos.
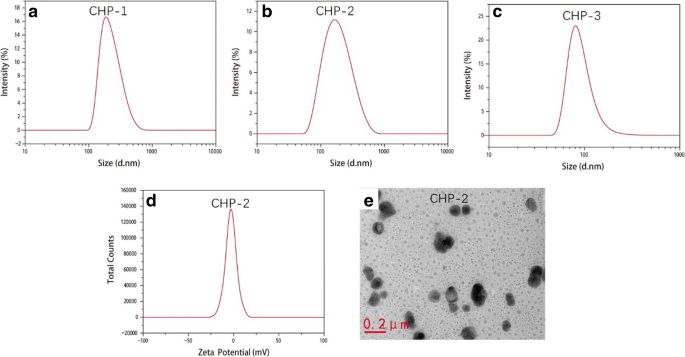
Imágenes de tamaño NP cargadas con mitoxantrona (CHP-1 ( a ), CHP-2 ( b ), CHP-3 ( c )), imágenes potenciales (CHP-2 ( d )) e imágenes TEM (CHP-2 ( e ))
Liberación de fármacos de NP cargados con fármacos de diferentes tamaños y bajo diferentes medios ácidos
Cuando las proporciones de fármaco y polímero de CHP eran iguales, la carga de fármaco y la eficacia de atrapamiento de los NP de CHP-1, CHP-2 y CHP-3 cargados con fármaco eran 8,17% y 88,92%; 7,62% y 82,28%; y 4,83% y 50,67%, respectivamente. Cuanto mayor sea la sustitución hidrófoba colestérica en el polímero de CHP, menor será el tamaño de partícula formado y mayor será la carga del fármaco y la eficacia de atrapamiento. La Figura 3 muestra los perfiles de liberación de fármaco para los tres NP de CHP cargados con fármaco. En PBS, el fármaco se liberó durante 48 h. Las tasas de liberación de CHP-1, CHP-2 y CHP-3 fueron 38,73%, 42,35% y 58,89%, respectivamente. Los tres NP mostraron propiedades de liberación sostenida, pero cuanto menor es el tamaño del NP, más fuerte es la hidrofobicidad y más lenta la liberación del fármaco. A pH 6,8, las tasas de liberación de fármaco para CHP-1, CHP-2 y CHP-3 fueron 43,82%, 49,48% y 64,18%, respectivamente. En condiciones débilmente ácidas, los NP de CHP liberaron el fármaco de forma sostenible, pero la tasa de liberación aumentó significativamente. A pH 4,0, después de 48 h de liberación del fármaco, las velocidades de liberación del fármaco para CHP-1, CHP-2 y CHP-3 fueron 51,25%, 56,23% y 75,46%, respectivamente. La liberación del fármaco CHP NP fue significativamente más rápida a un pH más bajo, especialmente para CHP-3 NP, el más grande de los tres CHP NP.
Liberación de mitoxantrona (MTO) de los NP de pululano en solución salina tamponada con fosfato (cuadrado negro:CHP-1, círculo blanco:CHP-2, triángulo negro que apunta hacia abajo:CHP-3), en pH 6,8 (triángulo blanco que apunta hacia arriba:CHP- 1, diamante negro:CHP-2, cuadrado blanco:CHP-3) y en pH 4.0 (triángulo negro:CHP-1, diamante blanco:CHP-2, círculo negro:CHP-3) a 37 ° C in vitro
Citotoxicidad de NP de CHP cargadas con mitoxantrona
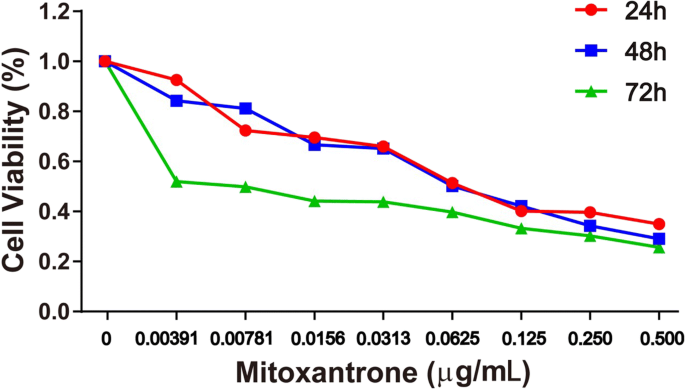
En el ensayo MTT (Fig. 4), el IC 50 Los valores de mitoxantrona para inhibir el crecimiento de células cancerosas de vejiga fueron 0,25, 0,20 y 0,06 μM a las 24, 48 y 72 h, respectivamente (Tabla 1). Consideramos 24 h como tiempo de dosificación.

Efecto del tratamiento con mitoxantrona y NP sobre la proliferación celular de la línea celular MB49 de cáncer de vejiga. La viabilidad celular se evaluó mediante un ensayo basado en tetrazolio con tratamiento de 24, 48 y 72 h con mitoxantrona y nanofármacos de 0 a 0,5 μg / ml en la línea celular de cáncer de vejiga murino MB49
Dado que la concentración de NP de mitoxantrona libre y de mitoxantrona-CHP es la misma con la misma administración, los resultados de los experimentos MTT en la figura 5 muestran que la concentración de mitoxantrona libre era más tóxica para las células cancerosas de vejiga que las NP de mitoxantrona-CHP. Al comparar las NP de mitoxantrona-CHP con los tres grados de sustitución del colesterol, el efecto citotóxico más potente fue el CHP-3, seguido del CHP-2, y el más débil fue el CHP-1.
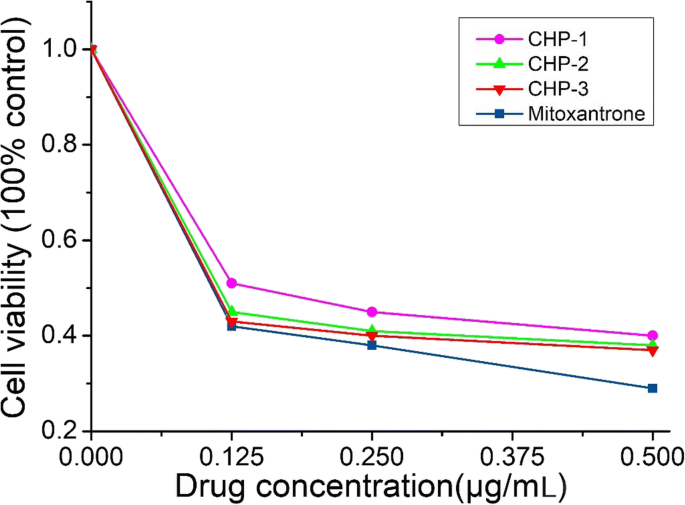
Citotoxicidad de las NP de CHP cargadas con mitoxantrona y mitoxantrona libres a las 24 h (cuadrado azul:mitoxantrona, círculo rosa:CHP-1, triángulo verde:CHP-2, triángulo rojo que apunta hacia abajo:CHP-3)
Aunque los efectos tóxicos de diversas concentraciones de NP de mitoxantrona-CHP en las células cancerosas de vejiga fueron similares, especialmente CHP-2 y CHP-3, el efecto de CHP-1 se redujo significativamente. Cada concentración de CHP-1 mostró este fenómeno. Por lo tanto, cuanto mayor sea el tamaño de NP de mitoxantrona-CHP, más fuerte será la citotoxicidad.
El efecto terapéutico de las NP tiene dos partes:(1) la captación celular de las NP y (2) las NP se liberan fuera de la célula y los fármacos entran libremente en las células para ejercer su eficacia. Debido a que la mitoxantrona libre tiene un efecto más fuerte que los NP de mitoxantrona-CHP, el CHP-3 tuvo un efecto terapéutico más fuerte que los otros dos NP de CHP a la misma dosis de fármaco. La liberación de CHP-3 fue la más rápida y el efecto terapéutico de los NP de CHP dependió principalmente de la toxicidad de la mitoxantrona libre en las células después de la liberación de la preparación nanofarmacéutica.
Apoptosis celular de NP de Mitoxantrona-CHP
Utilizamos inmunofluorescencia y citometría de flujo para comparar el efecto de la misma concentración de mitoxantrona 0,2 μg / ml y las tres NP de CHP cargadas con fármaco sobre la apoptosis de células MB49. La mitoxantrona libre fue más fuerte para la apoptosis que las tres NP de mitoxantrona-CHP (Fig. 6). Sin embargo, CHP-3 tuvo el efecto más potente y el más débil fue CHP-1. Los resultados anteriores de MTT se confirmaron aún más.
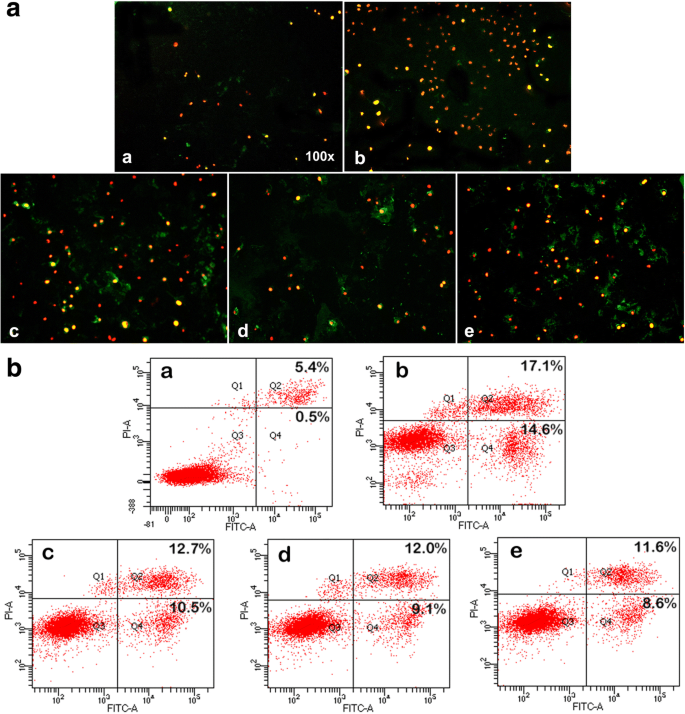
Apoptosis de mitoxantrona y nanofármacos a las 24 h en células cancerosas de vejiga MB49 ( a DMSO, b mitoxantrona, c CHP-3, d CHP-2, e CHP-1):A. Se detectó tinción doble de Anexina V-FITC / PI mediante microscopía de fluorescencia, las células apoptóticas tempranas mostraron tinción positiva de Anexina V-FITC (verde), las células necróticas fueron positivas a PI (rojo) y las células apoptóticas tardías mostró doble tinción positiva (amarillo). B. FCM determinó la tasa de apoptosis. Células vivas (Q3), tasa de apoptótica temprana (Q4), tasa de apoptótica tardía (Q2), células necróticas (Q1). Cuanto mayor es la tinción celular, mayor es la tasa de apoptótica
Migración celular de centrales nucleares de CHP cargadas con mitoxantrona
Se observó la capacidad de 24 y 48 h de la mitoxantrona libre y las tres NP de CHP para inhibir la migración de células MB49 en comparación con los controles (Fig. 7). La inhibición de la migración no fue significativamente más fuerte para la mitoxantrona libre que para las tres NP de CHP. En el ensayo MTT y la prueba de apoptosis, la inhibición de la migración fue más fuerte para el fármaco libre que para los tres NP de CHP, principalmente porque el fármaco libre entró más fácilmente en las células para matar las células cancerosas. En el experimento de migración celular también, el fármaco libre puede inhibir la migración celular de manera más eficiente que los nano-farmacéuticos de CHP, lo que puede deberse a que algunos nano-farmacéuticos de CHP no se fagocitan entre las células, lo que da como resultado la resistencia a la migración de las células cancerosas. Además, las tres NP de CHP no se diferenciaron en la inhibición de la migración de las células cancerosas, por lo que la resistencia estérica formada por las NP desempeñó un papel importante en la migración celular. Por lo tanto, los CHPNP cargados con fármaco inhiben las células cancerosas de dos formas:(1) la liberación extracelular es la forma dominante, mediante la cual los nanofármacos liberan los fármacos fuera de las células y destruyen las células cancerosas como fármacos libres, siendo los NP de CHP-3 más tóxicos que los otros NP de CHP, y (2) los NP de CHP fuera de las células cancerosas crean resistencia estérica, por lo que bloquean la migración de las células cancerosas.

Las NP de CHP cargadas con mitoxantrona sola y con mitoxantrona mostraron una migración alterada en los ensayos de cicatrización de heridas. un DMSO, b mitoxantrona, c CHP-3, d CHP-2, e CHP-1. Las imágenes mostraron el espacio de la región rayada en diferentes momentos; A 0 , A 24 y A 48 representan 0, 24 y 48 h de tratamiento con DMSO, respectivamente
El objetivo de este estudio fue seleccionar NP de CHP de tamaño adecuado como portadores de fármacos y proporcionar evidencia experimental de la acción terapéutica de las NP de CHP. Sintetizamos tres tipos de polímeros de pululano sustituidos con esteroles (CHP), CHP-1, CHP-2 y CHP-3, con un grado de sustitución de colesterol del 6,82%, 5,78%, 2,74% respectivamente, y un diámetro de 86,4, 162,30 y 222,28. Nuevo Méjico. La tasa de liberación del fármaco de tres tipos de NP de mitoxantrona-CHP durante 48 h fue 38,73%, 42,35% y 58,89%, respectivamente. El grado de sustitución hidrófoba en el polímero se asoció con el proceso de autoensamblaje de las NP, afectando su tamaño y por lo tanto la tasa de liberación del fármaco. En medios de liberación de ácido, la liberación se aceleró significativamente. Cuanto mayor es el NP, mayor es la velocidad de liberación del fármaco. A las 24 h, el IC 50 El valor fue de 0,25 M, para el mejor efecto de inhibición de mitoxantrona sobre el crecimiento de células cancerosas de vejiga. Las NP de CHP-3 cargadas con fármaco con el tamaño más grande fueron las más tóxicas para las células cancerosas de vejiga y las NP de CHP-3 tuvieron el efecto más fuerte en la promoción de la apoptosis de las células. Todas las NP podrían inhibir la migración de células MB49, pero las NP de CHP-3 de gran tamaño tenían la inhibición más poderosa.
Los polímeros anfifílicos pueden autoensamblarse en NP en soluciones acuosas; ejemplos son los polisacáridos pululano y quitosano, que pueden modificarse en polímeros anfifílicos mediante la modificación hidrófoba de moléculas pequeñas y autoensamblarse en NP esféricas en soluciones acuosas con grupos hidrófobos como núcleo y capas de cadenas de azúcar hidrófilas [43, 44]. Durante el autoensamblaje, los grupos hidrófobos son la fuerza impulsora para la formación de NP y la clave para la formación de su estructura de caparazón y núcleo. Las propiedades y el peso molecular de los grupos hidrófilos también tienen un efecto importante sobre la formación y el tamaño de las NP [45, 46]. Cuando el mismo polímero se modifica con una pequeña fracción de un grupo hidrófobo, el grado de sustitución hidrófoba debe ser moderado, y solo dentro de un cierto intervalo la sustitución hidrófoba puede autoensamblarse en NP. Si el grado de sustitución hidrófoba es demasiado alto, la hidrofobicidad del polímero es demasiado fuerte, lo que no conduce al autoensamblaje. Si la sustitución hidrófoba es demasiado baja, la fuerza impulsora hidrófoba es demasiado pequeña para formar NP [47].
En este estudio, sintetizamos con éxito tres tipos de polímeros de CHP con varios grados de sustitución del colesterol mediante el diseño de una proporción de alimentación adecuada, y todos podían autoensamblarse en NP de cierto tamaño. Durante el autoensamblaje de los polímeros de CHP, los fármacos hidrófobos como la mitoxantrona se pueden incrustar en el centro hidrófobo de las NP para formar NP cargadas de fármaco (Fig. 8). El tamaño de las NP cargadas de fármaco está relacionado con el grado de sustitución del polímero CHP:cuanto mayor es el grado de sustitución, menor es el tamaño. El grado de sustitución de los polímeros también afecta la cantidad de fármaco cargado en los NP después del autoensamblaje. Cuando la proporción de polímero a fármaco es la misma, cuanto mayor es el grado de sustitución, mayor es la carga de fármaco [48]. Además, la proporción de polímero a fármaco afecta la eficacia de encapsulación y la carga de fármaco. Solo cuando la proporción de alimentación esté en el rango adecuado, la carga de fármaco y la eficacia de encapsulación serán relativamente altas [31]. La liberación de fármacos de NP afecta directamente sus efectos terapéuticos, que está estrechamente relacionado con los tipos de nanomateriales, la carga superficial y el grupo hidrofóbico de NP, el valor de pH de los medios de liberación y la adsorción de la proteína albúmina de suero humano (HSA) in vivo. [49, 50]. La liberación del fármaco de las NP de CHP cargadas con mitoxantrona mostró una liberación lenta. La liberación del fármaco de NP de CHP de gran tamaño fue más rápida y la de NP en un entorno ácido fue más rápida. La tasa de liberación de fármacos de los NP de mayor tamaño fue más obvia y rápida.
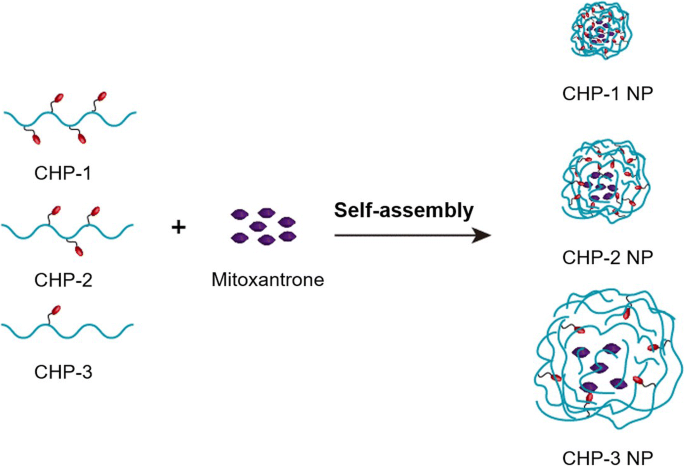
El autoensamblaje de nanopartículas de CHP cargadas con mitoxantrona (NP)
La quimioterapia del cáncer es la forma principal de tratar el cáncer actualmente, pero los fármacos de quimioterapia no son específicos de tejido y son tóxicos para los tejidos normales, y algunos causan un gran daño a las células inmunitarias, lo que perjudica el efecto general del tratamiento [51, 52]. La nanomedicina puede dirigirse pasivamente a los tejidos cancerosos a través del efecto EPR, lo que reduce la deposición del fármaco en los tejidos no objetivo y reduce la toxicidad y los efectos secundarios. En este estudio, usamos células cancerosas de vejiga como modelo de células cancerosas y discutimos los efectos del tamaño de los NP y de los NP sobre el cáncer de vejiga. El efecto antitumoral fue más fuerte para la mitoxantrona libre que para las NP de CHP; sin embargo, si se administra el fármaco completo, la mitoxantrona no es específica de tejido. La deposición y el desgaste de los tejidos y la toxicidad y los efectos secundarios causados por estos medicamentos no serán tan efectivos como los tratamientos con nanofármacos. Por lo tanto, los efectos tóxicos sobre las células cancerosas y la inhibición de la migración celular fueron mejores con el fármaco libre que los NP cargados con fármaco, lo que no indica que el efecto terapéutico general de los nanómetros de CHP no sea tan bueno como el de la mitoxantrona libre. Señalamos el efecto del grado de sustitución hidrófoba sobre el tamaño de los fármacos a nanoescala y el efecto del tamaño nanométrico sobre la carga del fármaco, la liberación del fármaco, la citotoxicidad y la migración de las células cancerosas. Una vez que los NP se dirigen pasivamente al tejido canceroso a través del efecto EPR, la eficacia terapéutica de los NP cargados con fármaco se deriva principalmente de la liberación de fármacos en el tejido y la liberación de NP a las células (Fig. 9). El efecto terapéutico de los NP de CHP es si su liberación extracelular o intracelular juega el papel dominante. A partir de los experimentos celulares, el tamaño de las NP de CHP tiene un efecto fuerte:con un tamaño grande, los medicamentos se liberan más, pero la cantidad del medicamento es la misma. Por lo tanto, el efecto terapéutico de los CHP-NP puede depender principalmente de la liberación en el tejido en lugar de la captación celular.
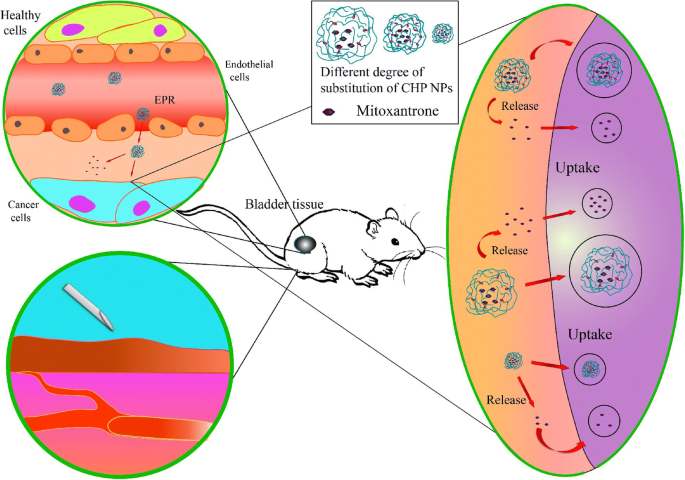
La eficacia del tratamiento de las NP de CHP cargadas con mitoxantrona principalmente por la liberación de ubicación en el tejido tumoral
Muchos NP clásicos se utilizan como portadores de fármacos, y los NP de CHP que preparamos son superiores a otros. Por ejemplo, las NP biogenéticas (como exosomas, vesículas extracelulares miméticas, vesículas extracelulares modularizadas) son difíciles de preparar [53]. La distribución objetivo de los liposomas comunes no es ideal y su inestabilidad sigue siendo un problema [54]. Los NP inorgánicos, como los NP de punto cuántico, son muy estables, pero como materia extraña, su biocompatibilidad es deficiente, lo que puede provocar efectos secundarios en los seres humanos [55]. Las NP de CHP son fáciles de preparar y podemos controlar su tamaño controlando el grado de sustitución hidrófoba [48]. Debido a que pueden ser degradados directamente por la amilasa in vivo, tienen una buena biocompatibilidad [56]. Además, los NP de CHP tienen buena estabilidad y excelentes propiedades de liberación de fármacos [57]. La desventaja es que inevitablemente serán tragados en parte por el sistema fagocítico mononuclear [58]. Se necesita más investigación para reducir la eliminación por parte del sistema y mejorar la concentración sanguínea efectiva de NP.
Conclusión
El tamaño de las NP de CHP cargadas con mitoxantrona está relacionado con el grado de sustitución del colesterol en el polímero. Cuanto mayor sea el grado de sustitución de la hidrofobicidad, menor será el tamaño y mayor será la carga del fármaco y la eficacia de encapsulación, y más lenta será la liberación del fármaco. En condiciones ácidas, cuanto más fuerte es la acidez, más rápida es la liberación de NP de CHP. Además, la liberación de NP de mayor tamaño es mejor y las NP de mayor tamaño pueden inhibir el crecimiento de las células de la vejiga y su migración mejor que las NP de menor tamaño. Los NP de CHP destruyen las células cancerosas principalmente mediante la liberación de fármacos a nanoescala fuera de la célula.
Nanomateriales
- Preparación de nanopartículas de mPEG-ICA cargadas con ICA y su aplicación en el tratamiento del daño celular H9c2 inducido por LPS
- La administración de nanopartículas de artesunato mejora la eficacia antitumoral activando la apoptosis celular mediada por mitocondrias
- Efecto de la distribución de nanopartículas de oro en TiO2 sobre las características ópticas y eléctricas de las células solares sensibilizadas por colorante
- Formación y propiedades luminiscentes de Al2O3:nanocompuestos de SiOC en la base de nanopartículas de alúmina modificadas por feniltrimetoxisilano
- Poliglicerol hiperramificado modificado como dispersante para el control del tamaño y la estabilización de nanopartículas de oro en hidrocarburos
- Promoción del crecimiento celular SH-SY5Y mediante nanopartículas de oro modificadas con 6-mercaptopurina y un péptido penetrante de neuronas
- Nanopartículas de oro de forma redonda:efecto del tamaño de partícula y la concentración sobre el crecimiento de la raíz de Arabidopsis thaliana
- Síntesis verde de nanopartículas de metal y óxido de metal y su efecto sobre el alga unicelular Chlamydomonas reinhardtii
- Evaluación de las propiedades antimicrobianas, apoptóticas y de administración de genes de células cancerosas de nanopartículas de oro cubiertas con proteínas sintetizadas a partir del hongo mic…
- Efectos del tamaño y la agregación / aglomeración de las nanopartículas en las propiedades interfaciales / interfásicas y la resistencia a la tracción de los nanocompuestos poliméricos
- Influencia de nanopartículas de agricultura con diferentes tamaños y concentraciones incrustadas en una capa compacta de TiO2 en la eficiencia de conversión de las células solares de perovskita



