La administración de nanopartículas de artesunato mejora la eficacia antitumoral activando la apoptosis celular mediada por mitocondrias
Resumen
Se consideró que la artemisinina y sus derivados ejercen un amplio espectro de actividades anticancerígenas e inducen efectos anticancerígenos significativos en las células tumorales. La artemisinina y sus derivados pudieron absorberse rápidamente y se distribuyeron ampliamente, matando selectivamente las células tumorales. Dado que las concentraciones bajas de artesunato dependían principalmente de la oncosis para inducir la muerte celular en las células tumorales, sus efectos antitumorales eran indeseables y limitados. Para obtener mejores efectos antitumorales, en este estudio, aprovechamos una nueva nanotecnología para diseñar nuevas nanopartículas de albúmina de suero bovino cargadas con artesunato para lograr la acumulación mitocondrial de artesunato e inducir la apoptosis mediada por mitocondrias. Los resultados mostraron que, en comparación con la dependencia del artesunato libre en la muerte oncótica, las nanopartículas de albúmina de suero bovino cargadas con artesunato mostraron una mayor citotoxicidad y sus efectos apoptóticos significativos se indujeron a través de la distribución de artesunato en las mitocondrias. Este hallazgo indicó que las nanopartículas de albúmina de suero bovino cargadas con artesunato dañaron la integridad mitocondrial y activaron la apoptosis celular mediada por mitocondrias al regular al alza las proteínas relacionadas con la apoptosis y facilitar la liberación rápida del citocromo C.
Antecedentes
La artemisinina y sus derivados se han utilizado ampliamente en el tratamiento de la malaria debido a su alta actividad antipalúdica y baja toxicidad. Los investigadores también encontraron que la artemisinina y sus derivados demostraron una actividad antitumoral significativa en virtud de sus pocos efectos secundarios tóxicos y una mayor tolerancia por parte de los pacientes [1]. Se informó que el artesunato (Ats) inhibió definitivamente el crecimiento de las células tumorales y además indujo efectos anticancerígenos significativos en las células tumorales [2, 3, 4]. Algunos experimentos indicaron que Ats causaba diferentes grados de apoptosis y oncosis en las células tumorales después de 48 h, y que los grados de apoptosis y oncosis dependían de la dosis de Ats. A bajas concentraciones, Ats no indujo apoptosis obvia en las células tumorales y la muerte celular inducida por Ats se acompañó de muerte similar a la oncosis [5,6,7,8]. Para obtener mayores efectos antitumorales, se aplicó una dosis más alta de Ats, pero esto confirmó aún más su grave toxicidad y supresión de la médula ósea. Por tanto, es necesario encontrar un tratamiento eficaz para reducir la dosis eficaz de Ats para mejorar su eficacia antitumoral [9,10,11]. Se descubrió que las mitocondrias desempeñaban un papel importante en la regulación de los efectos apoptóticos y oncóticos de Ats. Las mitocondrias también participaron en la regulación del proceso de transducción de una amplia variedad de señales apoptóticas [12, 13, 14, 15, 16, 17]. Cuando las mitocondrias fueron atacadas por fármacos, su permeabilidad aumentó y el potencial de membrana disminuyó, lo que provocó una inflamación endometrial de la membrana mitocondrial y la rápida liberación del citocromo C de las mitocondrias al citoplasma [18,19,20]. Además, se activaron algunas proteínas de la familia de las caspasas y se indujo la reacción en cascada de la apoptosis celular.
Para mejorar los efectos antitumorales de Ats, se intentaron muchas técnicas nuevas para aumentar la distribución del fármaco en las células tumorales o para mejorar la administración dirigida de fármacos a los orgánulos celulares para inducir la muerte celular [21,22,23]. Las nanopartículas (NP) como herramienta clave en el tratamiento selectivo del cáncer se han investigado ampliamente y han mostrado un potencial prometedor. Como las NP presentaban un tamaño de partícula más pequeño y una gran superficie, podían entrar en la circulación sanguínea a través de los capilares y pasar a través del espacio de células endoteliales y migrar al sitio del tumor, logrando así una distribución dirigida al fármaco y mejorando la biodisponibilidad del fármaco. . Además, los NP podrían controlar la liberación del fármaco mediante la degradación del biomaterial en un patrón largo y suave, prolongando finalmente la vida media de eliminación, mejorando la concentración sanguínea efectiva y reduciendo la frecuencia de dosificación. Sobre todo, los NP cargados con fármaco podrían administrarse a ubicaciones específicas dentro de las células, mejorando la eficacia del tratamiento [24, 25, 26].
Para mejorar los efectos antitumorales de Ats a bajas concentraciones, intentamos diseñar nuevos NP de albúmina de suero bovino (BSA) cargados con Ats. Debido al bajo pH en las células tumorales, la acumulación de una gran cantidad de protón de hidrógeno presente en la membrana mitocondrial externa o en el espacio intermembrana, al contrario, la membrana intermitocondrial es rica en carga negativa debido a su composición química y matriz mitocondrial. secreción, que genera un potencial transmembrana electropositivo exterior y negativo interior que puede favorecer la liberación de BSA. Entonces, la acumulación masiva de Ats en las mitocondrias podría desencadenar efectivamente la apoptosis mediada por mitocondrias. Los resultados mostraron que, en comparación con la muerte oncótica típica inducida por Ats libres, Ats se transfirió específicamente a las mitocondrias con la mediación de BSA NP y promovió la activación mediada por mitocondrias de las proteínas caspasa relacionadas con la apoptosis. Esto encendió una apoptosis celular significativa, destacando así la mayor citotoxicidad.
Métodos
Materiales
BSA se compró a Sigma-Aldrich Co. (St Louis, MO, EE. UU.), Y Ats se compró a Guilin Pharmaceutical Corporation (Guilin, República Popular de China). Las células SMMC-7721 y las células Plc se compraron en el Instituto de Bioquímica y Biología Celular de la Academia de Ciencias de China (Shanghai, República Popular de China). Todos los demás productos químicos adquiridos eran de calidad analítica; se obtuvieron de una variedad de proveedores.
Preparación y caracterización de NP BSA cargadas con Ats
Según la bibliografía publicada anteriormente [27], las NP de BSA cargadas con Ats se prepararon mediante un método de desolvatación. Brevemente, las NP de BSA cargadas con Ats se prepararon vertiendo rápidamente 1,0 ml de alcohol anhidro que contenía una cierta cantidad de Ats en 0,5 ml de solución de BSA a 37 ° C hasta la opalescencia. Con la eliminación del etanol por evaporación rotatoria, las NP de BSA cargadas con Ats se precipitaron adicionalmente del medio, y luego se añadió glutaraldehído al 8% en agua (0,5 μL / mg de BSA) para inducir la reticulación de las partículas con agitación de la suspensión durante un período. de 24 h. Finalmente, los NP se recolectaron y lavaron tres veces con agua desionizada para analizar más a fondo sus caracterizaciones físicas, incluido su diámetro hidrodinámico, índice de polidispersidad (PDI), potencial zeta y morfología utilizando un Brookhaven Zetasizer (Brookhaven Instruments Corporation, Holtsville, NY, EE. UU.) y un microscopio electrónico de transmisión (JEM-1200EX; JEOL, Tokio, Japón). La determinación de la eficiencia de encapsulación de Ats en BSA NP se estimó utilizando un método informado anteriormente [27].
Ensayo MTT
Se incubaron por separado dos tipos de líneas de células tumorales, células SMMC-7721 y células Plc, con suero bovino fetal (FBS) al 20%. La densidad de crecimiento celular se ajustó a 1 × 10 6 células / ml por recuento de células, y luego las suspensiones de células se diluyeron a 1 × 10 5 células / mL. Las suspensiones diluidas se agregaron adicionalmente por separado en una placa de 96 pocillos (100 μL por pocillo, aproximadamente 1 x 10 4 células / pocillo) para incubación continua durante 24 ha 37 ° C en condiciones de 5% CO 2 y 95% O 2 . El medio se reemplazó por medio sin suero en presencia de Ats libres o NP de BSA cargadas con Ats que presentaban diferentes concentraciones de Ats, y posteriormente se incubó durante 24 h. Se añadió un total de 50 μL de bromuro de 3- (4,5-dimetiltiazol-2-il) -2,5-difenil tetrazolio (MTT) (5 mg / ml) a cada pocillo y se incubó durante 4 h para la terminación del cultivo. Cuando el tinte de tetrazolio MTT se redujo a su formazán insoluble, se centrifugaron placas de 96 pocillos a 1000 rpm durante 5 min, y se decantó el sobrenadante de cada pocillo, seguido de la adición de 150 μL de dimetilsulfóxido (DMSO), que por completo disolvió los cristales. La absorbancia de la solución se midió utilizando un lector de microplacas (Syneray-2; BioTek Instruments, Inc., Winooski, VT, EE. UU.) A 490 nm.
Distribución intracelular del grupo BSA NP en células
Se seleccionaron células SMMC-7721 y células Plc en la fase logarítmica y se trataron con digestión con tripsina; la concentración celular se ajustó a 1 × 10 6 células / mL. A continuación, las células cultivadas se añadieron a una placa de cultivo celular de 6 pocillos para comprobar la adherencia, y el medio de cultivo se retiró seguido de la adición de NP BSA marcadas con rodamina B. El núcleo se tiñó con Hoechst (azul) durante 15 min a 37 ° C, y las mitocondrias se tiñeron con Mitotracker Green FM. La ubicación de los NP de BSA en las células se rastreó dentro de las células mediante microscopía de barrido láser confocal (FluoView FV10i; Olympus Corporation, Tokio, Japón).
Cambio potencial de la membrana mitocondrial
JC-1 se puede utilizar para determinar cambios en el potencial de la membrana mitocondrial. Cuando el potencial de la membrana mitocondrial era alto, JC-1 pudo atravesar libremente la membrana celular y formó agregados dentro de las mitocondrias, exhibiendo una fluorescencia roja (longitud de onda de excitación, 525 nm; longitud de onda de emisión, 590 nm); cuando el potencial de la membrana mitocondrial disminuyó, JC-1 se transfirió de la matriz mitocondrial al citoplasma celular para formar un monómero verde fluorescente (longitud de onda de excitación, 490 nm; longitud de onda de emisión, 530 nm). Las células SMMC-7721 y las células Plc se sembraron respectivamente en placas confocales para alcanzar una densidad de 1 × 10 6 células / mL para incubación continua durante 12 h. A continuación, se desechó el medio de cultivo y se añadió a la placa medio de cultivo sin suero que contenía la dispersión de Ats o BSA NPs cargadas con Ats. Después de 9 h, se descartó el medio y las células se lavaron dos veces con PBS, seguido de la adición de 2 mL de JC-1 a una concentración de 2 μmol / L; A continuación, las células se incubaron durante 30 min a 37ºC en condiciones de oscuridad. Se utilizó un microscopio confocal de barrido láser (FluoView FV10i; Olympus Corporation) para observar los cambios de imagen en la membrana mitocondrial.
Medición de la producción de ROS y tinción del retículo endoplásmico (ER)
Las células se incubaron con FBS al 20% y la densidad de crecimiento celular se ajustó a 1 x 10 6 células / ml por recuento de células; y luego las suspensiones de células se diluyeron a 1 x 10 5 células / mL. Las suspensiones diluidas se agregaron adicionalmente en placas de 96 pocillos (100 μL por pocillo, aproximadamente 1 x 10 4 células / pocillo) para incubación continua durante 24 ha 37 ° C bajo 5% de CO 2 y 95% O 2 . En segundo lugar, las NP de BSA cargadas con Ats y Ats libres se incubaron con las células durante 6, 12 y 24 h, seguido de una incubación continua con 10 μM de diacetato de 2,7-diclorofluoresceína (DCFH-DA; Sigma-Aldrich Co.) para unos 30 min. Se usó tampón PBS helado para lavar las células tres veces para eliminar las NP no internalizadas. La intensidad de fluorescencia intracelular de DCF, que se excita a 485 nm y se emite a 530 nm, se detectó utilizando un lector de microplacas (Synergy-2; BioTek Instruments) para investigar el alcance del estrés oxidativo. Los grupos de prueba se trataron con células SMMC-7721 y células Plc durante 24 h, y se añadió la sonda ER-Tracker Blue-White DPX (Molecular Probes, Eugene, OR, EE. UU.) A las células para su incubación durante 30 min. Después de descartar la solución de carga y lavar las células con PBS, se observó el cambio de morfología del RE mediante microscopía de barrido láser confocal.
Evaluación de apoptosis y oncosis celular por citometría de flujo
De acuerdo con el protocolo de nuestro estudio anterior [28], se utilizó un ensayo de tinción con anexina V-isotiocianato de fluoresceína (FITC) / yoduro de propidio (PI) para evaluar la oncosis celular y la apoptosis inducida por Ats libres y NP de BSA cargadas con Ats. Las células se lisaron con tipsina y se sembraron en placas de seis pocillos a una concentración de 1 × 10 6 células / mL durante 24 h de incubación continua. A continuación, se retiró el medio de cultivo y se añadió a los pocillos medio libre de suero que contenía Ats libres y NP de BSA cargadas con Ats. Después del tratamiento, las células se recogieron y se suspendieron en tampón Nicoletti (Beijing 4A Biotech Co., Ltd., Beijing, República Popular de China) que contenía anexina V (AV-FITC) marcada con PI y FITC. El cambio morfológico de las células se observó mediante microscopía de barrido láser confocal. Para verificar las tasas de apoptosis y oncosis celular inducidas por las NP cargadas con Ats, se cuantificaron por citometría de flujo los porcentajes de células apoptóticas tempranas (Q4), oncóticas (Q2), necróticas (Q1) y vivas (Q3).
Análisis de transferencia Western de proteínas relacionadas con la apoptosis y citocromo C en células
Se realizó un ensayo de transferencia de Western para determinar los niveles de proteínas relativas cuando se incubaron NP libres cargadas con Ats o Ats con células SMMC-7721 durante 24 h. Las células se lisaron con tampón de ensayo de radioinmunoprecipitación (RIPA) enfriado con hielo que contenía un cóctel inhibidor de proteasa e inhibidores de fosfatasa (Roche, Basilea, Suiza). Las concentraciones de proteína se determinaron usando un kit de ensayo BSA modificado (Thermo Fisher Scientific, Waltham, MA, EE. UU.) Y se normalizaron antes de cargarlas en electroforesis en gel de poliacrilamida con dodecilsulfato de sodio (SDS) al 10% (PAGE). Los niveles de las proteínas objetivo se fotografiaron y analizaron utilizando un sistema de análisis de gel UVP (iBox Scientia 600; UVP, LLC., Upland, CA, EE. UU.).
Resultados
Características de las NP de BSA cargadas con Ats y el estudio de viabilidad celular
En la Fig. 1a, b se observó que las NP de BSA cargadas con Ats mostraban una forma esférica y estaban dispersas de manera homogénea con un PDI más bajo de 0,016. El tamaño de partícula promedio de las NP de BSA cargadas con Ats fue de aproximadamente 99,9 ± 2,3 nm y el potencial zeta fue negativo y se valoró en alrededor de –25,6 ± 4,3 mV. El perfil de liberación mostró una liberación suave y sostenida que se muestra en la Fig. 1c. En comparación con la liberación rápida de Ats libres en medio in vitro, los Ats atrapados en el núcleo de las NP de BSA se difundieron lentamente desde el interior de las NP al medio y mostraron un patrón de liberación suave y sostenida, debido a la degradación continua de BSA. Más del 85% de los AT libres se liberó por completo en las primeras 6 h, mientras que la cantidad acumulada total de fármaco liberada de los NP al medio en un período de 48 h fue del 78,9%. Esto indicó que los NP podrían controlar la liberación del fármaco a través de la degradación de biomateriales en un patrón largo y suave, prolongando así la vida media de eliminación, mejorando la concentración sanguínea efectiva y reduciendo la frecuencia de dosificación.
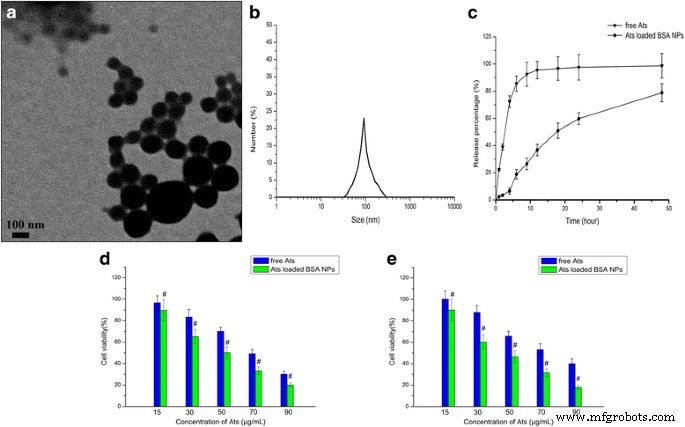
Caracterización de NP de BSA cargadas con Ats. un Imagen TEM de NP BSA cargadas con Ats. b Análisis de dispersión dinámica de luz (DLS) de las NP de BSA cargadas con Ats obtenidas. c El perfil de liberación in vitro de NP de BSA cargadas con Ats en solución salina tamponada con fosfato con un pH de 7,4 a 37 ° C durante 48 h. Viabilidad de las células SMMC-7721 ( d ) y celdas Plc ( e ) tras la incubación con diferentes cantidades de Ats libres y NP de BSA cargadas con Ats durante 24 h. Los datos se presentan como la media ± DE ( n =3). # P <0,05 frente a los Ats gratuitos correspondientes
Se usó MTT para examinar los efectos inhibidores de las NP de BSA cargadas con Ats y Ats libres en células SMMC-7721 y células Plc a diferentes intervalos de tiempo. Los resultados (Fig. 1d, e) mostraron que la citotoxicidad de los Ats libres aumentaba con el aumento de la concentración de fármaco, y las NP de BSA cargadas con Ats mostraron una citotoxicidad mejorada gradualmente. Esto demostró que las NP de BSA cargadas con Ats y Ats inhibían el crecimiento de células tumorales y que la proporción de inhibición dependía de la dosis de Ats. En comparación con los Ats libres, los NP de BSA cargados con Ats demostraron una mayor citotoxicidad y una mayor sensibilidad en ambas células, y dieron como resultado una mayor inhibición celular. Como se muestra en la Fig. 1d, e, el tratamiento de ambas células con NP de BSA cargadas con Ats provocó una disminución significativa en la viabilidad celular a las 24 h en comparación con la de Ats libres. Los valores de concentración inhibitoria máxima (IC50) del 50% para las células SMMC-7721 y las células Plc tratadas con NP de BSA cargadas con Ats fueron 50,1 y 44,9 μg / ml a las 24 h, respectivamente, que se compara con los valores obtenidos de 69,2 y 74,9 μg / mL a las 24 h en células tratadas con Ats libres. Esto indicó que cuando Ats se cargó en BSA NP, podría cambiar su ubicación intracelular, mediada por las NP, y finalmente mató a más células.
Captación celular in vitro de BSA NP
La distribución intracelular y la ubicación de las NP BSA en ambos tipos de células tumorales se observaron mediante microscopía de barrido láser confocal, como se muestra en la figura 2. Después de que las NP marcadas con rodamina B se cocultivaron con células durante 3 h, se observó claramente la fluorescencia roja en el citoplasma; Con el paso del tiempo, la mayoría de las NP de BSA se internalizaron intracelularmente y se difundieron en el citoplasma, mostrando una mayor fluorescencia roja dependiente del tiempo. También se observó que las NP de BSA localizadas en el citoplasma habían sido coubicadas con las mitocondrias, como lo evidencia la aparición de fluorescencia amarilla, lo que sirvió para indicar que la fluorescencia roja inherente de las NP marcadas con rodamina B y la fluorescencia verde emitida por el indicador mitocondrial MitoTracker® green FM se había fusionado. Esto demostró que las NP de BSA internalizadas podrían acumularse específicamente dentro de las mitocondrias, lo que destaca la posibilidad de que Ats se entregue a las mitocondrias con la mediación de las NP de BSA.
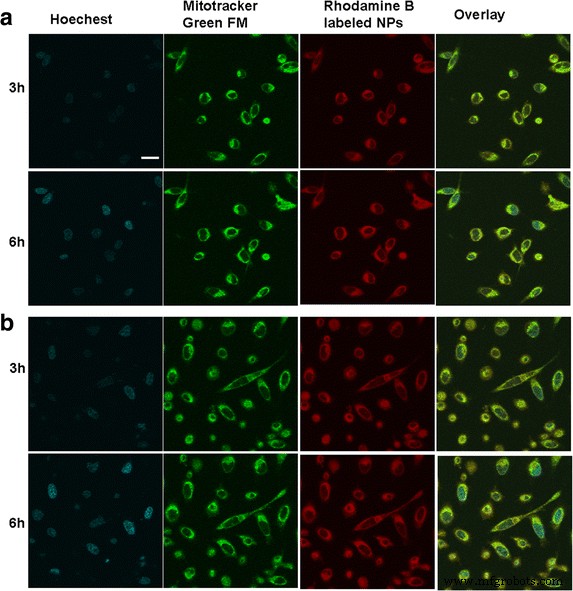
La distribución celular in vitro de las NP de BSA después de ser incubadas con diferentes células tumorales. Imagen fluorescente de células SMMC-7721 ( a ) y celdas Plc ( b ). Barra de escala , 100 μm
Análisis del potencial de la membrana mitocondrial
Para aclarar si las NP de BSA cargadas con Ats interferían con la función mitocondrial después de la administración de Ats en las mitocondrias, se determinaron los cambios en el potencial de la membrana mitocondrial. La Figura 3 demostró que después de la tinción con JC-1, la mayoría de las mitocondrias en las células tumorales tratadas con Ats libres exhibieron una fuerte fluorescencia roja y una débil intensidad de fluorescencia verde. Esto sugirió que la mayoría de JC-1 existía en un estado agregado, reforzando la integridad de la membrana mitocondrial y un mayor potencial. Por el contrario, cuando JC-1 tiñó las células tratadas con BSA NPs cargadas con Ats, las mitocondrias en ambas células tumorales exhibieron una fluorescencia verde más fuerte, lo que indica que la membrana mitocondrial estaba seriamente dañada y su potencial disminuyó significativamente. En conjunto, demostró que Ats se administró con éxito a las mitocondrias con la mediación de BSA NP, lo que resultó en la despolarización de la membrana mitocondrial.
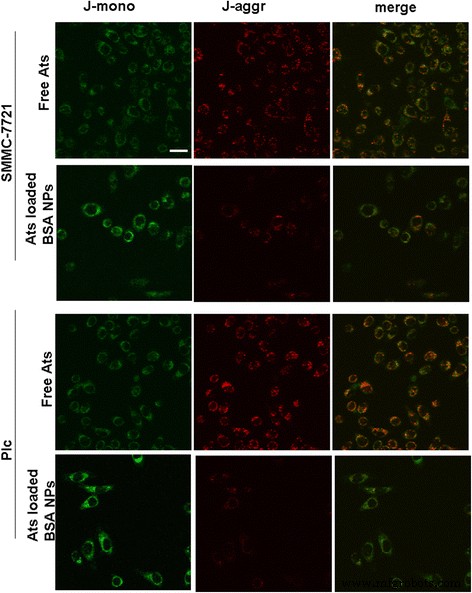
Cambio de imagen del potencial de la membrana mitocondrial después de la incubación de NP de BSA cargadas con Ats y Ats libres con células SMMC-7721 y células Plc. Barra de escala , 100 μm
Medición de la producción de ROS y tinción del ER
Se confirmó ampliamente que la generación de una gran cantidad de ROS puede causar peroxidación de fosfolípidos en la membrana mitocondrial interna y que también puede inducir una disminución en el potencial de la membrana mitocondrial, lo que resulta en la liberación rápida del citocromo C. Usamos DCFH- DA como sonda fluorescente para detectar el cambio de ROS. DCFH-DA pasó libremente a través de la membrana celular al interior de la célula y se transformó en DCFH mediante hidrólisis de esterasa. El DCFH generado no puede atravesar la membrana celular y se puede cargar fácilmente en las células. ROS intracelular oxidado DCFH no fluorescente a DCF con un color verde fluorescente. Por lo tanto, la detección de fluorescencia de DCF puede indicar el nivel de ROS intracelulares.
Cuando ambas células se trataron con Ats libres y NP de BSA cargadas con Ats durante un cierto período de tiempo, la cantidad de ROS intracelulares también aumentó, mostrando una relación dependiente del tiempo. En comparación con Ats libres, la generación de ROS en células SMMC-7721 y células Plc tratadas con NP de BSA cargadas con Ats mejoró significativamente. Las figuras 4a demostraron que los niveles de ROS en células SMMC-7721 y células Plc expuestas a NP de BSA cargadas con Ats durante 48 h se habían incrementado a 1,53 y 1,28 veces, respectivamente, en comparación con las células SMMC-7721 y las células Plc tratadas. con Ats gratis. Esto apoyó la idea de que los NP aceleraron la producción de ROS intracelulares. En comparación con el grupo de control y los Ats libres, y después de ser tratados con NP de BSA cargadas con Ats, la intensidad de la tinción de fluorescencia del ER-Tracker Blue-White DPX como un tinte específico de ER aumentó significativamente, lo que sugiere que el estrés de ER también se desencadenó en las células tratadas con NP cargadas con Ats con un aumento correspondiente en el nivel de ROS. Este hallazgo destacó que Ats se localizó específicamente en las mitocondrias, mediado por BSA NP; esto condujo a un aumento significativo en el nivel de radicales libres de oxígeno dentro de las células, lo que desencadenó la inducción del estrés ER y activó la vía mitocondrial para inducir la apoptosis celular dependiente de caspasa.
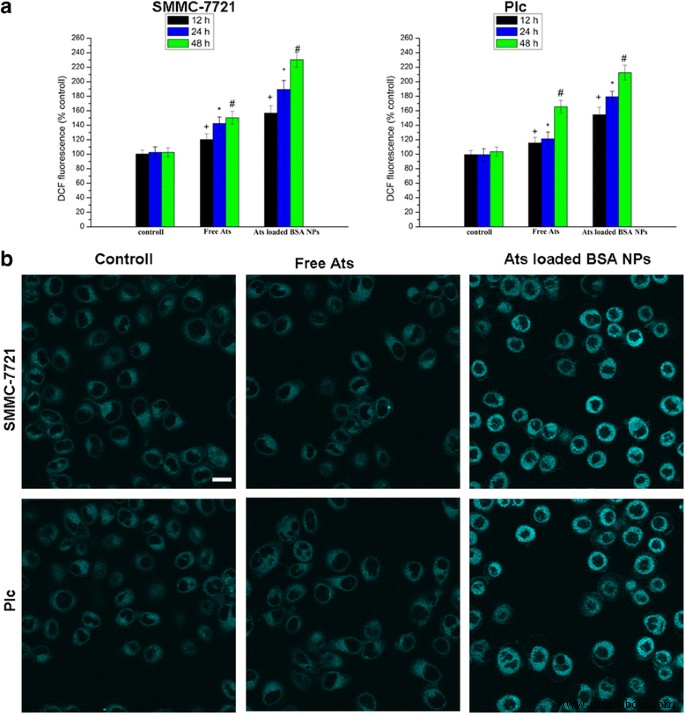
Cuantificación de la generación de ROS en células tratadas con Ats libres y NP de BSA cargadas con Ats en diferentes momentos ( a ). Tinción ER con la sonda ER-Tracker Blue – White DPX ( b ). Barra de escala , 100 µm. Los datos se presentan como la media ± DE ( n =3). + P <0.05 versus el grupo de control a las 12 h, * P <0.05 versus el grupo de control a las 24 h, # P <0,05 frente al grupo de control a las 24 h
Evaluación de la apoptosis y necrosis celular
Las células se trataron mediante un ensayo de tinción con Anexina V-FITC / PI. Las células vivas no se unieron a Anexina V-FITC / PI, por lo que no apareció fluorescencia. Las células apoptóticas no se unieron a PI, pero se tiñeron con Anexina V-FITC, produciendo fluorescencia verde. Por el contrario, para las células oncóticas, sus membranas celulares se dañaron hasta cierto punto y los núcleos celulares se dilataron para romperse en pedazos, mostrando así fluorescencia verde y roja. Como se muestra en la Fig.5a, en comparación con el grupo de control, cuando Ats libres y NP cargadas con Ats se incubaron con células durante 24 h, se observó una fuerte fluorescencia verde y roja en las células, lo que indica que Ats libres y NP BSA cargadas con Ats oncosis y apoptosis de células tumorales inducidas. Especialmente después de ser tratado con BSA NPs cargadas con Ats, las intensidades de tinción de fluorescencia obtenidas de Anexina V-FITC y PI habían aumentado significativamente, lo que sugiere que los grados de oncosis y apoptosis mejoraron significativamente en las células tratadas con NPs cargadas con Ats.
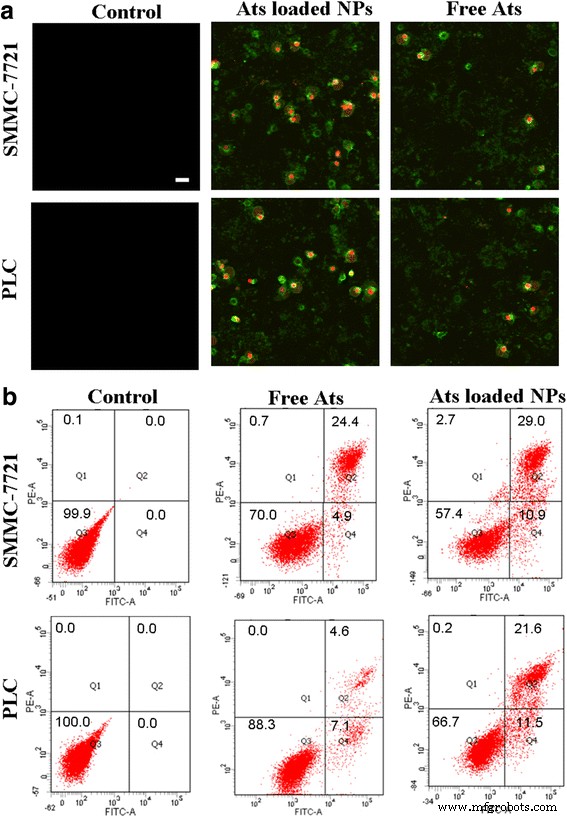
Morfología de los cambios ultraestructurales de las células tratadas con Ats libres y NP de BSA cargadas con Ats mediante el ensayo de tinción de Anexina V-FITC / PI ( a ). Barra de escala , 100 µm. Análisis con citómetro de flujo de la apoptosis celular y la oncosis después de 24 h de incubación con las NP de BSA cargadas con Ats libres y con Ats, respectivamente ( b )
Los porcentajes de células apoptóticas tempranas (Q4), oncóticas (Q2), necróticas (Q1) y vivas (Q3) se muestran en la Fig. 5b. Este hallazgo demostró que cuando las células se trataron con Ats libres, las tasas oncóticas aumentaron gradualmente a 24,4 y 4,6%, y la tasa de apoptosis se mantuvo en 4,9 y 7,1% en células SMMC-7721 y células Plc, respectivamente, lo que sugiere que Ats libres desencadenaron la aparición de oncosis y apoptosis conduce a la muerte celular. Por el contrario, las NP de BSA cargadas con Ats mejoraron significativamente la tasa de apoptosis y oncosis celular. Las proporciones apoptóticas aumentaron significativamente al 10,9% en las células SMMC-7721 y al 11,5% en las células Plc. Las proporciones oncóticas aumentaron al 29,0% en las células SMMC-7721 y al 21,6% en las células Plc. Esto indicó que la administración mitocondrial de Ats con la mediación de BSA NP aceleró la muerte de las células tumorales al potenciar los efectos oncóticos y apoptóticos. Las NP de BSA cargadas con Ats desencadenaron el proceso de transducción de señales apoptóticas y promovieron la reacción en cascada de la apoptosis celular mediada por mitocondrias.
Análisis de Western Blot
Para explorar la dependencia de la muerte celular de la apoptosis inducida por Ats libres y NP cargadas con Ats, se realizó un ensayo de transferencia de Western para detectar la expresión de proteínas de apoptosis. Se encontró que en células SMMC-7721 tratadas con NP cargadas con Ats, el nivel de expresión intracelular de la proteína Bax aumentó significativamente (Fig. 6). Este hallazgo sugirió que con la ayuda de BSA NP, Ats se acumuló en las mitocondrias y causó disfunción mitocondrial. La proteína citoplasmática del monómero Bax se transfirió a la membrana externa de las mitocondrias y se oligomerizó, formando un canal de proteínas en la membrana externa de las mitocondrias, lo que condujo a un aumento de la permeabilidad de la membrana. El nivel de expresión del citocromo C en el citoplasma también se incrementó de manera particular y significativa, y se encontró que las expresiones de caspasa-3 y caspasa-9 demostraban una tendencia ascendente. Por lo tanto, debido a la mayor permeabilidad de la membrana de las mitocondrias, el citocromo C se liberó rápidamente en el citoplasma, activando las proteínas de señalización de la muerte celular (caspasas) y promoviendo la reacción en cascada de la apoptosis celular. Por el contrario, los Ats libres no tuvieron diferencias significativas en la expresión de proteínas relacionadas con la apoptosis y el citocromo C, lo que sugiere que los Ats libres no desencadenaron la apoptosis celular mediada por mitocondrias y se basó principalmente en la oncosis para provocar la muerte celular. Los NP de BSA mejoraron la acumulación del fármaco en las mitocondrias y activaron los efectos apoptóticos mediados por las mitocondrias, lo que condujo a una apoptosis significativa y aumentó las expresiones de las proteínas primarias relevantes para la apoptosis, como se muestra en nuestros análisis de transferencia Western.
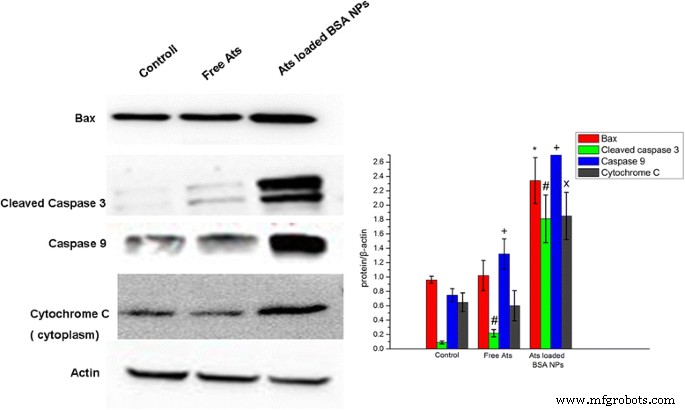
Análisis de transferencia Western de los niveles de expresión de caspasa-3, caspasa-9, Bax y citocromo C escindidas en células SMMC-7721. * P <0,05 frente a la expresión de la proteína Bax del grupo de control; # P <0,05 frente a la expresión de caspasa-3 escindida del grupo de control; + P <0,05 frente a la expresión de la proteína caspasa-9 del grupo de control; x P <0,05 frente a la expresión de la proteína del citocromo C del grupo de control. Los datos se presentaron como la media ± DE ( n =3)
Discusión
La oncosis y la apoptosis representan las dos formas diferentes en las que las células mueren. La apoptosis es un proceso activo de muerte celular programada que ocurre en organismos multicelulares. La oncosis, por otro lado, describe una muerte celular independiente de la caspasa que se caracteriza por hinchazón, aumento de la permeabilidad y ruptura de la membrana, lo que a menudo se denomina necrosis. Se cree que esta forma de muerte celular es accidental y descontrolada. Basándonos en nuestra investigación, encontramos que Ats inhibía el crecimiento de células tumorales y que la proporción de inhibición dependía de la dosis de Ats. Ats dependía principalmente del grado de oncosis y conducía a la muerte celular; también activó la muerte celular independiente de caspasa en forma de oncosis. Por el contrario, y por separado de la aparición de una muerte obvia similar a la oncosis, cuando las células tumorales se trataron con NP BSA cargadas con Ats, las NP BSA cargadas con Ats se internalizaron en el citoplasma y se localizaron rápidamente dentro de las mitocondrias para liberar Ats, mediado por los NP. Ats en las mitocondrias generaban ROS y desencadenaban estrés ER; activó aún más la vía apoptótica celular dependiente de caspasa meditada por mitocondrias al reducir el potencial de la membrana mitocondrial, liberando el citocromo C y promoviendo las expresiones de proteínas de Bax, caspasa 3 escindida y caspasa 9. En conjunto, las NP de BSA cargadas con Ats aumentaron el entrega mitocondrial de Ats y mejoró el grado de oncosis y apoptosis para inducir la muerte celular, aumentando así la citotoxicidad del fármaco e induciendo una muerte celular significativa.
Conclusiones
Brevemente, aclaramos que los Ats libres en las células tumorales dependían fuertemente del grado de oncosis para inhibir la proliferación de células tumorales en forma de muerte similar a la oncosis; por tanto, la citotoxicidad del fármaco era limitada e indeseable. En contraste, las NP de BSA cargadas con Ats activaron la vía apoptótica mitocondrial y simultáneamente desencadenaron efectos oncóticos; juntos, mejoraron la eficacia antitumoral sinérgica de Ats. The results of this study highlighted the significance of Ats-loaded BSA NPs in the enhancement of the cytotoxic and apoptotic effects of Ats, and they further signify the role of BSA NPs in diversifying the pathways of cell death induced by Ats. Compared with free Ats, Ats-loaded BSA NPs induced greater cytotoxicity and significant cell apoptosis effects in tumor cells.
Nanomateriales
- El amplificador de emisor común
- Los efectos de COVID-19 en la fabricación
- Adaptación de la toxicidad de las especies reactivas del oxígeno a la terapia tumoral avanzada
- Marcos metal-orgánicos sensibles al medio ambiente como sistema de administración de fármacos para la terapia tumoral
- Los efectos de la relación Li / Nb en la preparación y el rendimiento fotocatalítico de los compuestos Li-Nb-O
- La administración de ADN tetraedro mejora la apoptosis inducida por doxorrubicina de las células de cáncer de colon HT-29
- Los efectos de acoplamiento de los polaritones de plasma superficial y las resonancias magnéticas dipolo en metamateriales
- Una investigación sobre una célula solar de silicio cristalino con una capa de silicio negro en la parte posterior
- Evaluación de las propiedades antimicrobianas, apoptóticas y de administración de genes de células cancerosas de nanopartículas de oro cubiertas con proteínas sintetizadas a partir del hongo mic…
- Thiacalix [4] arenes Elimina los efectos inhibidores de los cationes de Zn en la actividad de la miosina ATPasa
- Los efectos positivos de la automatización agrícola



