Marcos metal-orgánicos sensibles al medio ambiente como sistema de administración de fármacos para la terapia tumoral
Resumen
Las nanopartículas como sistemas de administración de fármacos pueden alterar la hidrofilicidad de los fármacos para afectar la captación y la salida del fármaco en los tejidos. Evitan que los fármacos se unan de forma no específica a las biomacromoléculas y mejoran la acumulación de fármacos en los sitios de la lesión, mejorando los efectos de la terapia y reduciendo los efectos secundarios innecesarios. Las estructuras metalorgánicas (MOF), las nanopartículas típicas, una clase de materiales porosos cristalinos a través de enlazadores orgánicos autoensamblados e iones metálicos, exhiben una excelente biodegradabilidad, forma y tamaño de poros y una composición química finamente sintonizable. Los MOF tienen una estructura molecular rígida y el tamaño de poro ajustable puede mejorar la estabilidad del fármaco de encapsulación en condiciones adversas. Además, la superficie de las MOF se puede modificar con ligandos de molécula pequeña y biomoléculas, y unirse con los biomarcadores que se sobreexpresan en la superficie de las células cancerosas. Las formulaciones de MOF con fines terapéuticos se han desarrollado para responder eficazmente al microambiente tumoral único (TEM), como el H 2 alto O 2 niveles, hipoxia y glutatión de alta concentración (GSH). Por lo tanto, los MOF como sistema de administración de fármacos deben evitar que los fármacos se filtren durante la circulación sanguínea y se liberen en los sitios de la lesión mediante una forma de control. En este artículo, resumiremos los MOF sensibles al medio ambiente como sistemas de administración de fármacos para la terapia tumoral bajo diferentes estímulos.
Introducción
El tumor es una enfermedad multifactorial con altas tasas de mortalidad y recurrencia que amenaza la salud humana [1]. En las clínicas, los fármacos quimioterapéuticos y la cirugía aplicada para la terapia tumoral han logrado inhibir el tumor, pero a menudo con efectos secundarios graves, lo que nos impulsó a desarrollar métodos terapéuticos superiores [2, 3]. Durante las últimas décadas, se han desarrollado nanoportadores para la obtención de imágenes de tumores, la terapia y la terapia [4].
En todo tipo de nanoportadores, los marcos organometálicos (MOF) han atraído una atención cada vez mayor, ya que pueden ser estimulados por diferentes entornos [5, 6]. Los MOF, como una clase de materiales porosos inorgánicos-orgánicos altamente cristalinos, consisten en iones metálicos o grupos unidos por ligandos puente orgánicos y han atraído una gran atención en los últimos años en diferentes campos [7]. Antes de la década de 1990, los MOF se aplicaron ampliamente en el almacenamiento de gas, la catálisis de separación, la conversión de energía, la luminiscencia y la detección química y el campo biomédico, debido a su composición química finamente sintonizable, forma y tamaño de poros, morfología, gran área de superficie y excelente biodegradabilidad. [8, 9].
Los MOF tienen sitios orgánicos activos y arquitecturas porosas accesibles y abiertas, estabilidad química y suficientes efectos térmicos [10]. Por lo tanto, varios grupos funcionales pueden integrarse en MOF a través de tres estrategias:encapsulación, injerto e infiltración, que pueden mejorar su biocompatibilidad, solubilidad e interactividad con moléculas diana [11]. En particular, el enfoque de encapsulación a través de coprecipitación y método de mineralización biomimética es el enfoque rápido y conveniente que utiliza ligandos orgánicos e iones metálicos para lograr la integración de fármacos en MOF en un solo paso [12, 13]. Inspirándose en estos excelentes méritos, se han elaborado varios métodos para identificar su viabilidad y eficacia de uso. Sin embargo, los MOF pueden crecer fácilmente en diferentes sustratos para formar complejos multifuncionales [14]. Por lo tanto, algunos agentes terapéuticos pueden incorporarse directamente en los MOF a través del progreso de la síntesis, lo que puede evitar problemas de crecimiento de cristales cuando se aplican ligandos prefuncionalizados [15, 16]. Esta estrategia proporciona una alta economía atómica y conduce a cargas útiles de drogas extremadamente satisfactorias [14].
Aunque los MOF como sistema de administración de fármacos para la terapia tumoral tienen ventajas incomparables, su aplicación se ha visto restringida por muchos inconvenientes insolubles. Por ejemplo, los MOF son un progreso sintético complicado, eliminado por el sistema inmunológico del cuerpo y tiene una vida media corta en la sangre [17,18,19]. En este artículo, resumiremos algunos MOF sensibles a estímulos ambientales básicos para mejorar la terapia tumoral y revisar el estado actual de los teranósticos tumorales.
Respuesta a pH / ATP
Las estructuras de imidazolato zeolítico (ZIF), como la subclase específica de MOF, tienen un tamaño de poro ajustable, un área de superficie ultra grande y un progreso de síntesis fácil. Los ZIF se sintetizan a través de la mineralización biomimética y la coprecipitación que se utilizan como el portador de fármacos ideal para la terapia tumoral [20]. Además, las nanopartículas de ZIF pueden lograr el escape del endosoma, atribuido a la protonación del imidazol-2-carboxaldehído (2-ICA) en el endosoma ácido que impulsa el efecto de "esponja de protones" [21].
La terapia génica ha atraído gran atención tanto en la investigación básica como en la clínica de la terapia tumoral en las últimas décadas [22]. Sin embargo, los ácidos nucleicos desnudos se degradan fácilmente por la nucleasa del suero sanguíneo. Son demasiado grandes y frágiles para atravesar la membrana celular, lo que da lugar a resultados terapéuticos insatisfactorios [23, 24]. El marco orgánico zeolítico-8 (ZIF-8) se fabrica mediante el método de un solo recipiente mediante iones metálicos de baja toxicidad (Zn 2+ ) y 2-metilimidazol (2-Mim) en condiciones suaves. Tiene una excelente capacidad de encapsulación y protege a los genes contra la degradación enzimática [25]. Li y sus colaboradores proporcionaron un enfoque de un solo paso para cargar grandes moléculas de ADN plasmídico (pDNA) en sistemas poliméricos ZIF-8 y ZIF-8 mediante un enfoque de mineralización biomimética y coprecipitación (se muestra la figura 1A) [26]. Los sistemas poliméricos ZIF-8 y ZIF-8 exhiben una excelente capacidad de encapsulación, una buena distribución de la carga de ADNp contra la degradación enzimática y una mejor liberación sensible al pH. Es importante destacar que el sistema de polímero catiónico (PEI) de funcionalización de polímero catiónico (PEI) de mayor peso molecular (MW) mejora la interacción electrostática con el pDNA, mejorando la captación celular y el escape endo- / lisosómico, lo que da como resultado una expresión génica notable [27]. Por lo tanto, estos nanoportadores basados en polímeros ZIF-8 y ZIF-8 para terapia génica ofrecen un enfoque económico, conveniente y rápido para encapsular moléculas de genes para un transporte y expresión intracelular efectivos.
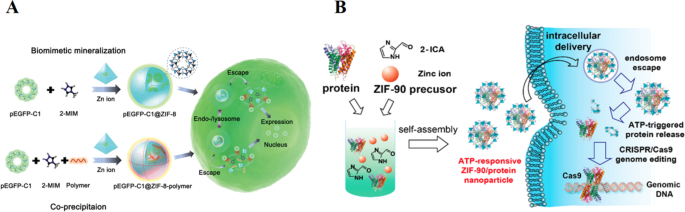
Copyright 2019 American Chemical Society. B Ilustración esquemática del autoensamblaje de nanopartículas de proteína ZIF-90 y liberación de proteína activada por ATP a partir de nanopartículas de ZIF-90 dentro de las células [29]. Copyright 2019 Sociedad Química Estadounidense
A Representación esquemática para la síntesis de nanoestructuras pEGFP-C1 @ ZIF-8 y nanoestructuras de polímero pEGFP-C1 @ ZIF-8 mediante el método de mineralización biomimética y coprecipitación, respectivamente, y su proceso de expresión y entrega celular [26].
La concentración de ATP es inferior a 0,4 mM en el extracelular. Sin embargo, la concentración aumenta en el citosol o en las células enfermas (1-10 mM) [28]. Por lo tanto, el sistema de administración de fármacos que responde a ATP abrirá una nueva ventana para la administración avanzada de fármacos para la terapia dirigida a enfermedades. Se muestra la Figura 1B, Yang et al. informó que el marco imidazol zeolítico 90 sensible al ATP (ZIF-90) es un nanoportador ideal para el suministro de proteínas citosólicas, que se preparó simplemente mezclando Zn 2+ e imidazol-2-carboxaldehído (2-ICA) en la solución de proteína [29]. En los sitios del tumor, los MOF de ZIF-90 / proteína tal como se preparan se degradarán gradualmente para liberar la proteína de precarga debido a la coordinación competitiva entre el Zn 2+ y ATP que desmonta ZIF-90 y la proteína liberadora puede inhibir eficazmente el crecimiento de células cancerosas. Por lo tanto, podemos especular que ZIP-90 MOF pueden encapsular proteínas de peso molecular independientemente del peso molecular y el tamaño de la proteína. Esto incluye superóxido dismutasa y albúmina de suero bovino con efectos mínimos sobre la función de las proteínas para la terapia de tumores.
Debido a la TME anormal, este sistema de administración de proteínas que responde a ATP ilustrado en esta sección no solo expande la química de las MOF en aplicaciones biomédicas, sino que también abre una nueva ventana para la administración de proteínas y la técnica de edición del genoma para la terapia de enfermedades dirigidas.
Responsivo a la luz
Como enfoque "verde", la terapia fototérmica tiene una toxicidad mínima para los tejidos circundantes, y se aplica ampliamente en la terapia tumoral [30, 31]. Las temperaturas elevadas pueden provocar daños graves e irreversibles en los tejidos cuando la temperatura se mantiene por encima de los 44 ° C. Es suficiente para causar daño a la membrana celular, disfunción mitocondrial y alteración de la síntesis de ARN para inducir la muerte celular [32]. A diferencia de los tejidos normales que pueden disipar el calor y mantener la temperatura constante mediante la circulación sanguínea a través de la neuromodulación, el bloqueo de la función reguladora autónoma convirtió a los tejidos tumorales en un depósito de calor. Esto proporciona una gran ventaja para la terapia fototérmica posterior [33].
Sobre la base de estos méritos mencionados anteriormente y la escasa capacidad de disipación del calor, la terapia basada en fotografías puede ser adecuada para la terapia de tumores. La terapia fotodinámica (TFD) es el enfoque típico de la terapia fototérmica, que está constituida por tres elementos básicos (irradiación de luz infrarroja cercana, abundante oxígeno y fotosensibilizadores) [34]. La irradiación de luz infrarroja cercana (luz NIR) como estímulo externo exhibe un alto control espacial y temporal del calentamiento local con efectos secundarios adversos mínimos [35, 36]. Los PS utilizaron el oxígeno circundante para generar especies de oxígeno reactivo venenosas (ROS) para destruir las células cancerosas bajo irradiación con láser [37, 38]. Como se muestra en la Fig. 2A, Park et al. diseñó una estructura organometálica porfirínica basada en Zr (IV) (Zr-MOF) que puede generar ROS bajo luz NIR [39]. Al inyectarse en el cuerpo, Zr-MOF puede acumularse en los tejidos tumorales a través de los efectos mejorados de permeabilidad y retención (EPR). Sin embargo, la capacidad de focalización no fue satisfactoria, lo que podría aumentar los efectos secundarios innecesarios [40]. Por lo tanto, Zr-MOF se modificó aún más con ácido fólico, mejorando la capacidad de focalización de Zr-MOF durante el tiempo de circulación sanguínea y mejorando la eficacia de la TFD.
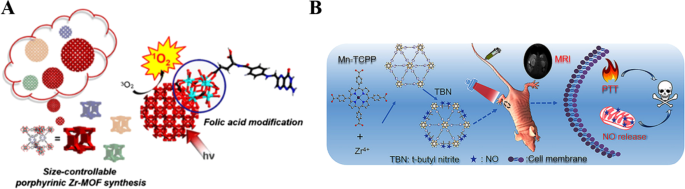
Copyright 2018 American Chemical Society. B Esquema para la síntesis del nanocompuesto NMOF-SNO y la liberación de NO activada por luz NIR y PTT [42]. Copyright 2018 Sociedad Química Estadounidense
A Ilustración de la estructura del PCN-224. Zr 6 de 6 conectados grupo (Zr 6 O 4 (OH) 4 (H 2 O) 6 (OH) 6 (Director de operaciones) 6 ), enlazador tetratópico (tetraquis (4-carboxifenil) porfirina (H 2 TCPP)) y el marco nanoporoso 3D de PCN-224. (b) Una unidad cúbica de PCN-224 e ilustración esquemática de nanopartículas esféricas de PCN-224 sobre la base de la construcción de unidades cúbicas, obteniendo diferentes tamaños [39].
Con la ayuda de agentes de contraste, esto puede proporcionar una navegación precisa de la terapia y determinar el tiempo terapéutico adecuado [41. Como se muestra en la Fig. 2B, Zhang y sus colaboradores desarrollaron MOF de Mn-porfirina mediante el autoensamblaje de Mn-tetrakis (4-carboxifenil) porfirina y Zr 4+ iones, que dotan a los MOF de Mn-porfirina con la formación de imágenes por resonancia magnética (MRI) y la capacidad de conversión fototérmica sin aumentar el tedioso progreso de síntesis [42]. Estos nuevos MOF pueden conjugarse aún más con el tipo s-nitrosotiol (SNO) de donante NO inestable al calor [43]. Por lo tanto, esta plataforma MOF puede lograr el tratamiento sinérgico de NO fototérmico y guiado por resonancia magnética. Los MOFs-SNO pueden acumularse de manera eficiente en las áreas del tumor mediante inyección intravenosa y lograr una alta capacidad de conversión fototérmica para PTT y controlar la liberación de NO para la terapia sinérgica de NO con menos daño fotoeléctrico. Por lo tanto, los agentes teranósticos integrados en los MOF son un enfoque factible para mejorar el diagnóstico y proporcionar una navegación precisa de la terapia y determinar el tiempo terapéutico adecuado.
Debido a que la porfirina libre tiene propiedades ópticas, cuando la porfirina se integra en los MOF, los MOF de porfirina obtenidos tienen imágenes de fluorescencia y TFD, lo que abre nuevas oportunidades para los teranósticos tumorales de próxima generación.
H 2 O 2 Responsive
Niveles altos de H 2 O 2 , la hipoxia, el valor de pH bajo y la concentración alta de glutatión (GSH) son características comunes en el microambiente tumoral (TME) [44,45,46]. Por lo tanto, mejorar o cambiar la TME única puede inhibir el crecimiento tumoral y mejorar los efectos terapéuticos [47, 48]. Muchas publicaciones han informado que MnO 2 tiene actividad nanoenzimática puede descomponerse en Mn 2+ y libere la cantidad O 2 bajo las circunstancias de H 2 O 2 , que puede aumentar la concentración de oxígeno dentro de los tumores sólidos y generar abundantes especies reactivas de oxígeno (ROS) bajo irradiación con láser [49, 50]. ROS, como sustrato químico intracelular, puede modular la señal celular y desempeñar un papel importante en el ciclo celular [51]. Importante, las células cancerosas son más sensibles a niveles altos de ROS y susceptibles a la apoptosis [52]. Como muestra la Fig. 3, Sun et al. albúmina de suero bovino construido-MnO 2 / clorina e6 @ ZIF-8 (BSA-MnO 2 / Ce6 @ ZIF-8) nanosistema presenta pH / H 2 O 2 controlabilidad para O 2 capacidad de producción, que ofreció un progreso seguro y eficiente en la administración de la terapia con TFD [53]. El fotosensibilizador de clorina e6 (Ce6) que se carga en el ZIF-8 puede resolver el problema de baja disolubilidad en el entorno acuoso y generar ROS para inducir la apoptosis y necrosis de las células cancerosas bajo irradiación láser de 650 nm. Albúmina de suero bovino (BSA) -MnO 2 decorado en la superficie de Ce6 @ ZIF-8, el BSA-MnO 2 obtenido / Ce6 @ ZIF-8 tiene una excelente dispersabilidad, baja toxicidad, suficiente capacidad de generación de oxígeno y efectos secundarios mínimos in vitro / in vivo. Este BSA-MnO 2 bien preparado / El nanosistema Ce6 @ ZIF-8 posee un pH / H 2 O 2 -sensible y sigue la TFD guiada por resonancia magnética, que tiene un enorme potencial para un diagnóstico más preciso y mejoras en los efectos antitumorales.
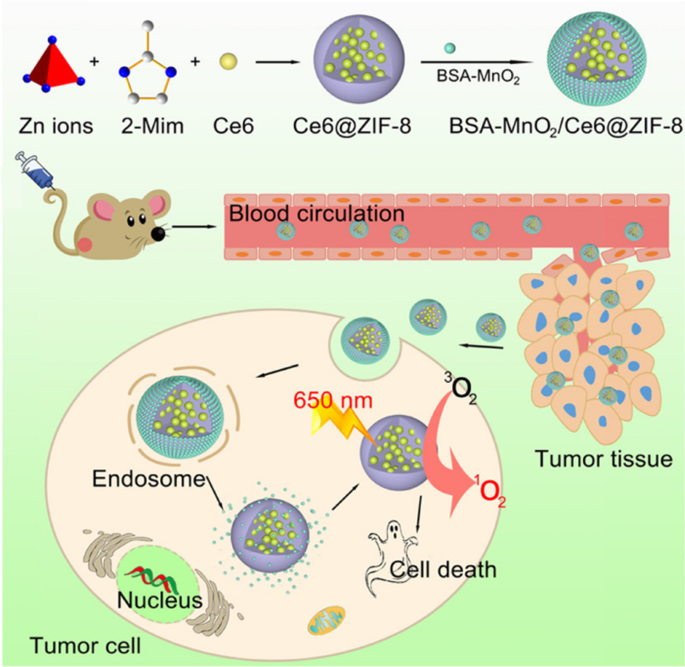
Copyright 2019 American Chemical Society
Ilustración esquemática para la formación de un BSA-MnO 2 / Ce6 @ ZIF-8 Nanoplataforma e ilustración esquemática que muestra la capacidad de respuesta de TME y la generación de irradiación ROS con láser NIR de 650 nm para el tratamiento del cáncer fotodinámico guiado por resonancia magnética [53].
Responsive GSH
La TFD ha logrado una clara ventaja en la terapia tumoral; una alta concentración de glutatión (GSH) en las células cancerosas (2–10 mM) no solo resiste la TFD, la radioterapia y la quimioterapia, sino que también sirve como antioxidante para eliminar las ROS celulares y compromete gravemente la aplicación de la TFD [54, 55]. Más específicamente, se ha informado de que las ERO excesivas pueden causar inflamación en los tejidos tumorales y fototoxicidad grave en los tejidos normales [56, 57]. Por lo tanto, es urgente desarrollar un sistema de MOF inteligente, que pueda lograr simultáneamente la generación de ROS mediada por PS y reducir los efectos negativos del GSH intracelular sobre la citotoxicidad de ROS en las áreas tumorales.
Para cumplir con estos requisitos, Wan et al. proporcionó un nanosistema de MOFs sellados con Mn (III) desbloqueado con GSH para experimentar una desintegración reductora por GSH de alto nivel en sitios tumorales. Esto puede controlar el agotamiento de GSH y la generación de ROS exhibió una inhibición tumoral completa al mejorar los efectos terapéuticos de la TFD (se muestra la Fig. 4A) [58]. Sin embargo, el principal desafío de los MOF en aplicaciones médicas es su biocompatibilidad desfavorable y su corta vida media en sangre. Por lo tanto, muchas estrategias para optimizar la aplicación in vivo de MOF han atraído una atención significativa [59]. Inspirándose en las células sanguíneas circulantes, el encubrimiento biomimético con la membrana plasmática es un enfoque poderoso para coordinar el destino de los nanomateriales inorgánicos in vivo [60,61,62]. Como se muestra en la Fig. 4B, Min y sus colegas ilustraron nanopartículas de MOF biomiméticos multifuncionales con un camuflaje de membrana celular de cáncer de mama 4T1 para la terapia anticancerígena sinérgica de la TFD y la antiangiogénesis [55]. Dicho diseño puede mantener las proteínas de superficie heredadas de las células del donante y dotar a las células 4T1 decoradas de MnO 2 Zr-MOF porfirínico recubierto cargado con receptor 2 del factor de crecimiento endotelial vascular 2 MOF (aMMTm) función biológica adicional para escapar del reconocimiento de macrófagos y diana tejido tumoral a través de afinidad homotípica in vivo. Más importante aún, MnO 2 decorado en la superficie de los MOF para neutralizar los altos niveles intratumorales de GSH y H 2 O 2 para mejorar el microambiente tumoral único, que puede mejorar los resultados de la TFD. Cuando el MnO 2 el caparazón se degradó gradualmente, el Mn 2+ liberado puede actuar como un agente de contraste de resonancia magnética y apatinib neutralizó la revascularización inducida por la TFD y evitó el progreso del tumor. Creemos que este sistema de administración de fármacos multifuncional tiene una enorme capacidad potencial en la personalización basada en mecanismos de la terapia antitumoral.
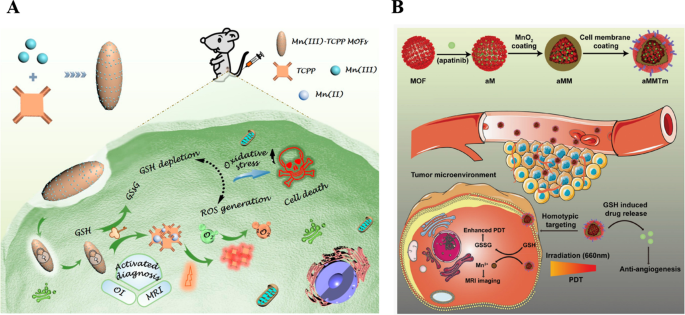
Copyright 2019 American Chemical Society. B Ilustración esquemática de la preparación de aMMTm y la terapia de combinación propuesta de TFD y antiangiogénesis [55]. Copyright 2019 WILEY – VCH Verlag GmbH &Co. KGaA, Weinheim
Ilustración esquemática de un nanosistema MOF sellado con endocitosis Mn (III) para MRI y TFD guiada por OI mediante la generación controlada de ROS y el agotamiento de GSH después de ser desbloqueado por GSH sobreexpresado en células tumorales [58].
El nanosistema biomimético fabricado para la terapia tumoral sinérgica guiada por imágenes duales era un sistema teranóstico simple, que allanaría una nueva vía para el diagnóstico y la terapia de tumores.
Sulfuro de hidrógeno (H 2 S) Responsive
Sulfuro de hidrógeno endógeno (H 2 S), como tercer gasotransmisor, se genera a partir del sistema enzimático de la cistationina β-sintasa mediante el proceso de catálisis [63, 64]. Los MOF basados en Cu tienen una fuerte capacidad de unión de Cu 2+ con S 2− , y su actividad inherente de Cu 2+ poseía una mayor actividad catalítica en ácido [65]. En los últimos años, se han aprovechado los Cu-MOF para detectar el H 2 tóxico S gas en el suero o en la solución [66]. Por lo tanto, H 2 S puede reconocerse como una "señal diana" específica para el diagnóstico y la terapia de tumores de ovario y colon [67]. Como se muestra en la Figura 5, Li y sus colaboradores proporcionaron H 2 endógeno El Cu-MOF activado por S está en el estado "APAGADO" y no hay adsorción obvia en la región NIR. Sin embargo, cuando las Cu-MOF entraron en los tejidos del tumor de colon donde H 2 S se sobreexpresó, los Cu-MOF pueden cambiar al estado "ON" al reaccionar con niveles altos de H 2 S para generar sulfuro de cobre fotoactivo con una absorción NIR más fuerte, que promovió la terapia fototérmica (PTT) [68]. Cu-MOF tiene la actividad de imitación de peroxidasa y reacciona con H 2 sobreexpresado O 2 para producir radicales hidroxilo tóxicos para la terapia hemodinámica después de ser endocitosados por las células cancerosas [69]. Por lo tanto, H 2 La estrategia de "activación" de activación S exhibe excelentes resultados antitumorales y evita efectos secundarios innecesarios en la terapia tumoral. Este H 2 El nanoportador activado por S puede inhibir significativamente las células de cáncer de colon que crecen in vivo, y los agentes terapéuticos activados por este biomarcador muestran un enorme potencial para el diagnóstico y la terapia de tumores.
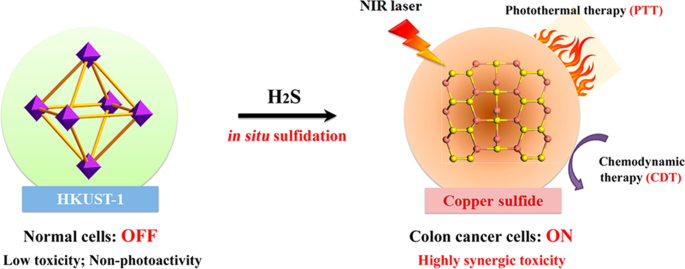
Copyright 2020 American Chemical Society
Ilustración esquemática del H 2 Transformación activada por S de nanoenzimas de Cu-MOF no fotoactivas en un agente fototérmico casi activable por NIR mediante la reacción de sulfifidación in situ y su terapia fototérmica y quimiodinámica sinérgica adicional para el cáncer de colon [68].
Perspectivas
Los MOF, como sistemas de administración de fármacos para la terapia tumoral, muestran ventajas incomparables debido a sus características intrínsecas, que incluyen estabilidad estructural, alta porosidad, multifuncionalidad y biocompatibilidad. Aunque los MOF han logrado un progreso impresionante en el campo biomédico, es necesario abordar varios problemas clave antes de que se pueda permitir que los MOF pasen a las etapas de traducción clínica. Estos incluyen síntesis complejada, eliminación temprana por parte del sistema inmunológico del cuerpo, toxicidad del sistema, farmacocinética y biodistribución insatisfactorias, acumulación fuera del objetivo y capacidad de liberación prematura del fármaco.
Para resolver estos problemas de niveles múltiples, el encubrimiento biomimético con la membrana plasmática es una estrategia poderosa para ajustar el destino de los MOF in vivo. Se han aplicado ampliamente todo tipo de membranas celulares para camuflar MOF. Este enfoque biomimético puede formar MOF con la biointerfaz de las membranas celulares, lo que puede mantener las proteínas de superficie heredadas de la célula donante, reducir su eliminación del sistema inmunológico del cuerpo para prolongar su vida media en la sangre y mejorar los MOF acumulados en la sangre. tejidos tumorales a través de efectos de permeabilidad y retención. Sobre la base de estos méritos, la membrana celular y los MOF combinaron plataformas biomiméticas para maximizar los agentes terapéuticos para los tejidos tumorales y lograr de manera efectiva la terapia tumoral.
Especialmente, los vasos sanguíneos cancerosos distorsionados y la rápida proliferación de las células cancerosas causarían baja concentración de oxígeno y acidificación en el microambiente tumoral (TME). La hipoxia, el pH bajo y la concentración alta de GSH son las características comunes en la TEM, que promueven la metástasis del cáncer y la angiogénesis y conducen a la resistencia terapéutica y comprometen los resultados de la terapia. El desarrollo de MOF inteligentes y sensibles al entorno que se desencadenan por el microambiente del tumor es un enfoque factible para la elevación sustancial del diagnóstico preciso y la reducción de los efectos secundarios innecesarios en la terapia del tumor.
Conclusión
En este artículo, resumimos varios tipos de MOF en función de sus mecanismos y estructuras únicos. El diseño complejo, los altos costos operativos y los largos pasos de preparación son obstáculos que encuentran los MOF en su aplicación real en el campo clínico. En última instancia, la administración dirigida, la toxicidad baja o nula y los efectos terapéuticos sobresalientes son los factores críticos para traducir con éxito los MOF a la aplicación clínica.
Disponibilidad de datos y materiales
No aplica.
Nanomateriales
- Nanofibras y filamentos para una mejor administración de fármacos
- Administración de medicamentos basados en células para aplicaciones de cáncer
- Pez cebra:un sistema modelo en tiempo real prometedor para la administración de fármacos neuroespecíficos mediada por nanotecnología
- Nanopartículas de lípidos de PLGA trazadas con 131I como portadores de administración de fármacos para el tratamiento quimioterapéutico dirigido del melanoma
- Nanotecnología:del sistema de imágenes in vivo a la administración controlada de fármacos
- Nanoportadores basados en lípidos y nucleósidos para la administración de sorafenib
- Nanoconjuntos de ácido 5-aminolevulínico-escualeno para fotodetección y terapia de tumores:estudios in vitro
- Investigación sobre las características fisicoquímicas de un sistema basado en nanoliposomas para la administración dual de fármacos
- Decoración de nanovesículas con péptido de inserción de pH (bajo) (pHLIP) para entrega dirigida
- Un papel emergente para IoT en el sistema de prestación de atención médica
- Los microrobots impresos en 3D son prometedores para la administración de medicamentos



