Síntesis verde de nanopartículas de metal y óxido de metal y su efecto sobre el alga unicelular Chlamydomonas reinhardtii
Resumen
Recientemente, la síntesis verde de nanopartículas metálicas ha atraído una gran atención debido a su viabilidad y su muy bajo impacto ambiental. Este enfoque se aplicó en este estudio para sintetizar materiales a nanoescala de oro (Au), platino (Pt), paladio (Pd), plata (Ag) y óxido de cobre (CuO) en medios acuosos simples utilizando el polímero natural goma karaya como reductor y agente estabilizador. El potencial zeta, la estabilidad y el tamaño de las nanopartículas (NP) se caracterizaron mediante Zetasizer Nano, espectroscopía UV-Vis y microscopía electrónica. Además, el efecto biológico de los NP (rango de concentración 1.0-20.0 mg / L) sobre un alga verde unicelular ( Chlamydomonas reinhardtii ) se investigó evaluando el crecimiento de algas, la integridad de la membrana, el estrés oxidativo, la clorofila ( Chl ) fluorescencia y eficiencia fotosintética del fotosistema II. Las NP resultantes tenían un tamaño medio de 42 (Au), 12 (Pt), 1,5 (Pd), 5 (Ag) y 180 (CuO) nm y mostraron una alta estabilidad durante 6 meses. A concentraciones de 5 mg / L, las NP de Au y Pt solo redujeron ligeramente el crecimiento de algas, mientras que las NP de Pd, Ag y CuO inhibieron completamente el crecimiento. Los NP de Ag, Pd y CuO mostraron fuertes propiedades biocidas y pueden usarse para la prevención de algas en piscinas (CuO) o en otras aplicaciones antimicrobianas (Pd, Ag), mientras que Au y Pt carecen de estas propiedades y pueden clasificarse como inofensivos para las algas verdes. .
Antecedentes
Las nanopartículas (NP) de metales y óxidos metálicos han recibido una atención considerable en la investigación debido a sus excepcionales propiedades eléctricas, ópticas, magnéticas y catalíticas. Estos han permitido su amplio uso en diversas aplicaciones industriales, médicas, agrícolas y ambientales, con nuevos usos en constante desarrollo [1, 2, 3, 4]. Los métodos tradicionales de síntesis de NP de metales prístinos y óxidos metálicos incluyen agentes químicos reductores y estabilizadores que son tóxicos para los seres humanos y para otras especies en diferentes niveles tróficos [5,6,7,8,9,10,11]. En respuesta, los investigadores ahora están buscando enfoques alternativos de "síntesis verde" en un esfuerzo por reducir o eliminar las sustancias químicas nocivas durante la producción de NP [12,13,14,15,16,17,18].
Muchos estudios han informado sobre la amplia gama de aplicaciones de NP de metales y óxidos metálicos, debido a sus propiedades fisicoquímicas únicas y de amplio espectro [19]. Los NP de plata (Ag), por ejemplo, se utilizan ampliamente para aplicaciones médicas, textiles, de envasado de alimentos y de tratamiento de agua [20, 21, 22, 23]. Los NP de oro (Au) se han empleado en la investigación biomédica, mientras que los NP de platino (Pt) se utilizan ampliamente para aplicaciones industriales debido a sus propiedades catalíticas [24, 25]. Por último, los NP de paladio (Pd) se han utilizado como catalizadores durante la fabricación de productos farmacéuticos [26, 27] y los NP de óxido de cobre (CuO) como agentes antiincrustantes en pinturas y tejidos debido a sus probadas propiedades antibacterianas [28]. Los NP metálicos pueden servir como catalizadores para degradar una amplia variedad de contaminantes ambientales comunes, incluidos los bifenilos policlorados (PCB), los alifáticos halogenados, los plaguicidas organoclorados, los metales tóxicos y los disolventes orgánicos halogenados [29]. Los NP de CuO, Ag y Au también se utilizan para detectar gases venenosos, como el monóxido de carbono (CO), el cianuro de hidrógeno (HCN) y el dióxido de azufre (SO 2 ) [30, 31]. Recientemente, una serie de NP de metal (Au, Ag y Cu) que exhiben resonancia de plasmón de superficie localizada se han utilizado en el desarrollo de bio-nanosensores [24].
Desafortunadamente, los NP de metales y óxidos metálicos tienen el potencial de afectar negativamente tanto a la salud humana como al medio ambiente en general, p. Ej. mediante la generación de nuevas clases de toxinas que pueden afectar negativamente a las comunidades microbianas, con efectos en cadena para todo el ecosistema [32,33,34,35]. Como resultado, los efectos de los NP sobre los microorganismos se han estudiado ampliamente. Se ha demostrado que las NP de Ag, por ejemplo, inhiben el crecimiento de algas y la fotosíntesis, cambiando la clorofila ( Chl ) contenido de fluorescencia de Chlamydomonas reinhardtii [36], alterando el crecimiento celular de Thalassiosira pseudonana y Synechococcus sp. [37] y afectando el crecimiento y la viabilidad celular en la planta acuática hinchada lenteja de agua Lemna gibba [38] . Książyk y col. [39] y Sørensen et al. [40] han informado que las NP de Pt inhiben el crecimiento en las microalgas de agua dulce Pseudokirchneriella subcapitata [39, 40]. Como era de esperar, tanto las NP de Ag como las de Pd se han aplicado como agentes antibacterianos útiles contra una variedad de bacterias Gram positivas y Gram negativas [41,42,43]. Por el contrario, se cree que las NP de Au no tienen un impacto negativo sobre las bacterias o las algas [44, 45], aunque un estudio ha demostrado que pueden ser tóxicas, según su carga y la química de la superficie [46]. Se han informado impactos negativos para los NP de CuO en C. reinhardtii [36, 47], P. subcapitata [48], alga acuática occidental Elodea nuttallii [49] lenteja de agua Lemna sp . , Daphnia magna [48] y las primeras etapas de la vida del pez cebra Danio rerio [50, 51].
Los NP metálicos poseen propiedades físicas y químicas que pueden causar daño celular, p. Ej. a través de la generación excesiva de especies reactivas de oxígeno (ROS) con el consiguiente daño al ADN, proteínas y lípidos. Se ha detectado la formación de ROS por NP de Ag en Chlorella vulgaris y Dunaliella tertiolecta culturas y en L. gibba [52], así como en bacterias [53]. Las NP de CuO y Fe son capaces de generar radicales de hidrógeno, una familia de ROS producidos a través de la reacción de Fenton, que puede dañar una variedad de organismos acuáticos y terrestres [54, 55].
La química verde es un conjunto de principios o prácticas que fomentan el diseño de productos y procesos que reducen o eliminan el uso y generación de sustancias peligrosas [56,57,58]. Las prácticas actuales de nanotecnología verde implican a menudo el uso de fuentes naturales, disolventes no peligrosos, materiales biodegradables y biocompatibles y procesos energéticamente eficientes en la preparación de NP [59]. A modo de ejemplo, los biopolímeros, como la celulosa, el quitosano, el dextrano o las gomas de árbol, se utilizan a menudo como agentes reductores y estabilizantes para la síntesis de NP de metales [12, 60,61,62]. La goma karaya (GK) utilizada en este estudio es una goma de árbol natural de Sterculia que consta de aproximadamente 13-26% de galactosa y 15-30% de ramnosa, 30-43% de ácido galacturónico, 37% de residuos de ácido urónico y aproximadamente 8% de grupos acetilo [63]. Los estudios toxicológicos demostraron que GK no es tóxico, lo que permite su uso incluso como aditivo alimentario [62,63,64,65].
En este estudio, nuestro objetivo fue utilizar un enfoque de química verde para preparar una serie de NP de metal (Ag, Au, Pt, Pd) y óxido de metal (CuO) utilizando soluciones acuosas de un polímero natural, GK. El efecto biológico de estas NP recién preparadas se investigó en C. reinhardtii utilizando una variedad de respuestas celulares, incluido el crecimiento de algas, el estrés oxidativo, el daño de la membrana, Chl fluorescencia y fotosíntesis. La estabilidad, el tamaño y el potencial zeta del NP se determinaron en un medio de crecimiento de algas, junto con la solubilidad y las pruebas abióticas de la generación de ROS.
Métodos
Materiales
GK comercial, nitrato de plata (AgNO 3 ), tetracloroaurato de hidrógeno (HAuCl 4 · 3H 2 O), cloruro de cobre (CuCl 2 · 2H 2 O), ácido cloroplatínico (H 2 PtCl 6 ), tetracloropalladato de potasio (II) (K 2 PdCl 4 ), cloruro de hidrógeno (HCl), hidróxido de sodio (NaOH) e hidróxido de amonio (NH 4 OH) se adquirieron todos de Sigma-Aldrich, EE. UU. Se usó agua desionizada (DI) para todos los experimentos. Todos los productos químicos y reactivos utilizados en este estudio fueron de grado analítico.
El C. reinhardtii El cultivo de algas (cepa CPCC11) se obtuvo del Canadian Phycological Culture Centre (CPCC, Departamento de Biología, Universidad de Waterloo, Canadá).
Procesamiento de GK
Se introdujo polvo de GK (1 g) en un vaso de precipitados de vidrio que contenía 1 l de agua DI y se agitó suavemente durante la noche en un agitador magnético. Posteriormente, la solución de goma se dejó a temperatura ambiente (20 ° C) durante 18 h para separar cualquier materia no disuelta. Luego, la solución de goma se filtró a través de un embudo de vidrio sinterizado (tamaño de poro de 10 a 16 μm) y la solución transparente se liofilizó y almacenó hasta que se necesitó.
Síntesis de NP de metales y óxidos metálicos mediante GK
Brevemente, alícuotas de 100 μL de AgNO 3 10 mM , HAuCl 4 , H 2 PtCl 6 y K 2 PdCl 4 se añadieron soluciones a 10 ml de solución acuosa de GK en matraces cónicos separados de 50 ml. El pH de la dispersión coloidal se ajustó añadiendo HCl 0,1 N o NaOH 0,1 N con el fin de lograr el máximo rendimiento de formación de NP. Para sintetizar los NP de Ag, Au, Pt y Pd, el AgNO 3 , HAuCl 4 , H 2 PtCl 6 y K 2 PdCl 4 y las mezclas de GK se agitaron en un agitador orbital Innova 43 (New Brunswick Scientific, EE. UU.) a 250 rpm a temperaturas que oscilan entre 45 y 95 ° C durante 1 h. Las soluciones se volvieron de color amarillo claro, rojo vino, negro intenso y negro apagado, respectivamente, lo que indica la formación de NP de Ag, Au, Pt y Pd. En el caso del Pt, la reducción y formación de NP ocurrió a un pH de 8.0 y una temperatura de 90 ° C, mientras que las NP de Pd se formaron a pH 8.5 y 95 ° C. Ver más en Padil et al. [66, 67].
Las NP de CuO se sintetizaron mediante un proceso de síntesis térmica coloidal [13]. Brevemente, alícuotas de 100 μL de una solución 10 mM de cloruro de cobre dihidrato (CuCl 2 · 2H 2 O) se mezcló con 10 mL de la solución GK (100 mg dispersos en 10 mL de agua desionizada) y NaOH en matraces cónicos separados de 50 mL, con CuCl 2 · 2H 2 O y NaOH mantenidos en una relación molar de 2:5. La mezcla que contiene el CuCl 2 · 2H 2 O y GK se agitaron a 250 rpm a una temperatura de 75 ° C durante 1 h en un agitador orbital. El color de la mezcla cambió gradualmente de azulado a negro, lo que indica la formación de NP de CuO. El precipitado resultante se obtuvo por centrifugación y se lavó primero con etanol y luego con agua desionizada.
Caracterización de NP sintetizadas en verde
La concentración de metal dentro de las NP recién sintetizadas se midió mediante espectrometría de masas de plasma acoplado inductivamente (ICP-MS, OPTIMA 2100 DV, Perkin Elmer).
La formación y estabilidad de los NP metálicos se evaluaron utilizando un espectrofotómetro Cintra 202 UV-Vis (GBC, Australia), determinándose la estabilidad del NP después de 6 meses.
Las imágenes de microscopía electrónica de transmisión (TEM) de las NP de Ag, Au, Pt, Pd y CuO se obtuvieron utilizando un microscopio Tecnai F 12 (FEI, Thermo Fisher Scientific, Oregón, EE. UU.) Que funciona a un voltaje de aceleración de 15 kV. Las muestras se prepararon para el análisis TEM dejando caer 10-20 μL de dispersión de NP inorgánico-GK en una rejilla de cobre y secando a temperatura ambiente, después de eliminar el exceso de solución.
Condiciones de cultivo de algas
Chlamydomonas reinhardtii se cultivó en medio TAPx4 (Archivo adicional 1:Tabla S1, información de apoyo) a 20 ° C en una incubadora (Infors, Suiza) equipada con un agitador que gira continuamente a 100 rpm y un régimen de iluminación de 114,2 μmol fot m - 2 s −1 . Las células de algas se cultivaron a un ritmo exponencial para obtener aproximadamente 10 6 células / mL.
Caracterización de NP en medio de exposición a algas
Distribución de tamaño NP en el C. reinhardtii El medio TAPx4 se midió usando la técnica de sedimentación centrífuga diferencial (DCS) en una centrífuga de disco DC24000UHR (CPS Instruments Inc., EE. UU.). Las mediciones se realizaron a una velocidad de rotación del disco de 24.000 rpm y la sedimentación de partículas se realizó utilizando un 8-24% ( w / w ) gradiente de densidad de sacarosa. Antes de cada medición de muestra, el instrumento se calibró utilizando estándares de nanoesferas de PVC (470 nm). Los NP también se caracterizaron por la movilidad electroforética, y se utilizó la aproximación de Smoluchowski para determinar el potencial zeta (ZP) en un Zetasizer ZS (Malvern Instruments Ltd., Reino Unido). Cada medición se realizó en 10 corridas con funciones de autocorrelación de 10 s, y cada resultado se obtuvo a partir de mediciones por triplicado de la misma muestra.
El método de ultrafiltración se utilizó para determinar la cantidad de iones metálicos en el medio de algas (Cheloni et al. [47]; Ma et al. [68]). Las alícuotas extraídas a diferentes intervalos de tiempo (2 y 24 h) se centrifugaron durante 30 min a 7500 rpm para separar las partículas y los agregados. A continuación, el sobrenadante se filtró a través de filtros de ultrafiltración Amicon Ultracel 3K con un límite de peso molecular de 3 kDa (Millipore, EE. UU.) Para separar los iones de las partículas. Las NP y los agregados con un diámetro superior a 1,3 nm se retuvieron en el filtro y el filtrado se analizó mediante ICP-MS en busca de iones disueltos [68].
La generación de ROS abióticos con una concentración creciente de NP en medio de algas se determinó utilizando diacetato de diclorodihidrofluoresceína fluorescente (H 2 DCF-DA, Sigma-Aldrich, Suiza), como se describe en estudios anteriores [47, 69].
Efecto de los NP sobre el crecimiento de las algas, la integridad de la membrana y la generación de estrés oxidativo
El efecto de las NP de metales y óxidos metálicos sobre el crecimiento de las algas, la integridad de la membrana y la generación de estrés oxidativo se evaluó mediante citometría de flujo (FCM; Citómetro de flujo BD Accuri C6, BD Biosciences, EE. UU.). El experimento se realizó en viales transparentes (PS, 50 mL, Semadeni, Suiza) que contenían 5 mL de suspensión de algas y NP en concentraciones de 1, 5, 10 y 20 mg / L. Las muestras de control sin NP se procesaron en paralelo. Las células de algas se calentaron en agua hirviendo (100 ° C) durante 15 min para proporcionar un control positivo de las membranas celulares dañadas. Las células de algas también se trataron con comino (Sigma-Aldrich, EE. UU.), Un agente de especies oxidativas, durante 30 minutos en la oscuridad como control positivo del estrés oxidativo (ROS). Todas las muestras no tratadas y las tratadas con NP se incubaron en condiciones similares a las adoptadas para el mantenimiento de cultivos. Se tomaron submuestras después de 1, 3, 5 y 24 h para evaluar el efecto de las NP sobre la integridad de la membrana celular y el estrés oxidativo utilizando FCM. Se transfirió una alícuota de 250 μl de cada muestra a una placa de fondo plano Microtiter® de 96 pocillos. Para evaluar la integridad de la membrana celular, se agregaron a la muestra sondas fluorescentes de yoduro de propidio (PI) (P4170, Sigma-Aldrich, EE. UU.) A una concentración final de 7 μM. Para la detección del estrés oxidativo, se agregó CellROX® Green Reagent (ROS) (C10444, Life Technologies, EE. UU.) A las muestras según las instrucciones del producto. En resumen, el PI se une al ADN y se une al ARN después de la penetración intracelular a través de las membranas celulares dañadas, pero se excluye de las células sanas. CellROX® Green Reagent es una sonda para medir el estrés oxidativo en células vivas. El tinte que penetra en las células es débilmente fluorescente mientras se encuentra en un estado reducido, pero exhibe una fluorescencia fotoestable de color verde brillante tras la oxidación por ROS y la posterior unión al ADN. Por tanto, su señal se localiza principalmente en el núcleo y las mitocondrias. Las placas se incubaron en la oscuridad durante 20 minutos (PI) y 30 minutos (ROS) antes de la medición de FCM. A continuación, las suspensiones de algas se pasaron a través del FCM con un láser de excitación azul de 488 nm. CellROX Green se midió en el canal FL1 533/30 nm, la fluorescencia roja PI en el canal FL2 585/40 nm y la autofluorescencia roja de la clorofila a ( Chla ) en canal FL3> 670 nm. El experimento se llevó a cabo por duplicado y se repitió.
Los datos de FCM se analizaron utilizando el software CFlow Plus (BD Biosciences, EE. UU.). Las muestras se seleccionaron según las propiedades de dispersión directa y la autofluorescencia roja de Chla , para eliminar señales de NP, escombros y otros contaminantes. La cantidad de células, el porcentaje de membranas celulares dañadas o células con estrés oxidativo y los datos de autofluorescencia se recuperaron en función de la autofluorescencia de Chla (670 nm), celdas etiquetadas con PI (585 nm) y ROS Green (533 nm) (Archivo adicional 1:Figura S1).
Eficiencia del fotosistema II de algas
Se agregaron suspensiones de NP de metal y óxido de metal al mismo cultivo de algas (aproximadamente 10 6 células / mL) en matraces de vidrio de 15 mL para lograr concentraciones finales de 1, 5, 10 y 20 mg / L. Se prepararon cultivos de algas sin NP como controles negativos. Luego, todas las muestras se transfirieron a una incubadora en las mismas condiciones utilizadas para los cultivos de algas originales. Se tomaron alícuotas (2,2 ml) de cada muestra inmediatamente y después de 1, 3, 5 y 24 h de incubación para detectar el rendimiento cuántico (QY) del fotosistema II utilizando un fluorómetro AquaPen-C AP-C 100 (PSI Ltd., República Checa República). Todas las mediciones se realizaron por triplicado. QY representa la proporción de fluorescencia variable ( F v = F m - F 0 ) hasta la máxima fluorescencia ( F m ), con QY = F v : F m utilizado como un proxy de la eficacia de extinción fotoquímica [70]. F m se obtuvo aplicando iluminación a 680 nm durante unos segundos antes y al final de la iluminación, con mínima fluorescencia ( F 0 ) siendo la medición inicial al nivel mínimo de fluorescencia en ausencia de luz fotosintética.
Análisis estadístico
El efecto de los NP de metales y óxidos metálicos sobre C. reinhardtii se probaron mediante el análisis de varianza ANOVA y la prueba de Dunnett (GraphPad PRISM, EE. UU.). Los niveles de significancia se establecieron en * P <0.05, ** P <0.01 y *** P <0,001.
Resultados
Formación y caracterización primaria de NP
Las imágenes TEM de NP de Ag, Au, Pt, Pd y CuO sintetizadas mediante GK muestran NP esféricas bien separadas con diámetros que van de 2 a 100 nm (Fig. 1a-e). Las soluciones acuosas de NP coloidales examinadas bajo espectroscopia UV-Vis (Fig. 1f) mostraron una resonancia de plasmón de superficie distinta a 412 y 525 nm, consistente con la formación de NP de Au y Ag dentro de la red GK. No se observaron resonancias de plasmón de superficie distintas para NP de Pt, Pd o CuO. Las mediciones de UV-Vis después de 6 meses confirmaron la estabilidad de todos los NP, mostrando los espectros un solo pico con un tamaño promedio similar al de los NP recién sintetizados (archivo adicional 1:Figura S2).
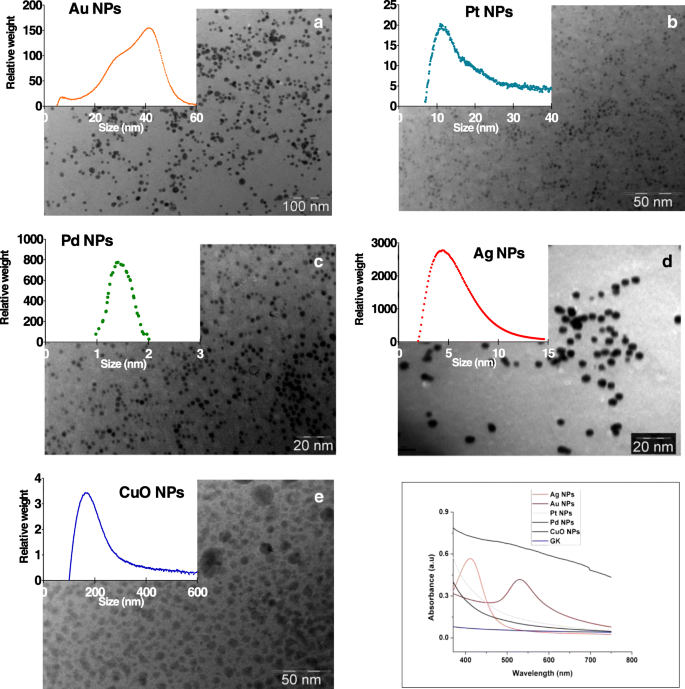
Imágenes de microscopía electrónica de transmisión de a Au, b Pt, c Ag, d Pd y e Nanopartículas de CuO sintetizadas mediante goma karaya y sus correspondientes sales metálicas. un , b , c , d y e Las inserciones de gráficos muestran la distribución máxima del tamaño de partícula por peso de nanopartículas en medios de algas, según lo determinado por sedimentación centrífuga diferencial. (F) Espectros UV-Vis para las nanopartículas de Au, Ag, Pt, Pd y CuO
Caracterización de NP en medio de exposición a algas
El tamaño de las NP, basado en la distribución del peso, varió de 180 a 5 nm de la siguiente manera:CuO> Au> Pt> Ag> Pd. Todas las NP se cargaron negativamente a pH 7 (Tabla 1 y archivo adicional 1:Figura S3). Las NP de Pt, Ag y CuO tenían las concentraciones de metales iónicos más altas (33–36 μg / L), y las NP de Au y Pt las más bajas (6–7 μg / L) (Tabla 1). Las formas iónicas de metales se detectaron en medio de algas (Tabla 1).
Efecto sobre el crecimiento de algas
C. reinhardtii la cultura tuvo una tasa de crecimiento de 1 × 10 6 células / h. En presencia de 1 mg / L de NP de Ag, Pd y CuO, la tasa de crecimiento disminuyó drásticamente a 2,2 × 10 4 , 1,7 × 10 4 y 0,2 × 10 4 células / h, respectivamente ( P <0,001). A medida que la concentración de NP aumentó aún más, el crecimiento de algas se inhibió por completo (Fig. 2). Cuando las algas fueron expuestas a NP de Au y Pt, la tasa de crecimiento también se redujo significativamente en comparación con el control ( P <0,001), pero el aumento de las concentraciones no aumentó el efecto.
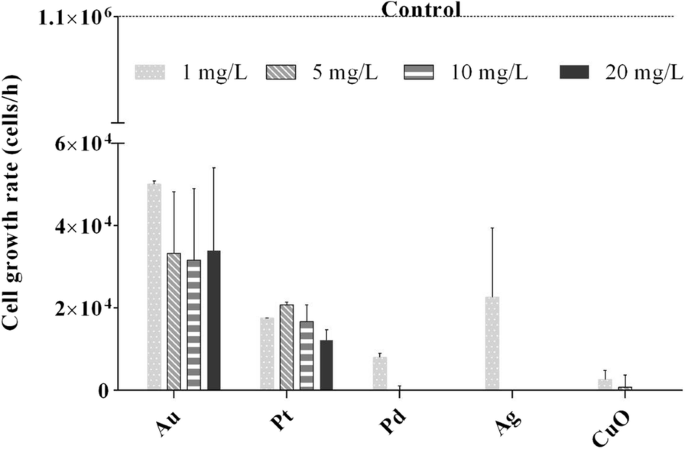
Tasa de crecimiento de Chlamydomonas reinhardtii expuestos a Au, Pt, Pd, Ag y CuO metal y nanopartículas de óxidos metálicos (1, 5, 10 y 20 mg / L). La tasa de crecimiento para el control no expuesto (cultivo de algas) fue 1 × 10 6 células / h después de 24 h. Las barras de error representan la desviación estándar de experimentos repetidos usando muestras duplicadas
Generación de estrés oxidativo en las células
El estrés oxidativo varió según el tipo de NP (Fig. 3). El efecto más alto, con casi el 100% de las células afectadas, fue causado por 5-20 mg / L de NP de Ag y CuO (Fig. 3d, ey Archivo adicional 1:Tabla S2). Cuando las células de las algas se expusieron a NP de Au, el estrés oxidativo fue mucho menor, y la mayoría de las células se vieron afectadas por debajo del 10%. Las concentraciones más altas de NP de Au (20 mg / L) afectaron solo al 15% de las células ( P <0,001). El porcentaje de células estresadas disminuyó gradualmente con el tiempo, sin que se detectara estrés oxidativo después de 24 h para todas las concentraciones de Au probadas (Fig. 3a). Las NP de Pt causaron estrés oxidativo en menos del 8% de las células de algas durante las primeras 5 h de exposición (Fig. 3b). Solo a concentraciones de 10 y 20 mg / L se generó estrés en el 10 y 19% de las células, respectivamente, después de 24 h ( P <0,001; Archivo adicional 1:Tabla S2), sin estrés detectado en concentraciones más bajas ( P > 0,1) tras 24 h de exposición (fig. 3b). La exposición a 1 mg / L de Ag NPs no indujo estrés oxidativo en las células de las algas durante un período de 24 h ( P > 0,9). Sin embargo, la exposición a 5 mg / L resultó en estrés oxidativo después de 5 h, y la exposición a 10 y 20 mg / L resultó en estrés oxidativo después de 3 h. Después de 24 h de exposición a Ag NP, el 100% de las células se estresaron ( P <0,001; Fig. 3c y archivo adicional 1:Tabla S2). Los NP de CuO indujeron ( P <0,001) el estrés oxidativo en las células de las algas más rápidamente (3 h) que los otros NP de metal probados a 10 y 20 mg / L (archivo adicional 1:Tabla S2), excepto para NP de Ag. El estrés oxidativo ya era significativo a 5 mg / L después de 5 h. Todas las concentraciones (> 5 mg / L) tuvieron un efecto significativo sobre el estrés oxidativo celular (Fig. 3d, e). Como parámetro complementario, también determinamos las ROS abióticas generadas por las NP. En contraste con C. reinhardtii tasa de crecimiento y porcentaje de C. reinhardtii células que exhiben estrés oxidativo, las NP de Au solo generaron un ligero aumento en las ROS abióticas ( P > 0,05; Archivo adicional 1:Figura S4).
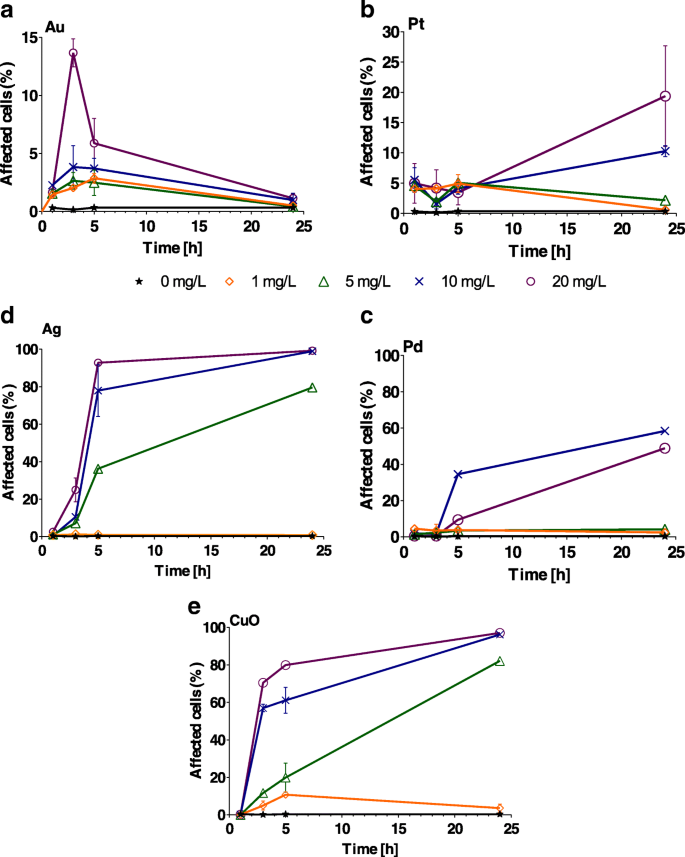
Porcentaje de Chlamydomonas reinhardtii células que presentan estrés oxidativo tras la exposición a concentraciones crecientes (1, 5, 10 y 20 mg / L) de a Au, b Pt, c Pd, d Ag y e Nanopartículas de CuO después de 1, 3, 5 y 24 h. Las barras de error representan la desviación estándar de experimentos repetidos usando muestras duplicadas. Nota diferente y -escalas de eje para Au y Pt
Efecto sobre la integridad de la membrana de las algas
Los NP de Au y Pt causaron importantes ( P <0,001) daño de la membrana celular en todas las concentraciones de 1 a 5 h (archivo adicional 1:Tabla S3); sin embargo, ningún efecto significativo ( P > 0,05) se observó después de 24 h (Fig. 4a, b). En el caso de las NP de Ag, el 100% de las células estaban dañadas ( P <0,001) después de 1 h de exposición a 1–20 mg / L (Fig. 4c, archivo adicional 1:Tabla S3, Ag). El porcentaje de membranas celulares dañadas después de la exposición a NP de 1 y 5 mg / L de Pd (archivo adicional 1:Tabla S3, Pd) fue comparable con el del control durante 24 h ( P > 0,4). Por otro lado, un daño significativo ( P <0,001) después de 24 h de exposición a NP de Pd de 20 mg / L (Fig. 4d). El efecto de CuO aumentó con el aumento de la concentración y el tiempo, logrando su mayor impacto después de 24 h (Fig. 4e y archivo adicional 1:Tabla S3).
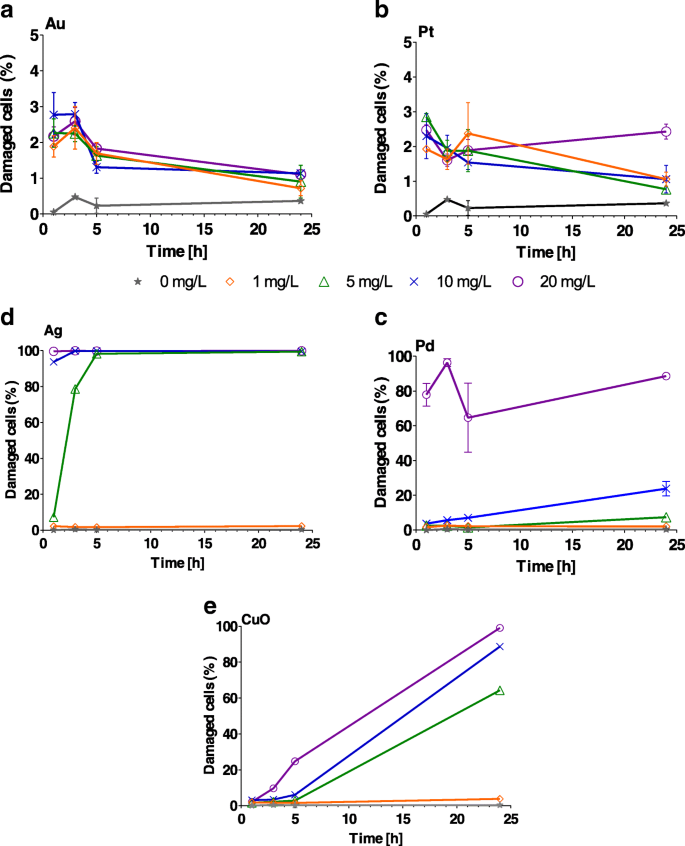
Porcentaje de Chlamydomonas reinhardtii células con membranas dañadas tras la exposición a concentraciones crecientes (1, 5, 10 y 20 mg / L) de a Au, b Pt, c Pd, d Ag y e Nanopartículas de CuO después de 1, 3, 5 y 24 h. Las barras de error representan la desviación estándar de experimentos repetidos usando muestras duplicadas. Nota diferente y -escalas de eje para Au y Pt
Efecto sobre la clorofila ( Chl ) Fluorescencia
Chl la fluorescencia no se vio afectada significativamente ( P > 0,1) por NP de Au en cualquier concentración durante el período de 24 horas y por Pt durante el período de 5 horas (Fig. 5a, by Archivo adicional 1:Tabla S4). Por otro lado, las NP de Ag, Pd y CuO inhibieron fuertemente ( P <0.001) Chl fluorescencia con concentración y tiempo de exposición crecientes, p. ej. Chl la fluorescencia se redujo del 98% (1 h) al 22% (24 h) ( P <0,001) cuando se cultivaron células de algas en presencia de 5 mg / L de Ag (Archivo adicional 1:Tabla S4). También se observó una reducción similar en la fluorescencia para 10 y 20 mg / L de Ag, con niveles que cayeron al 20 y 9% ( P <0,001), respectivamente (Fig. 5c). Los NP de CuO y Pd (ambos de 20 mg / L) provocaron una fuerte disminución en Chl fluorescencia después de 24 h ( P <0,001). No hubo ningún efecto observable ( P > 0,1), sin embargo, para 1 o 5 mg / L de Pd y para 1 mg / L de NP de Ag y CuO (Fig. 5c-e).
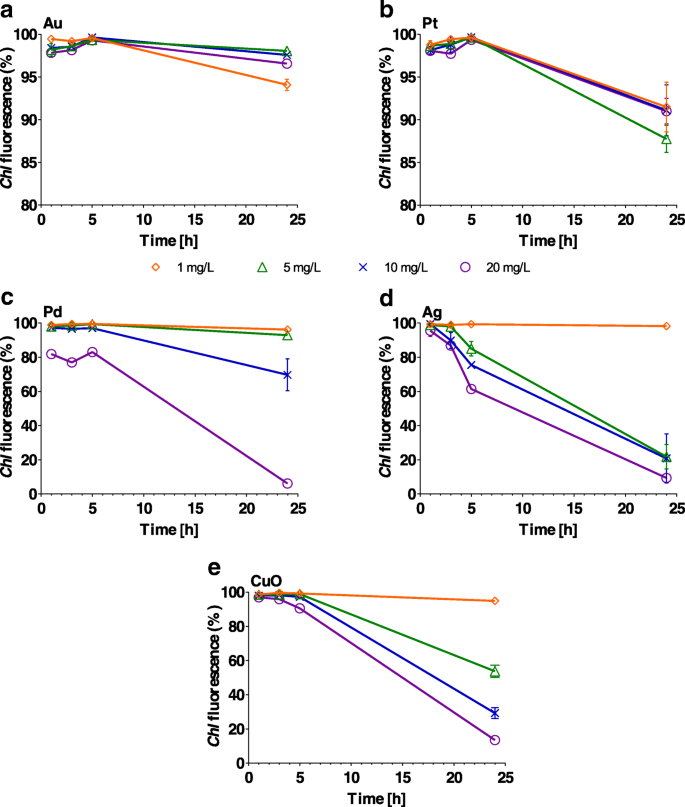
Porcentaje de Chlamydomonas reinhardtii células con clorofila ( Chl ) fluorescencia tras la exposición a concentraciones crecientes (1, 5, 10 y 20 mg / L) de a Au, b Pt, c Pd, d Ag y e Nanopartículas de CuO después de 1, 3, 5 y 24 h. Las barras de error representan la desviación estándar de experimentos repetidos usando muestras duplicadas
Efecto de los NP en el fotosistema II de algas
Los NP de Au, Pt y CuO tuvieron un efecto levemente significativo ( P <0.05) en el fotosistema II QY en algunos momentos durante el período de 24 horas a concentraciones que van desde 1 a 20 mg / L (Fig.6 y archivo adicional 1:Tabla S5). Por otro lado, QY se redujo significativamente ( P <0,001) después de solo 1 h después del contacto con Ag NP en todas las concentraciones (Fig. 6c y archivo adicional 1:Tabla S5). Los NP de Pd y CuO dieron como resultado una reducción significativa en QY a la concentración más alta de 20 mg / L (Fig. 6d, ey Archivo adicional 1:Tabla S5).
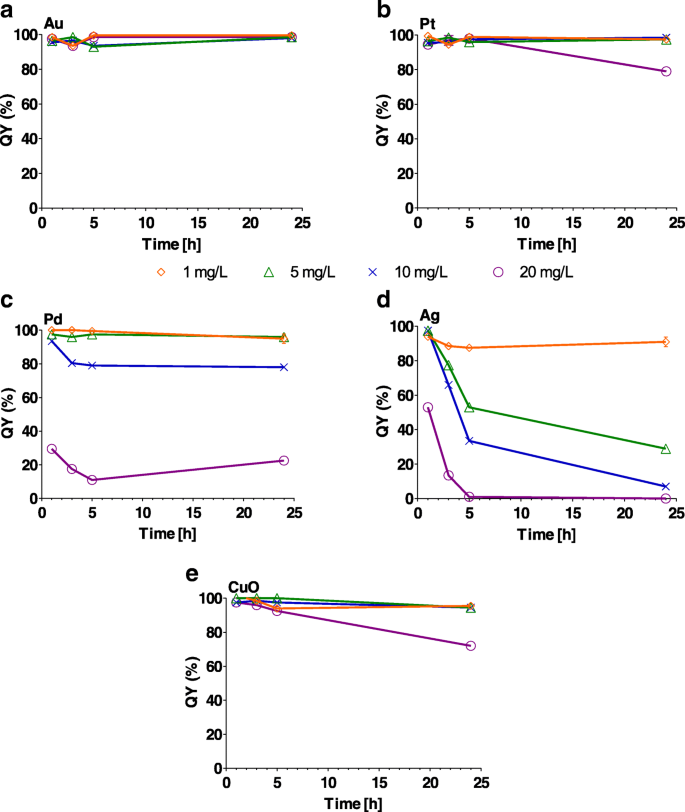
Efecto de a Au, b Pt, c Pd, d Ag y e Nanopartículas de CuO (1, 5, 10 y 20 mg / L) sobre la eficiencia del fotosistema II (QY%) después de 1, 3, 5 y 24 h. Cien por ciento el y -eje representa el QY del cultivo de algas de control sin nanopartículas. Las barras de error representan la desviación estándar de experimentos repetidos de muestras duplicadas
Discusión
En el presente trabajo, nuestro objetivo fue explorar la eliminación de la producción de desechos tóxicos durante la síntesis de metales y nanomateriales de óxidos metálicos en la implementación del enfoque de la química verde [16, 57, 58], con el mayor énfasis en el uso de dispersantes ambientalmente benignos y Materiales renovables y biodegradables. Utilizamos con éxito GK, un material natural, renovable y biodegradable para la síntesis y estabilización de una variedad de NP. Utilizando agua DI como disolvente, los grupos funcionales presentes en GK (es decir, –OH y –COO–) actuaron como agentes reductores y el propio polímero GK actuó como un agente de protección para las NP formadas, lo que permitió la síntesis verde de NP [59, 68]. Las NP sintetizadas en nuestro estudio (Au, Pt, Pd, Ag y CuO) fueron comparables en términos de tamaño, estabilidad y rentabilidad a otras NP sintetizadas en verde de estudios anteriores [13, 69].
Luego usamos un rango de concentraciones a nanoescala (1–20 mg / L) relacionadas con las concentraciones ambientales esperadas o registradas [39, 71,72,73] para evaluar el efecto biológico de las NP en C. reinhardtii utilizando criterios de valoración como el crecimiento de algas, la integridad de la membrana, Chl Eficiencia del fotosistema II de fluorescencia y estrés oxidativo. Nuestros resultados revelaron dos agrupaciones distintas:NP de Au y Pt que tienen poco o ningún efecto sobre el alga, y NP de Ag, Pd y CuO que muestran un fuerte efecto en casi todos los criterios de valoración (archivo adicional 1:Tabla S6). Los estudios de toxicidad de las NP de metales o de óxidos metálicos han identificado varias características físico-químicas clave de las NP que pueden estar relacionadas con su toxicidad, incluida la composición, el recubrimiento, el tamaño, la forma y la homoagregación o heteroagregación [69, 74,75,76,77, 78]. Además, la toxicidad del metal disuelto (forma iónica) se ha demostrado previamente en las algas utilizando una variedad de criterios, incluida la generación de ROS intracelulares, Chl agotamiento e inhibición de la fotosíntesis [79,80,81]. Detectamos claramente la generación de ROS y un efecto sobre el crecimiento, Chl producción y fotosistema II después de la exposición a NP de Ag, Pd y CuO.
Aunque las NP de Pd se han considerado habitualmente un grupo tóxico, no se han estudiado ampliamente y sólo recientemente se han reconocido como NP antibacterianas importantes [41]. En general, se cree que el tamaño pequeño (1,5 a 3 nm) de las NP de Pd contribuye a sus atributos antibacterianos, posiblemente facilitando el transporte a las células a través de las bacterias o los poros de la pared celular de las algas, que tienen diámetros que oscilan entre 5 y 20 nm [82, 83]. . In our study, Pd NPs of 1.5 nm mean size could directly enter algal cell walls and cause damage when releasing ions in the cell membrane and chloroplasts (Chl fluorescence, PS II, ROS). There is clear evidence that soluble Pd salt was able to enter P. subcapitata cells, where Pd precipitates were mostly formed in chloroplasts [78] which could increase generation of ROS and thus oxidative stress. It was also reported that Pd NPs (127 nm z -average hydrodynamic size) were less toxic toward P. subcapitata than soluble Pd salt [69] maybe due to larger size of NPs that could not directly enter the cells, while Pd salt could. On the other hand, Pd NPs could form hetero-aggregates with algal cells leading to physical entrapment. Surprisingly, the entrapment is not inevitably lethal because the cells could recover their growth after transfer to clean medium [69].
Numerous studies have shown that Ag NPs toxicity to algae was mainly driven by Ag ions dissolved in the exposure medium rather than Ag NPs and also depended on Ag NPs coatings and sizes [80, 84,85,86,87,88,89]. Our study revealed high toxicity of Ag NPs thus suitable for algicidal applications. The ionic Ag and/or Ag NPs (5 nm) could directly enter algal cells [90], causing damage to the cell membranes and other cellular compartments by ROS formation. Moreover, Ag NPs could damage algal cells by direct interaction between NPs and algal cells [72] or the type of NPs coating could play a significant role. For example, dexpanthenol, polyethylene glycol and polyvinyl polypyrrolidone coatings caused a similar effect as AgNO3 on C. reinhardtii , while carbonate, chitosan, and citrate decreased the Ag effect on photosynthesis [87]. Our Ag NPs showed strong effect toward C. reinhardtii regardless GK coating.
The ecotoxicity of CuO NPs has been extensively studied [36, 47,48,49, 69, 91]. We observed CuO NPs harming cell membranes right after 1 h, while the ROS elevated after 3 h at concentrations higher than 5 mg/L and also Chl fluorescence substantially decreased over 24 h. It is possible that the CuO NPs (or ionic Cu)-damaged membranes could increase further uptake of Cu and oxidative stress in the C. reinhardtii cells [91] where observed hetero-aggregation of NPs and the cells (data not shown) could even enhance this interaction. von Moos et al. [36] stated that free Cu 2+ or the NPs themselves were the main mediators of toxicity toward C. reinhardtii , while Cheloni et al. [47] believed ion Cu at lower CuO NPs concentrations was the driving force, being unable to clarify the contribution of dissolved Cu in CuO NPs . This was probably elucidated by other study revealed much stronger effect of soluble ionic Cu and soluble fraction of CuO NPs on P. subcapitata than bare CuO NPs [69].
Au NPs slightly increased membrane impairment and oxidative stress after 3 and 5 h, but these effects disappeared after 24 h. Interestingly, abiotic ROS were constantly generated during whole 24 h study contrary to all other NPs. We assume that stable conditions allowed the cells to cope with such small level of stress. Previous study has reported a range of EC50 values for dissolved Au on C. reinhardtii of between 5.9 and 1.7 mg/L, depending on exposure time [92]. In our opinion, almost any Au NP toxicity would not have been exacerbated or affected by the degree of ion Au and would have had nearly no bearing on any of the criteria adopted for our experiments. Moreover, Au NPs seemed to be well dispersed in exposure media and we did not observe any aggregates or direct interactions with the C. reinhardtii cells (data not shown).
We found that Pt NPs caused slight Chl and a growth rate decrease after 24 h for all concentrations. These not so pronounced effects could be caused by both ionic Pt and Pt NPs. Up to now, there has been only limited knowledge about the toxicity of Pt NPs on algae. For example, Pt NPs decreased growth rate, and Chl fluorescence and oxidative stress on P. subcapitata y C. reinhardtii [39, 40]. The latter authors also suggested that the toxicity of Pt NPs might be only partly attributed to dissolved form of Pt in the case of P. subcapitata and that also the shading effect might influence toxicity [40]. In our study, we did not find such evidence.
Conclusions
Green-synthesised metal and metal oxide NPs were produced at nanoscale sizes of 42 nm (Au), 12 nm (Pt), 1.5 nm (Pd), 5 nm (Ag) and 180 nm (CuO):all with a negative charge. GK, a natural hydrocolloid, was successfully applied as a safe, cost-effective stabiliser and showed no aggregation (all NPs) after 6 months at + 4 °C. The biological effect (algal growth, membrane integrity, oxidative stress, Chl fluorescence and photosystem II efficiency) of these NPs was investigated on green alga C. reinhardtii . All NPs had a significant effect on algal growth rate; however, Au and Pt NPs inhibited algal growth far less than the other NPs (Pd, Ag and CuO). In terms of other biological effects, Pd, Ag and CuO NPs caused significant cell membrane damage, highly affected Chl fluorescence and caused oxidative stress. Ag and Pd NPs mostly inhibited photosystem II, while it was not much affected by CuO (only the highest concentration of 20 mg/L significantly decreased QY) and Au or Pt. Generally, metal and metal oxide NPs were successfully synthesised following green chemistry rules, without harmful side-products and showing high stability. Some could find reasonable application in algicides (Ag and CuO) or antimicrobial surfaces (Pd, Ag and CuO), while Au and Pt proved to be almost non-toxic to green alga C. reinhardtii .
Nanomateriales
- Preparación de nanopartículas de mPEG-ICA cargadas con ICA y su aplicación en el tratamiento del daño celular H9c2 inducido por LPS
- Síntesis biogénica, caracterización y evaluación del potencial antibacteriano de nanopartículas de óxido de cobre contra Escherichia coli
- El efecto del plasma de no equilibrio por contacto sobre las propiedades estructurales y magnéticas de Mn Х Fe3 - X О4 Espinelas
- Efecto de diferentes aglutinantes sobre el rendimiento electroquímico del ánodo de óxido metálico para baterías de iones de litio
- Síntesis y rendimiento in vitro de nanopartículas de hierro-platino recubiertas de polipirrol para terapia fototérmica e imágenes fotoacústicas
- Síntesis fácil de óxido de estaño mesoporoso similar a un agujero de gusano a través del autoensamblaje inducido por evaporación y las propiedades mejoradas de detección de gas
- Efecto del método de síntesis de nanopartículas de manganita La1 - xSr x MnO3 en sus propiedades
- Aptitud ecológica en la síntesis y estabilización de nanopartículas de cobre:actividades catalíticas, antibacterianas, citotóxicas y antioxidantes
- Saponinas Platycodon de Platycodi Radix (Platycodon grandiflorum) para la síntesis verde de nanopartículas de oro y plata
- Nanopartículas de oro de forma redonda:efecto del tamaño de partícula y la concentración sobre el crecimiento de la raíz de Arabidopsis thaliana
- Postes indicadores y obstáculos en el camino hacia las cadenas de suministro ecológicas



