Preparación y evaluación de nuevas nanomicellas de oligosacárido de ácido esteárico g-quitosano cargadas con emodina
Resumen
El propósito de este estudio fue preparar y caracterizar el oligosacárido g-quitosano de ácido esteárico cargado de emodina (CSO-SA / EMO) y evaluar su actividad antitumoral in vitro. En este estudio se utilizó como portador oligosacárido de ácido esteárico-g-quitosano y se determinaron sus propiedades fisicoquímicas por diferentes métodos. El comportamiento de absorción celular se examinó utilizando oligosacárido de ácido esteárico-g-quitosano marcado con FITC. CSO-SA / EMO se preparó mediante ultrasonidos y diálisis. Se estudiaron in vitro el tamaño de las partículas, el potencial de superficie, la eficacia de atrapamiento y el comportamiento de liberación del fármaco. Los efectos de CSO-SA / EMO en las células de cáncer gástrico se investigaron mediante el ensayo MTT y la citometría de flujo. Los resultados mostraron que el tamaño de partícula de CSO-SA / EMO era mayor y el potencial era menor que el del oligosacárido de ácido esteárico-g-quitosano. La captación micelar de 12 h por las células MGC803 y BGC823 fue suficiente, y las micelas pudieron acumularse abundantemente en los sitios de lesión en los ratones, logrando así un buen direccionamiento pasivo de EPR. Los ensayos de detención del ciclo celular y MTT mostraron una actividad antitumoral mejorada por CSO-SA / EMO significativamente hacia las células MGC803 y BGC823 en comparación con la de la emodina libre. El volumen tumoral, la tinción con hematoxilina y eosina, y el ensayo de marcaje del extremo de la muesca de la desoxinucleótido transferasa dUTP demostraron que CSO-SA / EMO tenía un efecto antitumoral significativo en los tejidos tumorales in vivo. En conclusión, el método de diálisis por ultrasonidos proporcionó un método simple y eficaz para preparar CSO-SA / EMO. La administración de emodina mediante un sistema de micelas mejoró sus efectos antitumorales de manera eficaz.
Introducción
La emodina (EMO) es un derivado de antraquinona natural que se extrae principalmente de hierbas tradicionales chinas como el ruibarbo, cuspidatum y multiflorum. La medicina tradicional china (MTC) se usa ampliamente en la investigación clínica debido a su baja toxicidad, pocos efectos secundarios y bajo costo [1].
Los estudios han demostrado que la EMO tiene una amplia actividad farmacológica, que incluye actividades de inmunosupresión, anti-tos ferina, antihipertensiva, antiinflamatoria, antibacteriana y anticancerígena. Se ha descubierto que la EMO inhibe el crecimiento de las células cancerosas [2, 3, 4] y regula genes relacionados para controlar la apoptosis de las células tumorales, la tumorigénesis, la proliferación celular, la invasión y la metástasis [5, 6, 7, 8, 9]. Los estudios han demostrado que la EMO puede inhibir diversas células cancerosas, como las células de adenocarcinoma colorrectal humano, células de hepatocarcinoma, células de leucemia linfoide [10] y cáncer de lengua humana SCC-4 [11]. EMO puede inhibir la proliferación de células tumorales en cánceres gástrico, de mama y de próstata [7, 12]. Sin embargo, EMO no exhibe efectos citotóxicos en células normales como fibroblastos gingivales humanos normales [13], células epiteliales bronquiales humanas [14] y células mamarias humanas [15]. Estos muestran que EMO exhibe citotoxicidad selectiva hacia las células tumorales en comparación con las células normales.
El quitosano, un polisacárido natural, es la forma desacetilada de la quitina. Este polímero natural tiene excelentes características de solubilidad en agua, biofuncionalidad, compatibilidad con la sangre y degradabilidad microbiana, y es conocido por sus diversas aplicaciones biomédicas. Degradamos el quitosano de alto peso molecular (450 kDa) usando quitosanasa en condiciones ácidas para obtener un oligosacárido de quitosano de bajo peso molecular (CSO, 18 kDa). El CSO puede penetrar fuertemente las membranas celulares [16] y el ácido esteárico (SA) puede ingresar al núcleo a través de la vía de las glicoproteínas. El CSO se modificó hidrofóbicamente con SA utilizando carbodiimida (EDC) como reactivo de acoplamiento para sintetizar el oligosacárido anfipático de ácido esteárico-g-quitosano (CSO-SA).
Aunque EMO tiene una amplia actividad biológica, su estructura de antraquinona es poco soluble en agua. Dado que los fármacos terapéuticos se transportan a través del torrente sanguíneo, su solubilidad afecta directamente a su absorción y distribución. Los injertos CSO-SA pueden autoensamblarse en una solución acuosa para formar nanomicellas que son hidrofóbicas por dentro y hidrofílicas por fuera. Dispersamos las nanomicellas del estado reunido usando una sonda de ultrasonido. Debido a que tanto EMO como CSO eran hidrofóbicos, EMO se encapsuló en el centro de las micelas.
Se aplican varios fármacos modelo a CSO-SA, lo que requiere el peso molecular, la estructura y la hidrofobicidad de los fármacos modelo. Los estudios existentes incluyen curcumina [17], doxorrubicina [18], estearato de lamivudina [19] y oxaliplatino [20] que pueden mejorar significativamente los efectos antitumorales. Exploramos las condiciones óptimas de carga de CSO-SA / EMO. CSO-SA / EMO crea nuevas formas de dosificación con mayor solubilidad y eficiencia de utilización. CSO-SA / EMO puede proporcionar ideas para seleccionar fármacos o portadores modelo y la aplicación clínica de micelas.
Materiales y métodos experimentales
Materiales experimentales
Se obtuvieron ratones desnudos macho BALB / C + / nu del Centro de Animales Experimentales de la Universidad de Zhejiang. Las líneas celulares de cáncer gástrico de baja diferenciación MGC803 y BGC823 se adquirieron del banco de células ATCC. El medio de cultivo RPMI-1640 y FBS se obtuvieron de Hangzhou Holly Leaf Biotechnology Company. EMO, MTT, FITC, Hoechst 33342, DiR, ácido trinitrobencenosulfónico y pireno fueron suministrados por Sigma Aldrich. La Universidad de Zhejiang proporcionó a CSO-SA. Otros reactivos comprados eran de grado AR.
Determinación de la CMC y 1 Espectros de RMN H de CSO-SA
En este informe, la concentración de micelas críticas (CMC) de CSO-SA se determinó mediante espectrofotometría de fluorescencia utilizando pireno como sonda fluorescente. Se añadieron varias concentraciones de solución de CSO-SA a una solución de pireno acetona, después de lo cual se evaporó la acetona durante la noche. Los espectros de emisión y los valores máximos de pireno en soluciones de CSO-SA de diferentes concentraciones se analizaron mediante espectrofotometría de fluorescencia. El primer pico ( I 1 =374 nm) y el tercer pico ( I 3 =385 nm) del espectro. Trazamos la concentración logarítmica (Log C) como abscisas y I 1 / Yo 3 como la ordenada y calculó la CMC para las micelas del polímero.
CSO y CSO-SA se disolvieron en D 2 O a una concentración de 10 mg / ml. 1 Los espectros de RMN H se registraron, compararon y analizaron en busca de picos característicos de CSO y CSO-SA.
Grado de sustitución de amina detectado
El grado de sustitución de amina (% DE) se detectó mediante el método del ácido trinitrobenceno sulfúrico (TNBS).
Se prepararon diferentes concentraciones de soluciones de CSO y CSO-SA después de lo cual 4% NaHCO 3 y se añadieron sucesivamente TNBS al 0,1%. Después de la incubación a 37 ° C durante 2 h en un baño de agua, se añadió ácido clorhídrico 2 mol / L. La absorbancia se midió a 344 nm mediante espectrofotometría ultravioleta-visible después de 30 min de ultrasonidos. Se trazó una curva estándar y se calculó el% SD de la muestra de CSO-SA.
Tamaño y potencial de partículas de CSO-SA
Se preparó una solución de 1,0 mg / ml de CSO-SA y las micelas se dispersaron completamente con una sonda disruptora de células ultrasónica. El tamaño de partícula y el potencial de CSO-SA se determinaron con un analizador de tamaño de partícula y potencial de superficie.
Captación celular de CSO-SA
Las soluciones de FITC y CSO-SA se mezclaron, se agitaron durante la noche y se transfirieron a una bolsa de diálisis. El FITC sin reaccionar y el etanol absoluto se eliminaron mediante diálisis con agua desionizada durante 24 h. Finalmente, se obtuvo la solución CSO-SA (FITC-CSO-SA) etiquetada con FITC con una concentración de 1.0 mg / mL.
Se usaron células MGC803 y BGC823 como células diana para examinar la captación celular de CSO-SA. Basado en la tasa de proliferación celular, las células se sembraron en placas de 24 pocillos y se cultivaron durante la noche hasta que se volvieron completamente adherentes. Luego se agregaron ochenta μL de solución de FITC-CSO-SA en un punto de tiempo establecido. Las células se incubaron con 10 μL de Hoechst 33342 (1 mg / mL) durante 15 min para teñir el núcleo celular. La captación de CSO-SA por FITC-CSO-SA se detectó mediante microscopía confocal de barrido láser.
Distribución in vivo de CSO-SA
La distribución de CSO-SA in vivo se determinó mediante tinción con colorante fluorescente DiR. La solución CSO-SA / DiR se preparó mediante diálisis.
Se utilizaron ratones desnudos machos de seis semanas de edad como modelo experimental. Se inocularon ratones desnudos por vía subcutánea con 1 × 10 8 / mL de células MGC803. Se administró CSO-SA / DiR a través de la vena de la cola a un volumen de células tumorales de aproximadamente 200 mm 3 . A continuación, los ratones se anestesiaron en puntos de tiempo establecidos. La distribución cronometrada de CSO-SA / DiR in vivo se registró utilizando un generador de imágenes de cuerpos vivos de animales pequeños (rango de longitud de onda, 580-700 nm, tiempo de exposición 1000 ms).
Detección de concentración de EMO por HPLC
La concentración de EMO se determinó mediante HPLC. Se aplicó EMO a una columna empaquetada Eclipse XDB-C18 (4,6 × 250 mm, 5 μm) con una columna de protección (4,6 × 10 mm, 5 μm). La temperatura de la columna se fijó en 30 ° C, la velocidad de flujo fue de 1,0 ml / min, la longitud de onda de detección fue de 254 nm y el volumen de inyección fue de 20 μL. La fase móvil fue metanol / ácido fosfórico al 0,1% (85:15, v / v). La concentración de EMO se representó como abscisas y el área del pico como ordenadas. Se dibujaron curvas estándar de EMO para determinar el rango lineal óptimo. Todas las muestras inyectadas por HPLC se filtraron a través de un filtro orgánico de 0,45 μm para proteger la columna.
Preparación de CSO-SA / EMO
En este estudio, EMO se encapsuló con una sonda ultrasónica. Se utilizó como punto de partida una relación de formulación inicial del 10% (EMO:CSO-SA, p / p). La solución de EMO se añadió lentamente gota a gota a la solución micelar en un baño de hielo. A continuación, se aplicó la sonda ultrasónica durante 20 ciclos (400 W, trabajo 2 s, parada 3 s).
Las micelas cargadas con fármaco se transfirieron a una bolsa de diálisis (MWCO, 3,5 kDa) y se dializaron contra agua desionizada durante 24 h para eliminar el etanol del disolvente. Se obtuvo CSO-SA / EMO puro mediante centrifugación del dializado para eliminar la EMO libre.
Propiedades de CSO-SA / EMO (potencial de diámetro de partículas, TEM, EE%)
El tamaño de partícula y el potencial de superficie de CSO-SA / EMO se midieron con un analizador de tamaño de partícula y potencial de superficie.
Se añadió gota a gota una solución de 0,1 mg / ml de CSO-SA / EMO sobre un alambre de cobre cubierto con una película de carbono, se tiñó con ácido fosfotúngstico al 2% y se secó. La morfología y el tamaño de partícula de CSO-SA / EMO se observaron mediante microscopía electrónica de transmisión.
La eficiencia de atrapamiento (EE%) y la carga de fármaco (DL%) de CSO-SA / EMO se detectaron mediante extracción con solvente orgánico y HPLC. A una muestra de 200 μL de solución micelar CSO-SA / EMO, se le agregaron 1.8 mL de metanol para dispersar las micelas y extraer el fármaco. La concentración de EMO se midió como C EMO . Se colocaron otros 400 μL de solución micelar de CSO-SA / EMO en un tubo de centrífuga de ultrafiltración y se centrifugaron (12.000 rpm, 5 min) para obtener el sobrenadante. El% de EE y el% de DL se calcularon de acuerdo con las siguientes fórmulas:
$$ \ mathrm {EE} \% =\ left (10 \ times {C} _ {\ mathrm {EMO}} - C \ right) \ times V / {M} _ {\ mathrm {EMO}} \ times 100 \% $$$$ \ mathrm {DL} \% =\ left (10 \ times {C} _ {\ mathrm {EMO}} - C \ right) \ times \ mathrm {V} / \ left [\ left ( 10 \ times {C} _ {\ mathrm {EMO}} - C \ right) \ times V + {M} _ {\ mathrm {CSO} - \ mathrm {SA}} \ right] \ times 100 \% $$donde C EMO es la concentración de EMO en micelas, C es la concentración de EMO de las micelas cargadas con el fármaco después de la centrifugación por ultrafiltración, V es el volumen de micela cargada con fármaco sometida a diálisis, M EMO es la cantidad de EMO administrada durante la carga del fármaco, M CSO-SA es la masa de CSO-SA.
Evaluación de la liberación de fármacos in vitro
La liberación de fármaco de CSO-SA / EMO se investigó utilizando PBS (pH 7,2) como medio de liberación. Se colocó un mililitro de solución de micelas cargada con fármaco en una bolsa de diálisis de 3,5 kDa sellada en ambos extremos y luego se colocó en un tubo que contenía medio de liberación apropiado. La bolsa de diálisis se colocó en un agitador de termostato horizontal a 37 ° C. Se tomaron muestras en puntos de tiempo establecidos y se reemplazaron con el mismo volumen de medio de liberación reciente. El contenido de EMO en las muestras se determinó mediante HPLC y se calculó la cantidad acumulada de EMO liberada.
Citotoxicidad de CSO-SA / EMO
Las tasas de supervivencia de las células de cáncer gástrico tratadas con CSO-SA / EMO, CSO-SA y EMO se detectaron mediante el ensayo MTT. Las células se sembraron en placas de 96 pocillos a una concentración de aproximadamente 10 5 / ml. Se agregaron CSO-SA / EMO, CSO-SA y EMO en diferentes concentraciones. Después de la incubación durante diferentes períodos de tiempo, se agregaron 20 μL de solución de trabajo de MTT. Después de 4 h de incubación, se agregaron 200 μL de DMSO y se midió la densidad óptica (DO) de la solución a 570 nm mediante un lector de microplacas.
Efecto de CSO-SA / EMO en el ciclo celular
Las células de las dos líneas celulares se sembraron en una placa de 6 pocillos a una densidad de 10 5 / mL. Después de 12 h de cultivo, se agregaron CSO-SA, CSO-SA / EMO y EMO y se incubaron durante 24 h. A continuación, las células se digirieron, se recogieron y se lavaron. A continuación, se añadieron 500 μl de solución de tinción de PI a cada muestra de células, el sedimento celular se resuspendió lentamente y las células se incubaron en la oscuridad a 37 ° C durante 30 min. La fluorescencia roja se detectó mediante un citómetro de flujo a una longitud de onda de excitación de 488 nm. El contenido de ADN fue analizado por el software FlowJo.
Efectos antitumorales de CSO-SA / EMO evaluados por análisis histológicos e in vivo
Los experimentos con animales se realizaron de acuerdo con las Directrices para el Comité de Uso y Cuidado de Animales de la Universidad de Zhejiang. Células MGC803 (1 × 10 6 ) se inyectaron por vía subcutánea en el flanco anterior derecho de ratones desnudos macho a las 5 a 6 semanas de edad. Se dejó que los tumores crecieran hasta un diámetro de aproximadamente 5 mm. En ese momento, los ratones se dividieron aleatoriamente en un grupo de control, un grupo de inyección EMO y un grupo de inyección CSO-SA / EMO, con 3 animales en cada grupo. A todos los ratones se les inyectaron por vía intravenosa los reactivos relevantes a través de la vena de la cola una vez al día durante 2 semanas. Se utilizó un calibre Vernier electrónico para medir los diámetros largo (a) y corto (b) del tumor (b). El volumen tumoral se calculó de acuerdo con la fórmula V =a × b 2 / 2. Se registró el peso corporal de cada ratón, después de lo cual se recogieron los tumores para el análisis histológico. La tasa de inhibición tumoral se determinó en los tejidos tumorales después de la tinción con hematoxilina y eosina (HE). Se realizó el etiquetado terminal de la desoxinucleótido transferasa dUTP nick-end (TUNEL) para detectar la apoptosis celular en el tejido del íleon terminal utilizando un kit de detección de muerte celular in situ de acuerdo con las instrucciones del fabricante.
Resultados y discusión
CMC y 1 Espectros de RMN H de CSO-SA
Los polímeros anfifílicos se autoensamblaron en micelas en medio hidrófilo. Una CMC más baja dio como resultado una mayor formación de micelas. Esto fue beneficioso para el mantenimiento de la estructura de las micelas después de la administración intravenosa. Cuando CSO-SA formó micelas, la sonda fluorescente de pireno podría entrar fácilmente en el núcleo hidrófobo de las micelas aumentando la intensidad de fluorescencia del pireno cargado, lo que aumentó la intensidad del espectro de emisión. En este punto, yo 3 aumentó significativamente más rápido que I 1 , así, el I 1 / Yo 3 la relación de intensidad de fluorescencia disminuyó abruptamente. Se pudo observar un punto de ruptura significativo en el I 1 / Yo 3 plot y valores de Log C (Fig. 1). Los cálculos del punto de inflexión mostraron que la CMC fue de 179,02 μg / ml. Cuanto más pequeña es la CMC, más fuerte es la capacidad de formar micelas y más fuerte es la resistencia a la dilución, lo que mejora la protección de la estructura de las micelas después de la administración intravenosa.
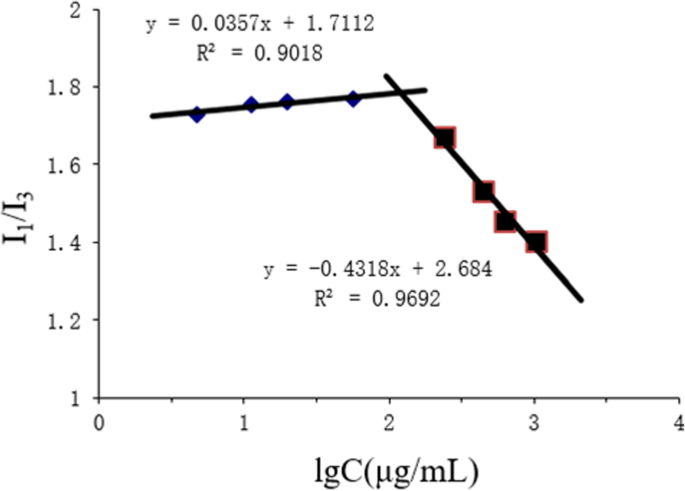
Variación de la relación de intensidad de fluorescencia ( I 1 / Yo 3 ) versus concentración logarítmica de CSO-SA
Se usó EDC como agente de acoplamiento de reticulación para reaccionar con el grupo carboxilo de SA y formar el intermedio activo derivado -OO-acil isourea. Este puede reaccionar con el grupo de amina primaria de CSO para formar un enlace amida. La estructura de CSO-SA se determinó y confirmó basándose en el espectro de protones de resonancia magnética nuclear. 1 H NMR (400 MHZ, D 2 O) δ 1.06 (m, CH2), 1.02 (m, CH3) corresponden al protón de metileno y al protón de metilo de SA respectivamente.
Grados sustitutos del grupo amino
El SD% de CSO-SA es el porcentaje de grupos amino sustituidos con ácido esteárico en el quitosano. TNBS reaccionó con grupos amino libres en quitosano y formó derivados de trinitrobenceno con una absorción de UV a 344 nm. La curva estándar del derivado trinitrobenceno de quitosano se determinó mediante absorción UV a 344 nm. Se calculó que el% DE de CSO-SA era de 9,3 ± 8%. Esto confirmó que CSO y SA se habían vinculado con éxito en función de su proporción de injerto.
Tamaño y potencial de partículas de CSO-SA, CSO-SA / EMO
La Tabla 1 muestra que el promedio Z de CSO-SA fue 139,3 ± 2,2 nm. El PDI fue 0,179 ± 0,03, lo que indica una dispersión relativamente uniforme. En comparación con CSO-SA, el promedio Z y el PDI de CSO-SA / EMO aumentaron. Después de cargar EMO, la carga positiva superficial de CSO-SA / EMO fue mayor que la de CSO-SA.
Captación de celda
FITC no afectó las propiedades fisicoquímicas de CSO-SA. Obtuvimos FITC-CSO-SA injertando fluoresceína FITC en CSO-SA. Después de teñir las células con Hoechst 33342, se observó la captación de células FITC-CSO-SA usando microscopía de barrido láser confocal. Descubrimos que la captación de MGC803 aumentó gradualmente con el aumento del tiempo y la fluorescencia de FITC aumentó gradualmente. La captación micelar de BGC823 fue similar a MGC803 en una forma dependiente del tiempo. FITC-CSO-SA tenía una buena capacidad de penetración celular y se distribuyó uniformemente en el citoplasma de las células cancerosas gástricas (Fig. 2).
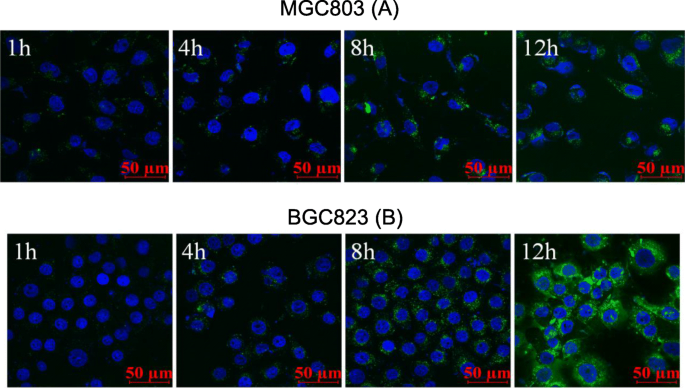
Captación celular in vitro dependiente del tiempo de micelas de CSO-SA en MGC803 ( a ) y BGC823 ( b ) celdas durante 1, 4, 8, 12 h, respectivamente (azul, Hoechst 33342; verde, FITC; barra de escala =50 μm)
Distribución de CSO-SA In Vivo
La tecnología de imágenes de infrarrojo cercano (NIR) es ventajosa para penetrar biomateriales y tejidos. Después de inyectar CSO-SA / DiR en la vena de la cola de ratones desnudos, se observó y registró la distribución de CSO-SA / DiR en diferentes momentos utilizando un generador de imágenes de cuerpos vivos de animales pequeños. Como se muestra en la Fig. 3, la distribución de CSO-SA / DiR fue similar a la de otras micelas a las 4 h después de la inyección en la vena de la cola y se distribuyó principalmente en el hígado, el bazo y los tejidos tumorales. La distribución de nanomicellas en el tumor aumentó gradualmente en intensidad con el paso del tiempo. Esto indicó que el injerto CSO-SA tenía una buena capacidad de focalización pasiva debido principalmente al efecto EPR de las nanomicellas (Fig. 3).
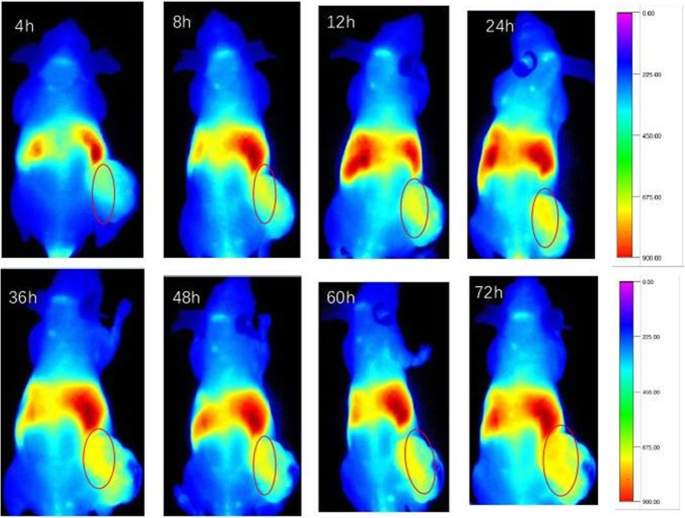
Imagen de cuerpo entero de CSO-SA / DiR en diferentes momentos después de la administración i.v. inyección
Preparación de CSO-SA / EMO
La influencia de diferentes entornos de pH en la carga de fármacos
Preparamos una solución de CSO-SA y ajustamos el pH de CSO-SA para investigar el efecto del pH sobre la carga de fármaco. Como se muestra en la Fig. 4, CSO-SA tenía una buena capacidad de carga de fármaco y exhibía una tendencia parabólica en el rango de pH 6,4-6,8. El nivel más alto de carga de fármaco se observó a pH 6,6, lo que hace que este valor sea el pH óptimo para la carga de fármaco (Fig. 4).
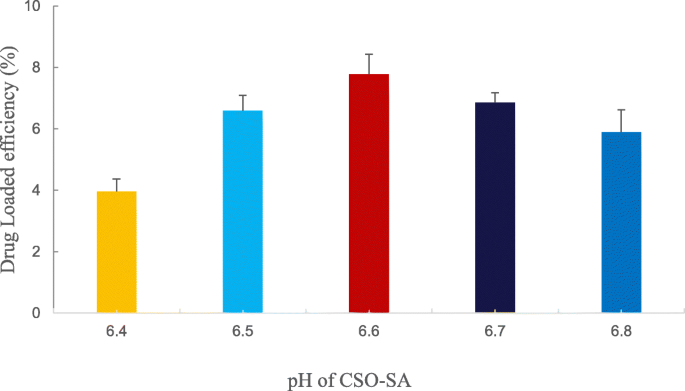
Efectos de diferentes valores de pH de injertos de CSO-SA sobre la carga de fármaco. Los datos se presentan como medias ± DE ( n =3)
Eficiencia de encapsulación, TEM y carga de fármacos
CSO-SA se autoensambla en micelas de nanocompuestos con núcleo de caparazón. Los restos hidrófobos forman espontáneamente estructuras centrales hidrófobas para repeler los medios hidrófilos. Esta estructura proporciona un vehículo clave para la carga de fármacos porque EMO puede encapsularse fácilmente en el núcleo hidrofóbico debido a su estructura hidrofóbica. Investigamos el efecto de CSO-SA sobre la capacidad de carga de EMO variando la dosis de EMO. Como se muestra en la Fig. 5, al aumentar la dosis de EMO, aumenta la cantidad de carga de fármaco. La tasa de carga de CSO-SA llegó hasta el 21,16% cuando la proporción era del 30% (Fig. 5).
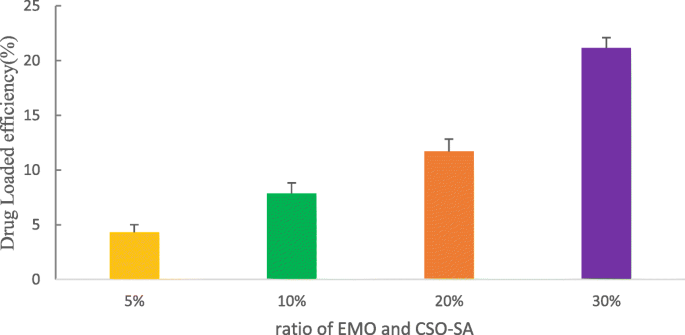
La influencia de diferentes proporciones de EMO y CSO-SA (5-30%) sobre las cargas de fármacos. Los datos se presentan como la media ± DE ( n =3)
CSO-SA / EMO se amplió 30.000 veces con un microscopio electrónico de transmisión. Se observaron y registraron la forma y el tamaño de las nanomicellas.
Lanzamiento de EMO de CSO-SA / EMO
La solución de micelas cargada con fármaco se añadió a una bolsa de diálisis de 3,5 kDa con PBS (pH 7,2) como medio de liberación. Cada vez que se extraía una muestra, se reemplazaba con el mismo volumen de medio de liberación reciente.
La concentración de EMO en diferentes momentos se determinó mediante HPLC, después de lo cual se calculó el porcentaje de liberación acumulada. Como se muestra en la Fig. 6, CSO-SA / EMO exhibió un efecto de liberación sostenida significativo en comparación con EMO libre. Estos resultados muestran que el porcentaje de liberación de EMO libre fue del 38,4% a las 0,5 h, mientras que el porcentaje de liberación de EMO de CSO-SA / EMO fue de aproximadamente 6,6%. A las 4 h, el porcentaje de liberación de EMO libre fue del 83,7% y el porcentaje de liberación de CSO-SA / EMO fue de aproximadamente el 32,5%. En 72 h, la liberación de EMO libre alcanzó el 97,2%, mientras que la liberación de EMO de CSO-SA / EMO fue del 78,4%. La EMO se liberó de las micelas cargadas con fármaco de CSO-SA / EMO de dos formas principales:a través de la disociación EMO del núcleo micelar y por la penetración del núcleo de la micela en el medio de liberación.
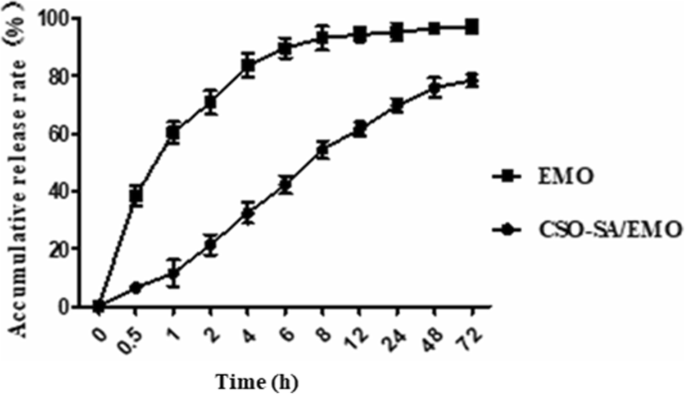
Perfil de liberación EMO de CSO-SA / EMO durante 72 h. Las barras de error en el gráfico representan las desviaciones estándar ( n =3)
Toxicidad de CSO-SA / EMO para las células de cáncer gástrico
El ensayo MTT es un método estándar para detectar la viabilidad celular. La citotoxicidad de EMO libre, CSO-SA y CSO-SA / EMO para células de cáncer gástrico MGC803 y BGC823 se midió utilizando el ensayo MTT. Mostró que EMO y CSO-SA / EMO podrían inhibir las células MGC803 y BGC823 de una manera dependiente de la dosis y el tiempo. Sin embargo, a la misma concentración, CSO-SA / EMO tuvo un mayor efecto inhibidor sobre las células MGC803 y BGC823 en comparación con la solución EMO libre. El IC 50 Se calcularon los valores (Tabla 2) de EMO y CSO-SA / EMO para células de cáncer gástrico. El IC 50 de CSO-SA / EMO fue significativamente menor que la de EMO en cada punto de tiempo (24 h, 48 h, 72 h). El IC 50 Los valores de CSO-SA mostraron que CSO-SA era un portador biológico seguro con poca toxicidad biológica, lo que confirmó que la citotoxicidad de CSO-SA / EMO era causada por EMO (Fig. 7).
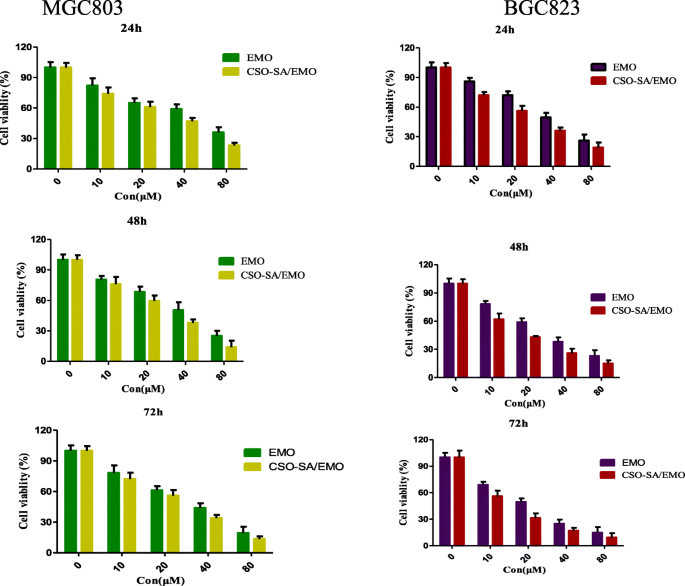
Viabilidad celular de las células de cáncer gástrico MGC803 y BGC823 tratadas con CSO-SA, EMO y CSO-SA / EMO durante 24 h, 48 hy 72 h. Los datos se presentan como la media ± DE ( n =3)
La Tabla 2 y la Fig. 7 mostraron que la citotoxicidad del sistema de administración de fármacos CSO-SA / EMO era significativamente mayor que la de EMO libre. Sin embargo, cuando se simuló la liberación de CSO-SA / EMO y EMO libre en un entorno in vivo, la liberación de EMO libre alcanzó el 38,4% a las 0,5 h, mientras que la liberación de CSO-SA / EMO fue solo del 6,6%. En general, la concentración de EMO libre fue más alta que la de CSO-SA / EMO en cada momento.
Este fenómeno se explica fácilmente. Aunque CSO-SA / EMO liberó EMO de forma relativamente lenta, el efecto antitumoral de CSO-SA / EMO no se ralentiza ni declina. Muchos estudios han demostrado que los sistemas de administración de nanofármacos pueden mejorar la actividad antitumoral de los fármacos de quimioterapia [21].
Primero, aunque la EMO libre muestra una explosión inicial de actividad, las células no pueden absorber la EMO de manera eficiente, mientras que CSO-SA aceleró enormemente la absorción celular a través de la endocitosis o la fagocitosis.
En segundo lugar, cuando CSO-SA / EMO se cierra a las membranas celulares, la interacción entre las nanopartículas y las membranas celulares puede afectar la estructura y propiedades de las nanomicellas, así como la función de macromoléculas biológicas como los canales iónicos. Por lo tanto, la unión de CSO-SA / EMO a las membranas celulares no da como resultado una simple adsorción física, pero puede cambiar el equilibrio dinámico de la célula y, por lo tanto, promover aún más la citotoxicidad de CSO-SA / EMO.
Finalmente, la EMO libre tiene una estructura de antraquinona hidrófoba que da como resultado una mala distribución en la sangre. El sistema de administración de fármacos CSO-SA / EMO aumenta la solubilidad de EMO y mejora la disolución, lo que conduce a una concentración molecular más alta en las células circundantes.
Detección de detención del ciclo celular por FCM
El análisis del ciclo celular es un aspecto importante del tratamiento clínico de los tumores malignos. Se ha demostrado que la aplicación de fármacos específicos del ciclo a las células tumorales durante los períodos sensibles al fármaco tiene una gran eficacia. Aunque los análogos de bromuro de etidio no pueden penetrar en las células normales, pueden teñir los núcleos celulares al penetrar en las membranas celulares dañadas. El ADN bicatenario incrustado en PI produce fluorescencia roja y la intensidad de la fluorescencia es proporcional al nivel de ADN bicatenario. El contenido de ADN se determinó mediante citometría de flujo (FCM) después de la tinción del ADN con PI. La distribución del ciclo celular y la apoptosis se analizaron en función de la distribución del contenido de ADN.
Los estudios han demostrado que la EMO afecta la distribución del ciclo celular [11, 22]. El análisis FCM mostró que CSO-SA / EMO y EMO podrían bloquear las células MGC803 y BGC823 en la fase G2 / M del ciclo celular.
Las células MGC803 se expusieron a la misma concentración (20 μM) de CSO-SA, solución de EMO libre y CSO-SA / EMO durante 24 h. Se encontró que el porcentaje de células MGC803 en la fase G2 / M era del 8,95%, 15,29% y 23,12%, respectivamente. El porcentaje del grupo de control fue del 6,47%. Los porcentajes de células BGC823 en G2 / M tratadas con 20 μM CSO-SA, EMO libre o CSO-SA / EMO en las mismas condiciones fueron 14.25%, 16.79% y 35.71% respectivamente, que fueron valores más altos que en el grupo control. (13,66%). Estos datos mostraron que CSO-SA / EMO bloqueó la fase G2 / M de las células MGC803 y BGC823 de manera más eficiente y significativa que la EMO libre a la misma concentración. El CSO-SA no mostró diferencias con los controles (Fig. 8).
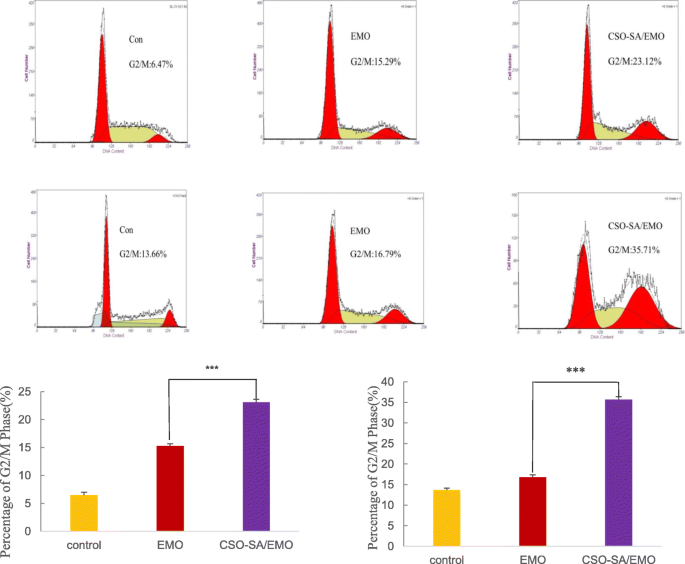
Distribuciones del ciclo celular de las células MGC803 y BGC823 tratadas con EMO y CSO-SA / EMO durante 24 h. t del estudiante se calculó la prueba y los datos se presentan como la media ± DE ( n =3), (* p <0.05, ** p <0.005, *** p <0,001)
Efecto antitumoral de CSO-SA / EMO In Vivo
Para estudiar más a fondo el efecto antitumoral de CSO-SA / EMO, se evaluaron in vivo la tasa de inhibición tumoral y los niveles de apoptosis celular. Los resultados mostraron que tanto CSO-SA / EMO como EMO tenían un efecto inhibidor notable sobre el crecimiento tumoral (Fig. 9a). La tasa de inhibición tumoral del grupo CSO-SA / EMO fue tres veces mayor que la del grupo EMO (Fig. 9d). El peso de los ratones en cada grupo no cambió significativamente (Fig. 9b). Esto demostró que tanto CSO-SA / EMO como EMO eran relativamente seguros. Las alteraciones morfológicas y la apoptosis en los tejidos tumorales de cada grupo mostraron que CSO-SA / EMO tenía efectos antitumorales significativos (Fig. 9e, f).
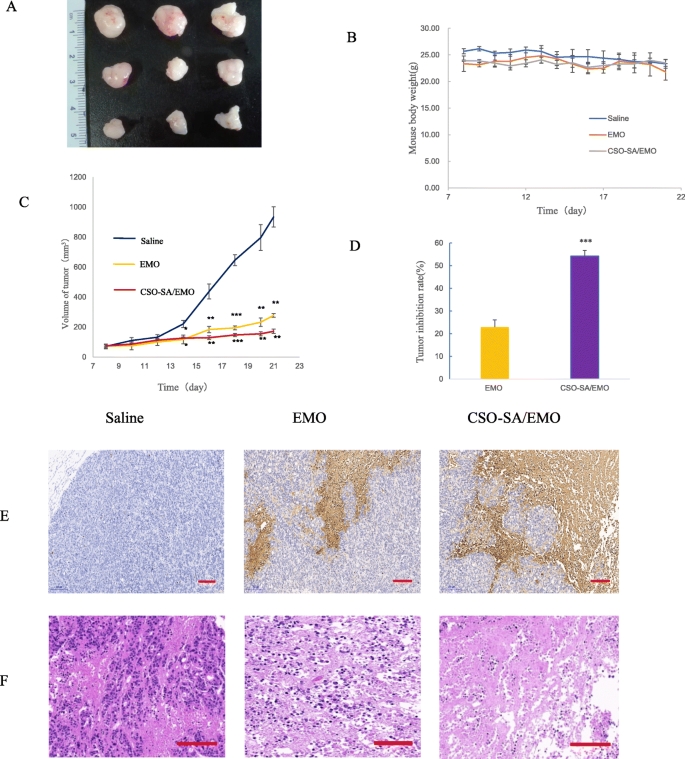
Efecto antitumoral de CSO-SA / EMO in vivo. un Forma del tumor en cada grupo. b Peso corporal del ratón en cada grupo. c Volumen tumoral en cada grupo. d Tasa de inhibición tumoral. e Imágenes representativas de tejido tumoral teñido con TUNEL de cada grupo (barra de escala =200 μm). f Imágenes representativas de tejido tumoral teñido con HE de cada grupo (barra de escala =200 μm)
Conclusiones
En este estudio, detectamos estructura, CMC, SD%, tamaño de partícula y potencial de CSO-SA con diferentes métodos. Los resultados demuestran que el CSO-SA anfifílico se desempeñó bien como portador. La intensidad de la fluorescencia de las células de cáncer gástrico mostró que CSO-SA se había absorbido rápidamente en 12 h. Nude mice were used as a model to study the distribution of CSO-SA within 72 h. Over time, CSO-SA distribution in lesion became more concentrated exhibiting a good passive targeting effect.
CSO-SA/EMO was prepared with ultrasound-dialysis method. CSO-SA had strong drug-loading capacity. When environment pH was set at 6.6, the level of drug loading reached 21.6% at a 30% formulation ratio. Compared with CSO-SA, CSO-SA/EMO had bigger particle size and zeta potential. The shape of CSO-SA/EMO could be recorded directly using TEM. The release of EMO from CSO-SA/EMO was 78.4% within 72 h, it indicated a smooth and continuous process in body. Considering the antitumor effect of CSO-SA/EMO compared with free EMO, we confirmed it with various experiments.
CSO-SA toxicity to gastric cancer cells was detected by MTT assay. The results showed that CSO-SA was a safe biological carrier. Compared with that of free EMO, CSO-SA/EMO significantly enhanced the antitumor activity against gastric cancer cells. MGC803 and BGC823 cell cycle could be arrested in the G2/M phase more effectively by CSO-SA/EMO. Tumor volume, HE staining, and TUNEL assay proved more significant antitumor effect of CSO-SA/EMO than free EMO.
Based on above results, CSO-SA is both biocompatible and safe carrier. CSO-SA/EMO in this study utilizes a new and effective dosage formulation for the treatment of cancer and exhibits good passive targeting effect in vivo.
Disponibilidad de datos y materiales
Todos los datos generados o analizados durante este estudio se incluyen en este artículo publicado.
Abreviaturas
- CSO-SA:
-
Chitosan oligosaccharide-stearic acid
- EMO:
-
Emodin
- FITC:
-
Isotiocianato de fluoresceína
- MTT:
-
Thiazolyl blue tetrazolium bromide
- TEM:
-
Microscopio electrónico de transmisión
- 1 RMN H:
-
Resonancia magnética nuclear de protones
- EPR:
-
Permeabilidad y retención mejoradas
- TCM:
-
Traditional Chinese medicine
- CMC:
-
Concentración de micelas crítica
- Log C:
-
Logarithm of concentration
Nanomateriales
- Preparación y propiedades magnéticas de nanopartículas de espinela de FeMn2O4 dopadas con cobalto
- Análisis de actina y organización de la adhesión focal en células U2OS en nanoestructuras poliméricas
- Hacia los nanofluidos de TiO2:Parte 1:Preparación y propiedades
- Preparación y actividad de hidrogenación catalítica mejorada de nanopartículas de Sb / Palygorskita (PAL)
- Nuevas nanopartículas de Au Nanostars @ PEG biocompatibles para la obtención de imágenes de TC in vivo y las propiedades de depuración renal
- Síntesis de nanocristales de ZnO y aplicación en células solares de polímero invertido
- Preparación y rendimiento fotocatalítico de fotocatalizadores LiNb3O8 de estructura hueca
- Preparación de nanoesferas poliméricas impresas con iones de paladio (II) y su eliminación del paladio (II) de la solución acuosa
- Preparación y características termoeléctricas de ITO / PtRh:termopar de película fina PtRh
- Dielectroforesis de ondas de frecuencia modulada de vesículas y células:cambios de sentido periódicos en la frecuencia de cruce
- Fabricación y propiedad fotocatalítica de nuevos nanocompuestos SrTiO3 / Bi5O7I



