Evaluación cuantitativa de la internalización celular de nanopartículas poliméricas dentro de las células del cáncer de laringe y las células inmunes para mejorar la administración de fármacos
Resumen
La traducción clínica de la nanomedicina basada en poli (ácido láctico-co-glicólico) (PLGA) es limitada, en parte debido a la escasa eficiencia de administración que resulta de la fagocitosis inespecífica por fagocitos. La comprensión de la interacción de las nanopartículas entre las células cancerosas y las células inmunitarias sigue siendo en gran medida difícil de alcanzar. En este estudio, se realizó por primera vez una investigación cuantitativa sobre la internalización celular de partículas de PLGA fluorescentes (100 nm, 500 nm y 1 µm) contra células de carcinoma de laringe con o sin monocitos / macrófagos en sistemas de monocultivo o cocultivo. Las partículas de PLGA a concentraciones de 5 a 20 µg / mL muestran una biocompatibilidad superior, excepto que las partículas de PLGA de 500 nm y 1 µm a 20 µg / mL reducen levemente la viabilidad celular. La observación microscópica ha descubierto que los tres tamaños de partículas son ingeridos eficazmente tanto por las células cancerosas como por los macrófagos; Sin embargo, el examen de fluorescencia cuantitativa ha revelado que el índice de absorción de las células cancerosas (la fluorescencia media de las partículas intracelulares por célula cancerosa normalizada a la de cada macrófago) está sustancialmente disminuida para todas las partículas de PLGA en los cocultivos en comparación con el de los monocultivos (1.35–1.05, 1,50–0,59 y 1,4–0,47 para partículas de 100 nm, 500 nm y 1 µm, respectivamente). El análisis cuantitativo mediante citometría de flujo confirmó aún más el índice de absorción reducido de las células cancerosas en los cocultivos, pero un mayor recuento de partículas por macrófago. También se ha descubierto que la formación de células gigantes multinucleadas a través de la fusión de macrófagos aumentó después del tratamiento con PLGA, lo que podría explotarse aún más como un enfoque potencial para la administración de fármacos tumorales. En general, estos hallazgos brindan nuevos conocimientos sobre la interacción de las células cancerosas inmunes a las nanopartículas, lo que puede facilitar la aplicación de nanoportadores basados en PLGA para el tratamiento del carcinoma de laringe.
Introducción
El cáncer es una de las principales causas de mortalidad en todo el mundo, con alrededor de 10 millones de nuevos casos de muerte notificados en 2018 [1]. El carcinoma de laringe (las células cancerosas surgen de la laringe) es la segunda neoplasia maligna más común de los carcinomas de células escamosas de cabeza y cuello (HNSCC), lo que representa alrededor de 180.000 casos nuevos y 95.000 muertes en 2018 [2]. Actualmente, los medicamentos dirigidos se desarrollan como un tratamiento opcional para los desafíos introducidos por las terapias tradicionales como la cirugía, la radioterapia y la quimioterapia [3]. Se han acelerado los esfuerzos científicos para mejorar la focalización y la eficacia de los medicamentos y reducir los efectos secundarios no deseados mediante el desarrollo, por ejemplo, de nuevos nanoportadores de medicamentos ( es decir, , microagujas), medicamentos personalizados contra el cáncer y sistemas de administración de anticuerpos terapéuticos dirigidos [4].
Los nanoportadores se han utilizado ampliamente para cargar medicamentos contra el cáncer como cisplatino, paclitaxel y docetaxel para mejorar su solubilidad en agua, biodisponibilidad y estabilidad para mejorar la administración y eficacia de los medicamentos [3, 4]. En general, la administración de fármacos a base de nanopartículas (NP) permite la administración de una amplia gama de otras sustancias ( p. Ej. , proteínas, anticuerpos, vacunas y ácidos nucleicos) a regiones específicas del cuerpo tanto en modelos animales como en pacientes [4, 5]. Sin embargo, el llamado efecto de permeabilidad y retención mejoradas (EPR) ha dado como resultado una eficiencia de focalización considerablemente variable entre los diferentes tipos de cáncer [6]. Evidencia reciente sugiere que la deposición de portadores de nanofármacos (en este caso, NP de oro) en los tumores depende preferentemente del proceso de transcitosis [7], un tipo de transporte biológico transcelular, en el que las sustancias / NP se transfieren a través de las células de un lado a otro. otro que incluye los cursos de endocitosis, transferencia vesicular y exocitosis. Sin embargo, debe tenerse en cuenta que los resultados contradictorios con respecto a los mecanismos de administración de fármacos dirigidos enfatizan la importancia crítica para comprender la base de la interacción celular con nanofármacos o NP utilizando múltiples estrategias experimentales que van desde el cultivo de células in vitro hasta el cultivo de tejidos ex vivo. y estudio animal in vivo.
Numerosos nanoportadores como liposomas, NP de albúmina (NP), NP de sílice y poli (ácido láctico-co-glicólico) (PLGA) se han empleado clínicamente para tratar diferentes tipos de cáncer, incluido el carcinoma de laringe [4]. Los NP de base polimérica como las micelas y el PLGA tienen un gran potencial en aplicaciones biomédicas debido a sus formulaciones versátiles de nanofármacos mediante mezcla simple o conjugación covalente, excelente capacidad de autoensamblaje, alta capacidad de carga de fármacos y biocompatibilidad [8, 9 ]. Por ejemplo, los nanoportadores de PLGA recubiertos con polietilenglicol (PEG) cargados con doxorrubicina y verde de indocianina permiten una terapia quimio-fototérmica sinérgica para el cáncer de mama [10]. Además, los estudios in vitro e in vivo han demostrado que las micelas cargadas con cisplatino exhiben una excelente actividad anticancerosa contra los tumores ortotópicos de HNSCC ( es decir , SAS-L1 y HSC-2) [11]. Aunque varios nanofármacos poliméricos como PLGA y micelas han sido aprobados para uso clínico o están siendo evaluados en ensayos clínicos [4, 6], muchos más nanofármacos poliméricos están bajo investigación preclínica con diferentes células cancerosas de cabeza y cuello. líneas y modelos de tumores de xenoinjerto de animales [11,12,13,14].
La evidencia científica ha resaltado la importancia de las respuestas inmunológicas del huésped a los portadores de nanofármacos, porque una vez que esos NP ingresan al cuerpo, son inevitablemente reconocidos por el sistema inmunológico. Los macrófagos se consideran la primera línea de defensa celular del huésped, y se especializan en la neutralización y eliminación de alérgenos, microorganismos y partículas extrañas ( p. Ej. , nanoportadores) a través de la fagocitosis y el consiguiente cebado de las respuestas inmunes. La mayoría de los nanoportadores de diseño novedoso no han logrado la administración dirigida a regiones enfermas o tumores específicos in vivo debido a la acumulación eficiente de NP en el sistema de fagocitos mononucleares (MPS), como las células de Kupffer en el hígado y los macrófagos de la pulpa roja en el bazo. [15]. Por lo tanto, comprender los mecanismos de captación celular de NP por células inmunes como los monocitos y macrófagos es crucial, ya que determina la vida útil de los nanoportadores en los tejidos y fluidos biológicos relevantes. Por lo tanto, el sistema de cocultivo de células in vitro emergente ha atraído gradualmente una atención creciente dentro de los campos de la nanomedicina y la toxicología debido a la creciente demanda para lograr resultados más significativos que puedan reflejar mejor la condición in vivo [16]. De hecho, se ha demostrado que los sistemas de cocultivo presentan una situación realista en la imitación de estados de tejidos sanos y enfermos [17] y se han utilizado de forma fiable en estudios de absorción celular y de absorción de fármacos de NP [18,19,20,21]. La utilización de modelos de células inmunes y de células cancerosas en cocultivo generalmente ofrece una plataforma adecuada para sondear las rutas de absorción y los mecanismos de estos nanomateriales en las células, lo que puede facilitar el diseño de nanoportadores que estén mejor dirigidos a las células cancerosas y, al mismo tiempo, reduzcan la fagocitosis de NP. Por lo tanto, es de fundamental importancia determinar la eficiencia de absorción y el destino de las NP en las células cancerosas en presencia de células inmunes. La mayoría de los nanoportadores se han diseñado para tener diámetros de 50 a 200 nm para aprovechar el efecto EPR y prolongar la circulación sanguínea, mientras que los NP más grandes (> 500 nm) se eliminan de manera eficiente mediante el MPS [6]. Por lo tanto, se seleccionó PLGA, un nanoportador aprobado por la FDA, en diferentes tamaños (100, 500 y 1000 nm) para investigar las capacidades de absorción de UM-SCC-17A (una línea celular de carcinoma escamoso laríngeo clásico) [22] y THP- 1 (una línea celular monocítica aguda humana) células. Varios estudios in vitro han aplicado nanoportadores de PLGA para administrar medicamentos para matar células cancerosas HNSCC en monocultivos [12, 13, 23], este es el primer estudio que prueba la eficiencia de captación y el mecanismo de captación de NP por células inmunes y células cancerosas de laringe de forma sincrónica en un modelo de cocultivo mediante el empleo de diferentes tamaños de PLGA, que podría proporcionar una base fundamental para el desarrollo de una nueva nanomedicina segura por diseño para la terapia de HNSCC.
Materiales y métodos
Materiales
En este estudio se utilizaron tres partículas de PLGA comercializadas (Sigma-Aldrich) con diferentes tamaños, incluidos 100 nm, 500 nm y 1000 nm. Todas las partículas se cargaron con fluoróforos verdes con longitudes de onda de excitación y emisión ópticas (ex / em) de 460 nm y 500 nm. Todas las partículas se recibieron en forma de polvo y se suspendieron en agua destilada con una concentración final de 10 mg / ml para su uso posterior. Los diámetros hidrodinámicos y los potenciales zeta de tres partículas se llevaron a cabo mediante dispersión dinámica de luz (DLS) realizada con un instrumento Malvern Zeta Sizer Nano (Malvern Instruments Ltd., Malvern, Reino Unido). Las suspensiones madre de cada partícula se diluyeron 1:100 en 80 µl de agua destilada para la medición de DLS. Siguiendo la indicación del fabricante, se obtuvieron 3 mediciones repetidas para cada partícula.
Cultivos celulares de UM-SCC-17A y THP-1 y exposición a partículas
Para construir el modelo in vitro en este estudio. Las células UM-SCC-17A y las células THP-1 se cultivaron en medio de cultivo celular DMEM [22] o RPMI-1640 complementado con FBS al 10% (Gibco, Alemania) y solución de penicilina-estreptomicina al 1% (Gibco, Alemania) a 37ºC. ° C con 5% de CO2. Las células THP-1 se expusieron a soluciones 100 nM de Phorbol 12-miristato 13-acetato (PMA) (Sigma, EE. UU.) Durante 72 h antes de la siembra celular para diferenciarlas en macrófagos. Ambas células se pasaron con tripsina-EDTA al 0,5% cada 3 días, y la morfología celular se verificó todos los días para garantizar la salud de las células.
Las células se sembraron en placas de 24 pocillos a una densidad de 0,1 × 10 6 células / pocillo para células monocultivadas para ensayo de WST-1 y LDH, o sobre cubreobjetos de vidrio estéril en placas de 24 pocillos para microscopía fluorescente. Para el modelo de co-cultivo, las células UM-SCC-17A se sembraron primero en placas de 24 pocillos a una densidad de 50.000 / pocillo durante la noche y luego se añadieron 50.000 / pocillo de células THP-1. Las partículas se suspendieron en 500 µl del medio de cultivo celular respectivo para células UM-SCC-17A y THP-1 monocultivadas o en medio de cultivo celular mixto 1:1 para células cocultivadas y se expusieron a muestras celulares durante 24 h con concentraciones de 5, 10 y 20 µg / mL para el ensayo de WST-1 y LDH o 10 µg / mL para microscopía de fluorescencia.
Para la medición de FACS, las células se sembraron en placas de 12 pocillos de la misma manera que se describió anteriormente a una densidad de 250.000 células / pocillo, o 125.000 células / pocillo cada una para el modelo de cultivo conjunto. Las células se cultivaron en 1 ml de medio de cultivo celular durante la noche y se expusieron a partículas de PLGA a una concentración final de 10 µg / ml durante 24 h.
Ensayo de viabilidad celular
La viabilidad celular se determinó mediante el kit de reactivo de proliferación celular WST-1 (Roche, Alemania) de acuerdo con las instrucciones del fabricante. Brevemente, la solución de WST-1 se diluyó 1:10 en el medio de cultivo celular respectivo para monocultivo UM-SCC-17A o THP-1, o en medio de cultivo celular mixto 1:1 para células cocultivadas. El sobrenadante se drenó después de la exposición y las células se incubaron con 500 µl de solución de trabajo del ensayo WST-1 a 37 ° C durante 30 min. Las muestras se recogieron y centrifugaron a 14.000 rpm durante 10 min para eliminar las partículas. La absorbancia (valor de DO) de las soluciones se midió bajo la longitud de onda de 450 nm usando Infinite ® F200 (Tecan, Estados Unidos). Los valores de absorbancia se corrigieron restando el valor de una muestra en blanco que contenía solo la solución de trabajo WST-1, y las viabilidades celulares relativas se compararon con la muestra de control sin tratar.
Ensayo de fuga en la membrana celular
La liberación de lactato deshidrogenasa (LDH) se midió usando un kit de detección de citotoxicidad comercial (LDH) (Roche, Alemania) para determinar la citotoxicidad por partículas de PLGA. El sobrenadante de las células se recogió 24 h después de la exposición, se centrifugó a 14.000 rpm durante 10 min y se diluyó 1:10 en 200 µl de medio de cultivo celular completo. El control positivo se definió como la liberación total de LDH incubando las células con Triton X-100 al 0,2% a 37 ° C durante 15 min, y diluido 1:50 en 200 µl de medio de cultivo celular completo. Las muestras se incubaron con 100 soluciones de trabajo de ensayo de LDH durante 30 min a temperatura ambiente y la reacción se detuvo usando 50 µl de HCl al 1%. La absorbancia a la longitud de onda de 492 nm se midió usando Infinite®F200 (Tecan, EE. UU.), Y las concentraciones relativas de LDH se calcularon de acuerdo con la siguiente ecuación
$$ {\ text {Relativo}} \; {\ text {LDH}} \; {\ text {concentración}} =\ left ({{\ text {muestra}} \; {\ text {OD}} {- } {\ text {blanco}} \; {\ text {OD}}} \ right) / \ left ({{\ text {positivo}} \; {\ text {control}} \; {\ text {OD} } {-} {\ text {blank}} \; {\ text {OD}}} \ right) \ times 5 \ times 100 \%. $$Microscopía de fluorescencia
Las células se visualizaron mediante tinción de Hoechst para la localización de las partículas bajo el microscopio de fluorescencia. Las células se lavaron con PBS 3 veces después de 24 h de exposición de las partículas y se incubaron con formaldehído al 4% durante 10 min a temperatura ambiente. Después de fijarlas con formaldehído, las células se incubaron con 200 µl de solución de tinción que contenía Hoechst diluido 1:1000. y BSA al 1% en PBS durante 30 min. Luego, los cubreobjetos se movieron sobre un portaobjetos de vidrio boca abajo y se mantuvieron con una gota de agente anti-decoloración de fluorescencia DAKO para visualización. Se establecieron cuatro canales ópticos con un microscopio de fluorescencia, incluido el campo brillante para la morfología celular, DAPI para los núcleos celulares y GFP para las partículas. Los tiempos de exposición del canal de partículas para cada imagen fluorescente se registraron y se utilizaron para la homogeneización de la intensidad de la fluorescencia a través de diferentes partículas, y las partículas intracelulares se calcularon mediante la intensidad de la fluorescencia utilizando áreas seleccionadas al azar por ImageJ (https://imagej.nih.gov/ij /). El índice de absorción a través de diferentes partículas se comparó entre células UM-SCC-17A monocultivadas o cocultivadas. Brevemente, se calculó la intensidad fluorescente media (MFI) de las partículas internalizadas en, por ejemplo, 50 células para cada tipo de célula, que se determinó como el valor de resta entre la intensidad de fluorescencia total ( I total ) de un área específica y la autofluorescencia ( I auto ) del mismo tamaño de área en la ecuación de la región libre de partículas [24, 25]. El índice de captación de las células cancerosas se determinó mediante el MFI de UM-SCC-17A normalizado al de las células THP-1 en un modelo de monocultivo o cocultivo. El cálculo se realizó siguiendo la siguiente ecuación:
$$ {\ text {captación}} \; {\ text {index}} =\ frac {{I _ {{{\ text {total1}}}} - I _ {{{\ text {auto1}}}} \ left ({{\ text {MFI}} _ { {{\ text {UM}} - {\ text {SCC}} - 17A}}} \ right)}} {{I _ {{{\ text {total2}}}} - I _ {{{\ text {auto2} }}} \ left ({{\ text {MFI}} _ {{{\ text {THP}} - 1}}} \ right)}} $$Clasificación de células activadas por fluorescencia (FACS)
La clasificación de células activadas por fluorescencia (FACS) se realizó para medir la capacidad de absorción de tres partículas. Las células se lavaron con PBS tres veces para eliminar el medio celular y las partículas disociativas 24 h después de la exposición y se incubaron con 200 µl de tripsina-EDTA al 0,5% (Gibco, Alemania) a 37 ° C durante 4 minutos para eliminar las células de la placa. . Luego, se detuvo la reacción agregando 2 ml de medio de cultivo celular completo, y la suspensión celular se trasladó a un tubo de vidrio para la medición de FACS y se centrifugó durante 5 min a 300 x G, 4 ° C. El sobrenadante se descargó suavemente y las células se suspendieron en 200 µl de PBS y se conservaron en hielo. Las células vivas se separaron primero de los escombros y las células muertas utilizando la dispersión del lado delantero (FSC-A) (SSC-A). Luego, las células cocultivadas se analizaron usando el canal APC frente a FSC-A para separar las células UM-SCC-17A de los macrófagos en función del tamaño de las células. Se analizaron un total de 30.000 células para cada muestra, y se calculó y normalizó la intensidad de fluorescencia media de cada célula entre diferentes partículas. Mientras tanto, después de 24 h de incubación de partículas con células, se recogieron el sobrenadante del cultivo celular, el tampón de lavado (lavado tres veces para eliminar las partículas residuales adheridas a la superficie celular) y las células (digestión tripsinizada) para medir la intensidad fluorescente utilizando una microplaca. lector (Infinite®F200, Tecan). Mediante este enfoque, el porcentaje de partículas ingeridas por las células se puede determinar para cada grupo, por ejemplo, aproximadamente 30.000 partículas expuestas a una sola célula en 12 pocillos / placa (250.000 células en total) a una dosis de 5 µg de 100 nm. Partículas de PLGA, que dan como resultado un promedio de 13.000 partículas internalizadas por células individuales, que es aproximadamente el 43% de la dosis aplicada administrada a las células. Este porcentaje entregado se puede utilizar además para calcular los recuentos de partículas en el sistema de cultivo conjunto para cada tipo de células en FACS.
Cuantificación de la fusión celular
La fusión de macrófagos con células gigantes multinucleadas (MGC) se definió como una célula gigante que contiene morfológicamente dos o más núcleos dentro de un citoplasma normal, que puede identificarse clara y sincrónicamente en imágenes de campo brillante e imágenes fluorescentes después de la tinción, como se registra en la literatura [26]. . El porcentaje de fusión celular se calculó mediante el número de núcleos MGC (recuento manual) normalizado al recuento total de células, que se determinó con un enfoque automático en ImageJ (https://imagej.nih.gov/ij/).
Análisis estadístico
Se utilizó el software GraphPad V8.0 (GraphPad Software Inc., San Diego, CA, EE. UU.) Para el análisis estadístico y la visualización de resultados. Después de ANONA de una vía, se llevó a cabo el método de Holm-Sidak o la prueba t para comparar resultados de grupos múltiples o resultados de dos grupos, respectivamente. Todos los experimentos se realizaron con triplicaciones independientes y los datos se presentaron como media ± desviación estándar (STD). Resultados con p valor <0.05 (*) y p <0.01 (**) se consideraron significativos.
Resultados y discusión
Caracterización de partículas de poli (ácido láctico-co-glicólico)
Las micrografías de fluorescencia de partículas de PLGA (Fig.1a, b, c) exhibieron una intensidad fluorescente robusta y ninguna disminución significativa en las señales de fluorescencia en el transcurso de 14 d después de la preparación (archivo adicional 1:S1), lo que sugiere una distribución de tamaño relativamente homogénea y alta fluorescencia estabilidad. Como indica el proveedor, las partículas de PLGA de 100, 500 y 1000 nm mostraron tamaños de aproximadamente 80,6 ± 19,3 nm, 542,6 ± 128,3 nm y 951,9 ± 237,5 nm (Fig. 1d, e, f), respectivamente. De acuerdo con las mediciones del potencial zeta, se encontró que las cargas superficiales promedio de las partículas eran - 20,6 ± 5,3, - 17 ± 4,6 y - 16,5 ± 3,5 con un índice de polidispersidad de 0,057, 0,056 y 0,062 para 100, 500 y 1000 nm, respectivamente, que indicaron estos últimos como patrones altamente monodispersos. Todas las partículas se agitaron en vórtex y luego se sonicaron en un baño de agua durante 5 minutos para eliminar en gran medida la agregación de partículas. Sin embargo, se observaron pequeños picos correspondientes a partículas de 100 y 1000 nm con diámetros de aproximadamente 4-6 µm debido a la inevitable agregación de partículas en cantidades muy pequeñas (aproximadamente 3-4%).
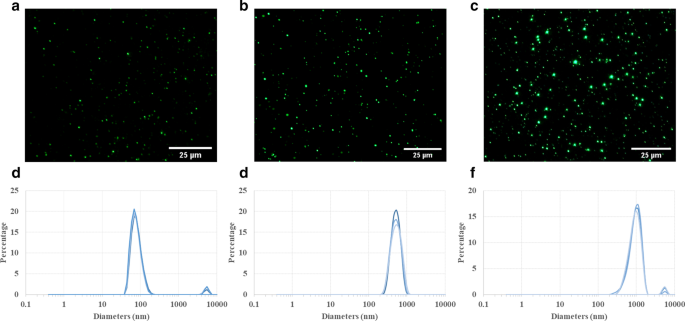
Caracterización de partículas de PLGA. Las micrografías de fluorescencia muestran los diferentes tamaños ( a 100 nm, b 500 nm y c 1 µm) de partículas de PLGA. Esas partículas se pueden detectar con microscopía óptica Olympus mostrando distribuciones de tamaño de partículas relativamente uniformes en suspensión de agua. Las mediciones de dispersión de luz dinámica (DLS) muestran la distribución de tamaño ponderada por volumen para 100 nm ( d ), 500 ( e ), 1 µm ( f ) Partículas de PLGA. A pesar de una pequeña parte de la agregación de partículas (picos más pequeños:3-4%) en suspensiones de PLGA de 100 nm y 1 µm, la distribución general del tamaño de partículas es bastante homogénea debido al pico principal estrecho
Evaluación de la viabilidad celular y citotoxicidad
Debido a su excelente biocompatibilidad y biodegradabilidad, las partículas de PLGA han sido aprobadas por la FDA y la Agencia Europea de Medicina para aplicaciones biomédicas [27, 28]. Por tanto, las partículas de PLGA se han utilizado actualmente en la clínica y se aplican ampliamente en estudios preclínicos como nanoportadores que administran fármacos a regiones o tumores específicos enfermos. Sin embargo, el sistema inmunológico obstaculiza la eficacia de dirección y la eficacia terapéutica de las partículas de PLGA, al menos parcialmente. Por ejemplo, la alta fagocitosis de partículas por las células de Kupffer en el hígado restringió en gran medida la entrada de los portadores de nanofármacos en el sitio del tumor [15]. Por lo tanto, es de vital importancia establecer modelos in vitro avanzados para estudiar la interacción entre células cancerosas, células inmunes y partículas para imitar mejor la situación in vivo de administración de fármacos. UM-SCC-17A es una línea celular de carcinoma escamoso de laringe única aislada de la muestra de cáncer de laringe primario [29]. Sin embargo, la información sobre su eficiencia de absorción celular in vitro en sistemas de cocultivo ( p. Ej. , co-incubación de macrófagos y células cancerosas) sigue siendo insuficiente, una cuestión que debe abordarse para mejorar la capacidad de predicción de las respuestas in vivo. Además, se ha demostrado que el tamaño de las partículas y el recubrimiento de la superficie desempeñan un papel importante en la capacidad de administración a tumores sólidos, sitios enfermos y células cancerosas en modelos animales y cultivos celulares [30,31,32,33]. Aquí, aplicamos tres tamaños de PLGA a células de carcinoma UM-SCC-17A para investigar los efectos del tamaño de partícula sobre la captación celular y la distribución intracelular en sistemas de monocultivo y cocultivo.
Este estudio determinó la viabilidad celular usando el método WST-1 (4- [3- (4-yodofenil) -2- (4-nitrofenil) -2H-5-tetrazolio] -1,3-benceno disulfonato) para monocultivo THP-1 y células UM-SCC-17A, así como un cocultivo de ambos tipos de células. A pesar de que no se produjo una muerte celular obvia en los grupos tratados con PLGA de 100 y 500 nm en todas las concentraciones probadas, las partículas de PLGA de 500 nm y 1 µm en la concentración más alta (20 µg / ml) redujeron significativamente la viabilidad celular en el monocultivo UM-SCC-17A células (Fig. 2a). Como era de esperar, la viabilidad de las células THP-1 no se vio afectada significativamente después de 24 h de incubación con los tres tipos de PLGA a concentraciones de 5 a 20 µg / ml (viabilidad ≥ 95% en comparación con las células no tratadas, cuya viabilidad se considera como 100% , Figura 2b). Idéntico a los resultados del monocultivo de células UM-SCC-17A, la viabilidad celular en el sistema de cocultivo no se vio alterada por la presencia de partículas de PLGA de 100 y 500 nm en las tres dosis utilizadas aquí, mientras que disminuyó significativamente en el grupo tratado con 20 µg / mL 1 µm PLGA (Fig. 2c).
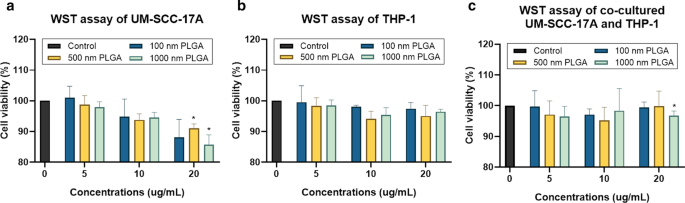
Determinación de la viabilidad celular en células de monocultivo y cocultivo utilizando el ensayo WST. UM-SCC-17A ( a ) y celdas THP-1 ( b ) y células UM-SCC-17A y THP-1 cocultivadas ( c ) fueron tratados con varias concentraciones (5-20 µg / mL) de partículas de PLGA en tres tamaños
La evaluación de la citotoxicidad de las partículas utilizando el ensayo de LDH es para determinar la fuga de la membrana celular midiendo la cantidad de LDH extracelular [9]. La liberación de esta enzima citoplasmática en el sobrenadante del cultivo celular es característica de la lesión de la membrana celular, que conduce a la muerte celular irreversible. A pesar del ligero aumento de los niveles de LDH con dosis más altas en células de monocultivo UM-SCC-17A tratadas con varias dosis de 1 µm de PLGA, no se observó una citotoxicidad clara en las células incluso a la concentración más alta de 20 µg / ml (Fig. 3a) . No es sorprendente que los tres tamaños de PLGA utilizados aquí en varias dosis no pudieron inducir una liberación sustancial de LDH en el sobrenadante, lo que indica los efectos tóxicos insignificantes para el monocultivo de células THP-1, que también es muy consistente con los resultados de viabilidad celular descritos anteriormente (Fig. .3b). En los experimentos de co-cultivo, todas las partículas con diferentes concentraciones mostraron una excelente biocompatibilidad hacia ambas células en términos de niveles de LDH liberados (Fig. 3c). En general, el amplio rango de tamaño de partícula, de 100 nm a 1 µm, que se utilizó aquí cubre los tamaños típicos de nanoportadores (50-200 nm), como liposomas, micelas, dendrímeros, polímeros y miniceldas. Este rango también cubre partículas de tamaño submicrónico (las partículas de 500 nm aún pueden considerarse NP, p. Ej., las partículas con tamaños de alrededor de 500 nm tienen las mismas vías de aclaramiento en el pulmón que las de los NP en 10–100 nm [34] y un tamaño de micra de 1 µm. Ninguna de estas partículas de PLGA mostró citotoxicidad obvia para las células THP-1 y / o UM-SCC-17A en sistemas de monocultivo y cocultivo, excepto las partículas de PLGA de 500 nm y 1 µm en la concentración más alta contra UM-SCC- 17A y células de cocultivo (pero sobreviven más del 85% de las células), lo que indica que son favorables para aplicaciones en sistemas de administración de fármacos.
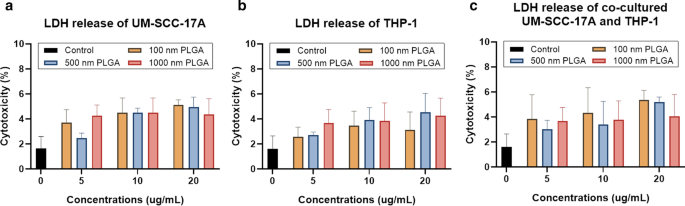
Determinación de la citotoxicidad para células en monocultivo y cocultivo mediante el ensayo de LDH. UM-SCC-17A ( a ) y celdas THP-1 ( b ) y células cocultivadas ( c ) fueron tratados con partículas de PLGA. No se observó una muerte celular significativa después de 24 h de incubación de partículas (con diferentes tamaños y concentraciones utilizadas aquí) y células en sistemas de monocultivo y cocultivo
Capacidades de captación celular de PLGA en sistemas de monocultivo y cocultivo
La Figura 4 muestra la morfología celular (Fig. 4a, d, g), los núcleos celulares y las NP de 100 nm (Fig. 4b, e, h), y las imágenes ampliadas fusionadas (Fig. 4c, f, i) en monocultivo y co- sistemas de cultivo. No se observaron partículas en las células no tratadas del grupo de control (archivo adicional 1:S2). Se observaron aglomerados masivos de NP de PLGA de 100 nm de gran tamaño en el citoplasma celular de las células de monocultivo de macrófagos (Fig. 4c). Mientras tanto, el monocultivo UM-SCC-17A exhibió una excelente capacidad de absorción de PLGA de 100 nm, demostrada por las señales de fluorescencia verde brillante observadas dentro de la membrana celular (Fig. 4f). Para ilustrar mejor la acumulación intracelular de partículas de PLGA en células THP-1 o UM-SCC-17A y partículas extracelulares en los co-cultivos, se aplicaron superposiciones de imágenes de campo brillante con imágenes de fluorescencia como en el archivo adicional 1:S3). En el sistema de co-cultivo, ambos tipos de células son diferenciables en términos de morfología y tamaño celular en las imágenes de campo brillante, en las que los macrófagos mostraron una forma redonda y un tamaño pequeño, mientras que las células cancerosas exhibieron un tamaño grande y una forma alargada. Sin embargo, las células cancerosas mostraron una ingestión celular insuficiente debido a la alta absorción de PLGA de 100 nm por los macrófagos en el sistema de cultivo conjunto. Esto se espera porque los macrófagos se consideran un tipo eficiente y específico de células inmunes para realizar la función de fagocitosis para eliminar microorganismos, alérgenos y partículas extrañas. De manera similar, la Fig. 5 y la Fig. 6 muestran un análisis cualitativo de la capacidad de absorción celular de partículas de PLGA de 500 nm y 1 \ mu m en cultivos de células unicelulares o mixtos, respectivamente. Es de destacar que ambas morfologías celulares no se alteraron después del tratamiento con diferentes tamaños de partículas de PLGA a la concentración de 10 mg / mL utilizada aquí (Fig. 4a, d, g, Fig. 5a, d, gy Fig. 6a, d, g). Las partículas de PLGA de 500 nm y 1 µm mostraron una intensidad de fluorescencia más fuerte en las células UM-SCC-17A únicas (Fig. 5e, f, y Fig. 6e, f) que en las células THP-1 únicas (Fig. 5b, cy Fig. .6b, c). En incubaciones de co-cultivo (Fig. 5h, i, y Fig. 6h, i), hay aparentes disminuciones de señal en las células cancerosas, en las que se encontró que la intensidad de fluorescencia de las partículas era menor que la de los macrófagos. Los macrófagos fagocitaron todo tipo de partículas de forma rápida y eficaz, de modo que las células cancerosas no pueden ingerir suficientes partículas en el sistema de cocultivo. Para cuantificar el efecto de la fagocitosis sobre la capacidad de absorción de las células cancerosas para diferentes tamaños de partículas de PLGA, se realizó un análisis óptico semicuantitativo. Brevemente, las intensidades de fluorescencia de las partículas se calcularon sobre la base de, por ejemplo, 50 células cargadas de partículas individuales para lograr un valor medio para ambos tipos de células, y el índice de absorción de las células cancerosas se determinó promediando la intensidad de fluorescencia de las partículas intracelulares por cáncer. célula normalizada a la de los macrófagos (Fig. 7). En monocultivo, se encontró que el índice de captación de células cancerosas para PLGA de 100 nm era de aproximadamente 1,34 ± 0,19, lo que sugiere que las células cancerosas han ingerido más partículas que las ingeridas por macrófagos en el cultivo unicelular (Fig.7). Esto no es sorprendente debido al alto nivel de viscosidad de las partículas de PLGA y al mayor tamaño de las células cancerosas de laringe. De manera similar, las células cancerosas también internalizaron en gran medida PLGA de 500 nm y 1 µm con índices de absorción de aproximadamente 1,5 ± 0,25 y 1,4 ± 0,31, respectivamente, en monocultivo. Los índices de absorción de partículas grandes se redujeron sustancialmente (0,59 ± 0,12 y 0,47 ± 0,1) en presencia de macrófagos en sistemas de cocultivo. Mientras tanto, idénticas capacidades de internalización celular para ambos tipos de células después de 24 h de incubación de partículas de PLGA de 100 nm en el cultivo celular mixto. Overall, the results accumulated here suggested that the ingestion of particles by cancer cells and macrophages might depend on different routes of uptake pathway in single-cell culture and co-culture environment. Moreover, the presence of macrophages reduced the cellular internalization of PLGA particles by cancer cells particularly for large ones, a biological event that has been observed in in vivo nanomedicine drug delivery studies [3, 15].
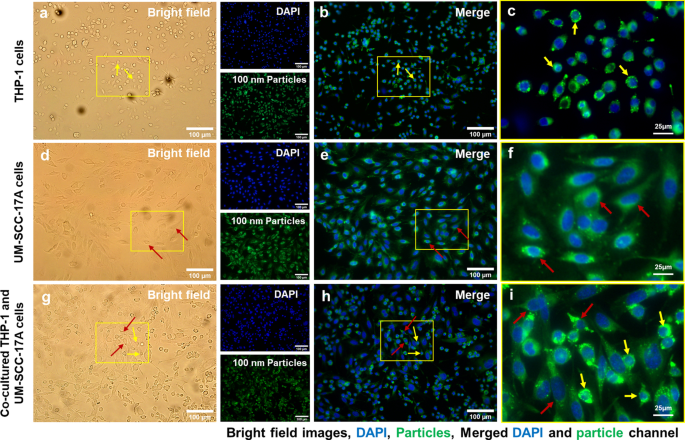
Microscopic examination of cellular internalization of 100 nm PLGA nanoparticles in monoculture and co-culture cells. Single type of cells or mixed cells was treated with 100 nm PLGA nanoparticles for 24 h at 37 °C at a concentration of 10 µg/mL. Cells were observed under bright-field (a , d , g ) and fluorescent channels (b, e, and h) with particles observed at the green channel and cell nuclei in the blue channel after stained with Hoechst. Massive cellular uptake of 100 nm PLGA nanoparticles can be visualized in magnified images (c , f , yo ) for monoculture THP-1 macrophages (yellow arrows) and laryngeal cancer cells UM-SCC-17A (red arrows). In the co-culture system, 100 nm PLGA nanoparticles were still highly ingested by macrophages but less efficient for cancer cells compared to single cultured cells
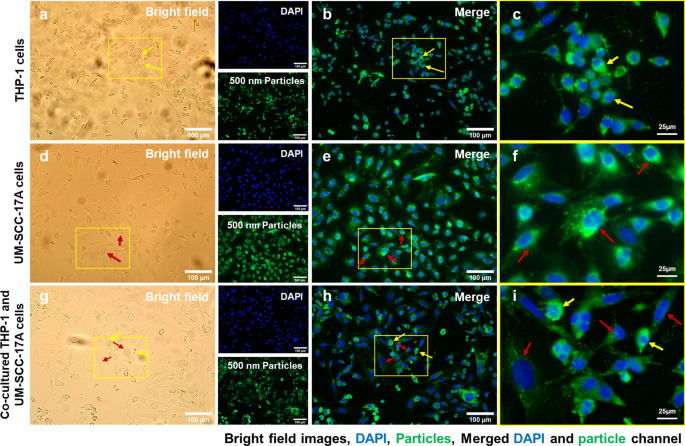
Microscopic examination of cellular internalization of 500 nm PLGA nanoparticles in monoculture and co-cultured cells. Single type of cells or mixed cells was treated with 500 nm PLGA nanoparticles for 24 h at 37 °C at a concentration of 10 µg/mL. Cells were observed under bright-field (a , d , g ) and fluorescent channels (b , e , h ) with particles observed at the green channel and cell nuclei in the blue channel after stained with Hoechst. Massive cellular ingestion of 500 nm PLGA nanoparticles can be visualized in magnified images (c , f , yo ) for monoculture THP-1 macrophages (yellow arrows) and laryngeal cancer cells UM-SCC-17A cells (red arrows). In the co-culture system, 500 nm PLGA nanoparticles were still highly uptake by macrophages, while cancer cells had inadequate particle internalization
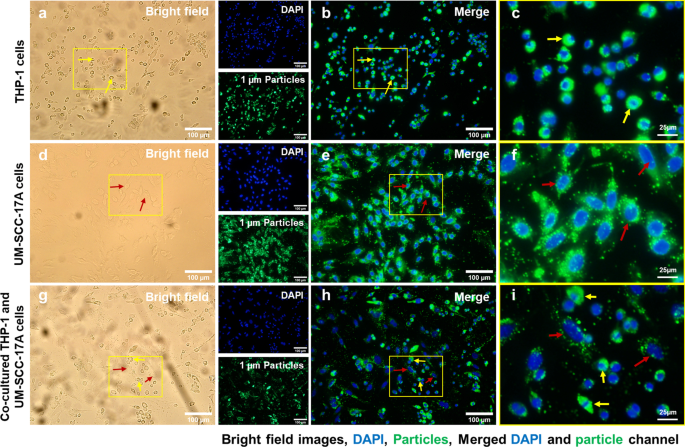
Microscopic examination of cellular internalization of 1 µm PLGA particles in monoculture and co-culture cells. Single type of cells or mixed cells was treated with 1 µm PLGA particles for 24 h at a concentration of 10 µg/mL. Cells were observed under bright-field (a , d , g ) and fluorescent channels (b , e , h ) with particles observed at the green channel and cell nuclei in the blue channel after stained with Hoechst. A large amount of particle uptake and tremendous accumulation of 1 µm PLGA particles can be visualized in magnified images (c , f , yo ) for monoculture THP-1 (yellow arrows) and UM-SCC-17A laryngeal cancer cells (red arrows). In the co-culture system, 1 µm PLGA particles were still efficiently uptake by macrophages, while cancer cells had insufficient particle ingestion
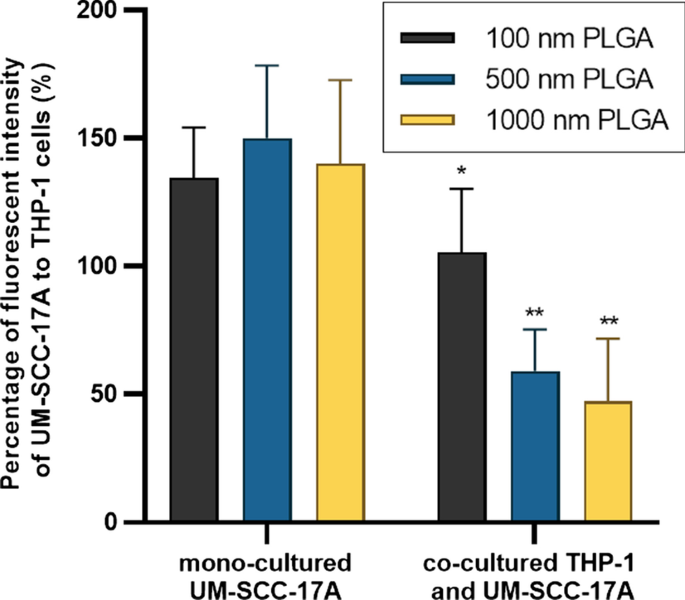
Quantitative analysis of PLGA particle internalization in UM-SCC-17A cells in monoculture and co-culture systems. The percentage of particle fluorescent intensity in UM-SCC-17A cells normalized to that in THP-1 cells for solely and mixed cultured cells
Quantification of cellular uptake by flow cytometry
Flow cytometry is widely used to determine of particle-cell interplay in a quantitative manner, for example, the size-dependent uptake of polystyrene particles with sizes ranging from 20 to 1000 nm by dendritic cells in vivo [35]. FACS was thus utilized for analysis of the percentage of NP-positive cells and particle number in those NP-positive cells in monoculture and co-culture systems. Then, average NP counts in a single cell were calculated by determining the total fluorescence intensity in particle-laden cells normalized to the fluorescence of total applied dose. For example, about 70% of 500 nm PLGA was deposited in the cancer cells, whereas the residual was kept in the supernatant of cell cultures (Additional file 1:S4). This fluorescence intensity measured by a Tecan reader was then compared to the average/total FACS signals (FITC signal values of P5 and P6 in Fig. 8,) to estimate the particle number in the co-culture system. As seeded in the co-cultured cells, about half of the cells were recognized as macrophages and the rest were considered as cancer cells. It was observed that approximately 13,000 of single 100 nm PLGA particles accumulated in cancer cells and 9700 particles in macrophages (Fig. 8i) in the monoculture, consistent with the above microscopic examinations. A much lower particle number (164 ± 30 and 45 ± 15) was ingested by monocultured cancer cells for 500 nm and 1 µm PLGA, with a slightly lower particle count in the respective macrophages (Fig. 8i). The number of particles ingested by single cells is in great agreement with the literature records [24]; for instance, an average 2500 of gold NPs coated with cetyltrimethylammonium bromide were deposited in epithelial cells, while PEG-modified gold NPs only had a few tens per cell [36]. In co-culture systems, unexpectedly, there is a slight increase of 100 nm particle number in cancer cells, despite a higher enhancement of NP internalization by macrophage. Comparing to the uptake index in the single-cell to mixed cell culture, it also reduces about 25% for 100 nm PLGA particles. The uptake indices were found to significantly decline with around 2.5 and 3 folds reduction in co-cultured system for 500 nm and 1 µm PLGA, respectively (Fig. 8i). Generally, it was found that the existence of macrophages largely affects the uptake ability of cancer cells especially for large particles, which is also in excellent agreement with the above observations.
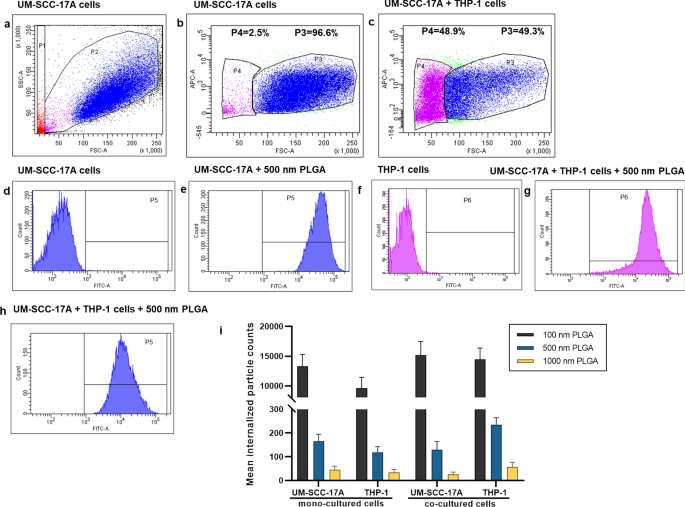
Particle uptake quantification in monoculture UM-SCC-17A cells and co-culture with THP-1 cells by flow cytometry. Grating strategy to identify respective cell populations in mixed cell culture (a - h ). Gating is showing one representative experiment of cells exposure to 500 nm PLGA particles. With initial live gating in the y-axis with a side scatter (SSC-A) and x-axis with a forward scattering (FSC-A), P2 a were further gated with FSC-A versus APC-A to differentiate the THP-1 cells in P4 c from UM-SCC-17A cell population in P3 (monoculture cells (b ) and mixed cells (c )). The cell population of P3 further displayed as counts versus FITC plots (P5) in non-exposed cells (d ), monoculture cells (e ), and co-cultured cells (h ). Also, P6 is the counts versus FITC-A plot originated from P4 population in non-exposed cells (g ) and co-cultured cells (f ). Both types of cells efficiently ingested the 500 nm PLGA indicated by the solid histogram completed shifted to the right side of the x -axis, indicating particles are taken up by all exposed cells. Quantification of particle-laden numbers (i ) in both types of cells for mono-culture and co-culture systems
Currently, different uptake pathways by cancer cells in ingesting particles with different sizes and surface modifications like clathrin-mediated endocytosis, caveolae-mediated endocytosis, clathrin- and caveolae-independent endocytosis, micropinocytosis, and macropinocytosis have been claimed in the literature [37]. For instance, it has been proved that iron oxide aggregates with a size of < 200 nm are taken up by MCF-7 cells through the clathrin-mediated endocytosis, whereas larger aggregates tend to be ingested via macropinocytosis [38]. Another study has demonstrated that 100 nm plain polystyrene particles tended to be taken up mainly through macropinocytosis, whereas the internalization of carboxylated polystyrene particles prefer to occur via the clathrin-mediated endocytic route [25]. Phagocytosis is a classical uptake pathway for immune cells such as neutrophils, dendritic cells, and most importantly monocytes/macrophages. The uptake pathways tightly depend on various parameters of drug delivery vesicles, e.g. , the particle size, chemical composition, surface modification, proteins in the culture environment, as well as cell type. Usually, multiple uptake pathways can be involved in particle ingestion such as the caveolae-mediated endocytosis, clathrin-mediated endocytosis, and macropinocytosis, which has been found to participate in cellular internalization of 300–400 nm chitosan NPs in human HeLa cells [39]. It has also been observed that 63 nm cholesterol-modified pullulan NPs enter into the human hepatocellular carcinoma (HepG2) cells via macropinocytosis and clathrin-mediated endocytosis [40]. Several previous studies showed that PLGA particle cell uptake involves different endocytic pathways, in which clathrin-independent endocytosis is the main route responsible for the internalization of PLGA in in vitro models [23, 24, 37]. Nevertheless, once they entered into the cells, PLGA particles applied here were highly potentially entrapped by the endo-lysosomal system consisting of early endosomes, recycling endosomes, late endosomes, and lysosomes [41]. It should be noted, however, that there is a lack of studies showing the cellular uptake mechanisms in co- or tri-cultured systems in vitro, a notion that has to be probe in the future.
Induction of cell fusion by PLGA NPs
Extensive scientific evidence has shown that the fusion of monocytes/macrophages into multinucleated giant cells (MGCs) occurred in a broad range of biological processes [42, 43]. Generally, implantation of biomaterials into the body causes a foreign body response characterized by the fusion of macrophages into MGCs and fibrotic encapsulation [44]. A wide type of human and murine primary cells like alveolar macrophages, splenic macrophages, microglia, bone-marrow-derived macrophages, and blood monocytes, as well as cell lines such as RAW264.7 and UG3 were also frequently observed to form MGCs in vitro [26, 45]. It is well-known that the macrophages form a fusogenic phenotype when they are unable to ingest foreign materials via phagocytosis because of the large size of particles or implants. So far, it is unclear whether in vitro macrophage cell fusion relates to the particle size in the range 100–1000 nm, which can be easily phagocytized. Here, the cell fusions were observed in all groups by microscopic examination (Fig. 9). The cellular fusion was confirmed only when multiple nuclei were found to share the same cytoplasm in both fluorescence images and bright-field images. Spontaneous formation of giant cells by THP-1 cells was occurred in the control group without particle treatment (Fig. 9a), with a fusion percentage of about 10% of the total cells (Fig. 9h), as reported in the literature [46]. Size-dependent cellular fusion was found for 100 and 500 nm PLGA particles, whereas 1 µm PLGA-induced insignificant enhancement of fusions in monoculture. This may be due to the small number of 1 µm PLGA particles exposed to cells (approximately 60 particles exposed to each cell at a concentration of 10 µg/mL). When the macrophages were co-cultured with cancer cells, the percentages of MGC formation were increased in all groups in comparison with the corresponding monoculture groups. In particular, there is a significant increment of cellular fusion for 1 µm PLGA (19%) in the mixed cell culture. The most prominent increase in fusion occurred in co-cultured 500 nm PLGA particles, which might be attributed to the large size of particles and sufficient particle numbers ingested per cell.
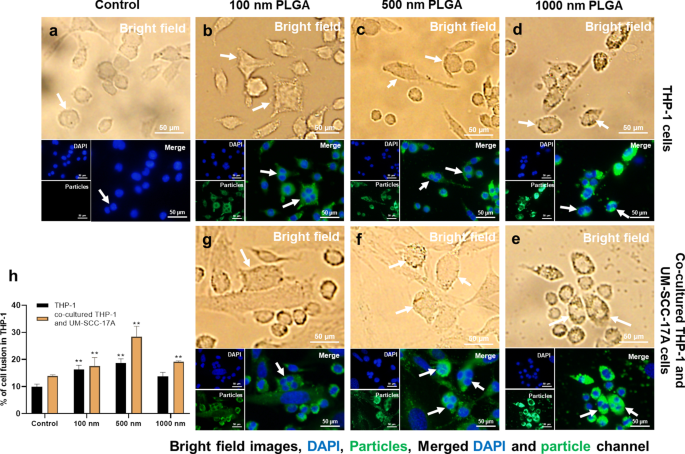
Visualization and quantification of THP-1 cell fusion in monoculture and co-culture systems. Cell fusion occurred in all groups including the control group without particle treatment for THP-1 cells (a ). Monocultured (b , c ) 100 nm and 500 nm NP-induced significant cell fusion compared to 1 µm PLGA group (d ), which has a slightly higher level than that of the control group. In co-cultured systems, 100 nm (g ) and 1 µm (e ) PLGA had an identical percentage of cellular fusion, which is apparently smaller than that of 500 nm group (f ). Quantification of cell fusion for all groups after 24 h incubation was displayed in h
The molecular machinery involved in macrophage fusion has been widely probed, achieving substantial progress [43]. For example, the formation of macrophage fusion receptors CD47and CD44 together allowed mediating the process of macrophage fusion, and subsequent the differentiation of giant cells [42] and miR-223 delivery by a NP vesicle permitted attenuating it [47]. Hence, further study should focus on the determination of key molecules in regulating particle-induced macrophage fusion and the dominant receptors expressed in the giant cell membrane. Another important concern is the fate of MGCs. It is believed that MGCs fused with particles or stimuli might subsequently experience the process of apoptosis or necrosis [48]. This may lead to the release of undigested particles or other giant materials to the other cells in vitro or biological tissues in vivo, further inducing the long-term inflammatory response or granulomas. On the other hand, the macrophage fusion itself may be benefit for NP drug delivery, for example, in tumorous tissues, the re-release of drugs from macrophages to the cancer cells might represent an enhanced tumor killing ability. More importantly, future nanomedicine study should address how to exploit the application of macrophage fusion for nanocarrier drug delivery to improved disease diagnosis and therapy. This is because not only macrophages an abundant type of immune cells in the body with the excellent uptake ability of nano-drugs, but also they may be used in targeted gene delivery for repair of injured tissues.
Conclusión
To the best of our knowledge, this study first reported the competitive cellular uptake of PLGA particles with sizes ranging from 100 nm to 1 µm in co-cultured UM-SCC-17A laryngeal cancer cells and THP-1 monocytes/macrophages. The data collected here proved that immune cells may alter/lower the particle internalization by cancer cells in vitro, which is similar to the previous findings in in vivo nanocarrier drug delivery studies. Size-dependent and cell culture-related macrophage cellular fusion caused by PLGA particles has also been demonstrated here. Future studies should probe the uptake mechanism in co-cultured systems and design novel approaches to achieve a higher uptake index for laryngeal cancer cells in the presence of phagocytes. Moreover, elaborate evaluation of intracellular trafficking and fate of nano-drug-carriers in co- or tri-cultured systems in 3D, which better mimic the in vivo conditions, is needed prior to the utilization of animal studies in vivo and even in clinical trials.
Disponibilidad de datos y materiales
Todos los datos generados o analizados durante este estudio se incluyen en este artículo publicado [y sus archivos de información complementaria].
Abreviaturas
- PLGA:
-
Poly(lactic-co-glycolic acid)
- HNSCC:
-
Head and neck squamous cell carcinoma
- EPR:
-
Enhanced permeability and retention
- NP:
-
Nanopartículas
- ICG:
-
Indocyanine green
- MPS:
-
Mononuclear phagocyte system
- LDH:
-
Lactato deshidrogenasa
- FACS:
-
Fluorescence-activated cell sorting
- MGC:
-
Multinucleated giant cells
- DLS:
-
Dispersión de luz dinámica
Nanomateriales
- Nanofibras y filamentos para una mejor administración de fármacos
- Demostración de un biosensor flexible basado en grafeno para la detección rápida y sensible de células de cáncer de ovario
- Nanopartículas para la terapia del cáncer:avances y desafíos actuales
- Nanopartículas de FePO4 biocompatibles:administración de fármacos, estabilización de ARN y actividad funcional
- Administración de medicamentos basados en células para aplicaciones de cáncer
- Nanopartículas de lípidos de PLGA trazadas con 131I como portadores de administración de fármacos para el tratamiento quimioterapéutico dirigido del melanoma
- Nanopartículas de quitosano cargadas con genisteína y bioflavonoides dirigidas al receptor de folato para un efecto anticancerígeno mejorado en los cánceres de cuello uterino
- Comparación entre el ácido fólico y la funcionalización basada en péptidos gH625 de nanopartículas magnéticas de Fe3O4 para una internalización celular mejorada
- Potencial de activación antiproliferativa y de apoptosis de nanopartículas de lípidos dirigidos a base de paclitaxel con internalización celular mejorada por receptores de transferrina:un estudio …
- Influencia del dopaje de Mg en nanopartículas de ZnO para una evaluación fotocatalítica mejorada y análisis antibacteriano
- Entrega novedosa de mitoxantrona con nanopartículas de pululano modificadas hidrofóbicamente para inhibir las células cancerosas de la vejiga y el efecto del tamaño de los nanofármacos en la efic…



