Síntesis y propiedades de puntos cuánticos de CdTe de aleación de Mn emisor de azul soluble en agua
Resumen
En este trabajo, preparamos puntos cuánticos CdTe y series de Cd 1-x Mn x Puntos cuánticos te-aleados con distribución de tamaño estrecha mediante una reacción de intercambio iónico en una solución acuosa. Descubrimos que los picos de fotoluminiscencia se desplazan a energías más altas con el aumento de Mn 2+ contenido. Hasta ahora, este es el primer informe de puntos cuánticos basados en CdTe emisores de azul. Por medio de voltamperometría cíclica, detectamos características de actividad electroquímica de niveles de energía de manganeso formados dentro del Cd 1-x Mn x Band gap de punto cuántico aleado con te. Esto nos permitió estimar su posición energética. También demostramos el comportamiento paramagnético para Cd 1-x Mn x Puntos cuánticos te-aleados que confirmaron la exitosa reacción de intercambio iónico.
Antecedentes
Las propiedades ópticas de los puntos cuánticos (QD) se pueden manipular dopando / aleando mediante el diseño de la composición. En consecuencia, la posibilidad de control sobre la incorporación de elementos de dopaje / aleación en las celosías QDs juega un papel importante para un gran número de aplicaciones. En particular, los QD aleados con Mn son uno de los materiales más prometedores para la detección de fluorescencia y la formación de imágenes por resonancia magnética. En consecuencia, ya se han desarrollado técnicas de síntesis para la obtención de Mn 2+ - ZnS, ZnSe, CdSe, CdS dopado / aleado y QD de núcleo / carcasa CdTe / CdS [1,2,3,4,5,6]. También hay una serie de trabajos que describen las capacidades de Mn 2+ - y Zn 2+ -síntesis de QD de CdTe dopado / aleado [7,8,9,10]. La obtención de tales composiciones en solución acuosa depende en gran medida del pH, lo que dificulta el dopaje. Cheng y col. demostraron que el medio alcalino obstaculizaba la nucleación y el crecimiento de las QD de CdTe aleadas con Zn [10]. Además, existe una alta probabilidad de aparición de Zn (OH) 2 en la superficie de las QD que inhibe el crecimiento de las QD iniciales formando una capa de ZnO en la superficie de las QD. Se llevan a cabo procesos similares en un intento de preparar un CdSe QD aleado con Mn en una solución acuosa alcalina [11]. En este caso, Mn 2+ la solvatación ocurre en lugar del intercambio iónico de Cd 2+ por Mn 2+ . Por otro lado, la diferencia de la constante de solubilidad de MnTe y CdTe indica una reacción de sustitución ineficaz entre Mn 2+ y CdTe [12].
En este trabajo, aplicamos el procedimiento sintético descrito en nuestro trabajo anterior [13] para la síntesis de Cd 1 − x Mn x QDs te-aleados. Para asegurar un proceso de aleación de Mn exitoso, se eligieron las condiciones óptimas de pH neutro. Dicho enfoque eliminó la formación de hidróxido de manganeso durante la síntesis que nos permitió obtener Cd 1 − x emisor de azul. Mn x QDs te-aleados mediante una reacción de intercambio iónico. Los estudios sistemáticos de sus propiedades ópticas y electroquímicas permiten una mejor comprensión de los cambios en la estructura de la banda durante la transformación de CdTe QD en Cd 1 − x Mn x QD aleados.
Métodos
Síntesis de CdTe y Cd 1-x Mn x QD aleados
CdTe y Cd 1-x estabilizados con ácido tioglicólico solubles en agua Mn x Los QD con aleación de te se sintetizaron de acuerdo con nuestro método de tres pasos modificado previamente informado [13]. En primer lugar, los nanoclusters de CdTe se sintetizaron utilizando un método sencillo a temperatura ambiente [14] con ácido tioglicólico como estabilizador. Los nanoclusters de CdTe obtenidos se dividieron en seis alícuotas diferentes de 50 ml. En segundo lugar, las soluciones coloidales obtenidas de nanoclusters de CdTe se sometieron a Mn 2+ Aleación debido al proceso de intercambio iónico con diferentes cantidades de MnSO 4 sal en alícuotas de 50 ml de soluciones bajo tratamiento con ultrasonidos. Las concentraciones de Mn 2+ iones añadidos fueron 1, 5, 10, 15 y 20% de Cd 2+ contenido en las mezclas de reacción (RM). Además, se utilizó como control una alícuota de nanoclusters de CdTe puro. El paso final fue un tratamiento térmico mediante calentamiento por microondas en el horno de microondas a 700 W durante 3 min.
Procedimientos de medición y caracterización de materiales
Los espectros de absorción y fotoluminiscencia (PL) se midieron a temperatura ambiente con el espectrofotómetro OceanOptics USB-2000. Los voltamogramas cíclicos (CV) se registraron utilizando un potenciostato / galvanostato controlado por computadora “ΠИ-50-1”. Se utilizó un sistema de tres electrodos que constaba de un electrodo de trabajo de platino, un contraelectrodo de carbón vítreo y un electrodo de referencia de Ag / AgCl. Los voltamogramas cíclicos se obtuvieron escaneando el potencial de - 2 a 2 V a una velocidad de escaneo de 100 mV s −1 . Imágenes de microscopía electrónica de transmisión (TEM) obtenidas con el microscopio Selmi TEM-125 K a un voltaje de aceleración de 80,00 kV. El análisis elemental de Cd 1-x soluble en agua Mn x Las muestras QD con aleación de te purificadas por precipitaciones múltiples se midieron mediante espectroscopía de emisión atómica (AES) С115М1. Los espectros de EPR se registraron utilizando un espectrómetro de EPR de banda "Radiopan" a 300 K. Modulación de cien kilohercios del campo magnético con una amplitud de 0,1 mT. Se utilizaron programas de Visual EPR para el procesamiento (deconvolución, ajuste y modelado) de los espectros obtenidos [15]. Las muestras de polvo que contienen QD se prepararon mediante la precipitación de QD de la solución acuosa mediante el método descrito en [16]. Las muestras se secaron a 35 ° C durante 5 h. La composición de fase de las muestras se determinó mediante mediciones de XRD en polvo utilizando un difractómetro Bruker D8 Advance. La identificación de la fase cristalina de Cd 1-x Mn x Se realizó utilizando la tarjeta de base de datos XRD:ICSD no. 040413 (software Match! Versión 3.6.0.111).
Resultados y discusión
Caracterización estructural de CdTe y Cd 1-x Mn x QD aleados
Análisis TEM
Las imágenes TEM de Cd 0.91 Mn 0.09 Los QD de Te-aleación indicaron que el diámetro medio es coherente con el diámetro de los QD de CdTe calculados a partir de las mediciones espectroscópicas de acuerdo con el método descrito en [14]. La Figura 1 muestra una imagen TEM para Cd 0.91 Mn 0.09 QDs te-aleados. Se observó la gran mayoría de QD con un tamaño medio de 2,3 ± 0,3 nm. Esto confirma nuestra suposición de que el tamaño de las partículas permanece sin cambios durante la aleación de Mn. Además, se observaron objetos más grandes de forma irregular. Se puede ver que esos objetos constan de múltiples QD de menor diámetro. Con base en estos datos, podemos concluir que los objetos más grandes son agregados formados durante la preparación de las muestras para el análisis TEM.
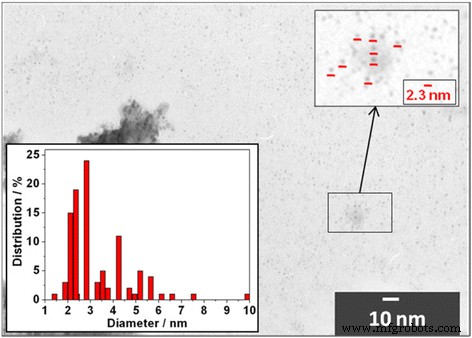
Imagen TEM de Cd 0.91 Mn 0.09 QDs te-aleados. Recuadro:histograma que ilustra el Cd 0.91 Mn 0.09 Distribución de diámetro QD de aleación te.
Análisis de espectroscopia de emisión atómica
Anteriormente se demostró que solo alrededor del 20% del Cd 2+ Los iones de la solución precursora participan en la formación de las QD de CdTe mediante este método de síntesis [13].
La composición elemental del CdTe y la serie de Cd 1-x Mn x Los QD con aleación de te se determinaron mediante espectroscopía de emisión atómica (AES). El contenido de cadmio y manganeso se evaluó mediante la relación de Cd:Mn (mg / l) para la serie de Cd 1-x Mn x QDs te-aleados con diferente contenido de Mn 2+ iones (Tabla 1).
Es interesante notar que la aleación de Mn ha ocurrido de manera desigual con el aumento de Mn 2+ concentración en las mezclas de reacción. Se ve claramente que la adición de aproximadamente 1% Mn 2+ iones (relativo al contenido de Cd 2+ iones en la mezcla de reacción) a la solución coloidal recién preparada de nanoclusters de CdTe conduce a la formación de Cd 0.96 Mn 0.04 QDs te-aleados. Por otro lado, cuando la concentración de Mn 2+ añadido fue del 5%, la formación de Cd 0.97 Mn 0.03 Se observaron QD con aleación de te. Este desacuerdo puede sugerir que el proceso de aleación de Mn es más eficiente en presencia de un pequeño exceso del componente de aleación. Una adición adicional de 10, 15 y 20% de Mn 2+ iones conduce a una aleación de Mn consistente con CdTe QDs.
Caracterización espectroscópica
Las propiedades ópticas del CdTe y Cd 1-x preparados Mn x Se estudiaron las QD con aleación de te mediante espectros de absorción y fluorescencia de la región Vis. La Figura 2 ilustra una absorción típica (a) y un espectro de PL (b) de CdTe y una serie de Cd 1-x Mn x QDs te-aleados. Dependiendo del Mn 2+ incorporado en CdTe, observamos un cambio hipsocrómico de los picos de absorción a la longitud de onda más corta. Además, se observó el desplazamiento al azul de los picos PL de 542 a 496 nm. Existe un cierto desajuste entre el cambio hipsocrómico de absorción y los picos de PL para las muestras 2 (línea roja) y 3 (línea azul) que probablemente se deba a una aleación irregular de Mn.
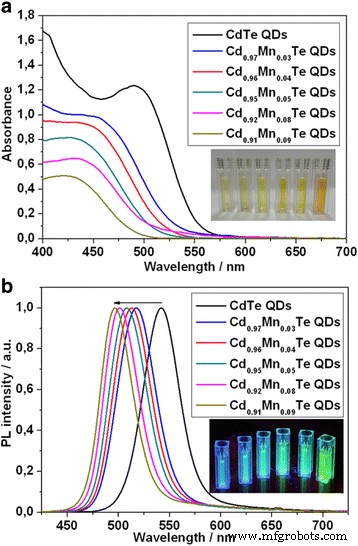
Absorción ( a ) espectros de CdTe y series de Cd 1-x Mn x QDs te-aleados con diferente contenido de Mn 2+ iones. Recuadro:las imágenes de CdTe y la serie de Cd 1-x Mn x QD con aleación de te bajo luz de lámpara de luz diurna. PL normalizado ( b ) espectros de CdTe y series de Cd 1-x Mn x QDs te-aleados con diferente contenido de Mn 2+ iones. Recuadro:las imágenes de CdTe y la serie de Cd 1-x Mn x Te QD bajo luz ultravioleta
Cabe señalar que la intensidad de fluorescencia del Cd 1-x Mn x Los QD con aleación de te disminuyeron con el aumento de Mn 2+ contenido de iones (archivo adicional 1:Figura S1). Puede explicarse por la conjunción parcial de Mn 2+ iones que no participan en el proceso de aleación y presencia de un estabilizador (ácido tioglicólico), que puede apagar la fluorescencia de QD [17].
Caracterización voltamétrica cíclica
Se aplicó un método de voltamperometría cíclica (CV) para comprender los cambios en la estructura de la banda como resultado de la transformación de CdTe QD en Cd 1-x Mn x QDs te-aleados debido al aumento de Mn 2+ contenido.
En el CV típico de los QD de CdTe coloidal, observamos (Fig. 3a) picos catódicos y anódicos a -1,00 V (marcados como C1) y 1,48 V (marcados como A1), respectivamente. El valor de la energía de la banda prohibida de 2,48 eV, calculado de acuerdo con el método descrito en [18], concuerda bien con la banda prohibida óptica de 2,50 eV obtenido a partir de los máximos del pico de absorción.
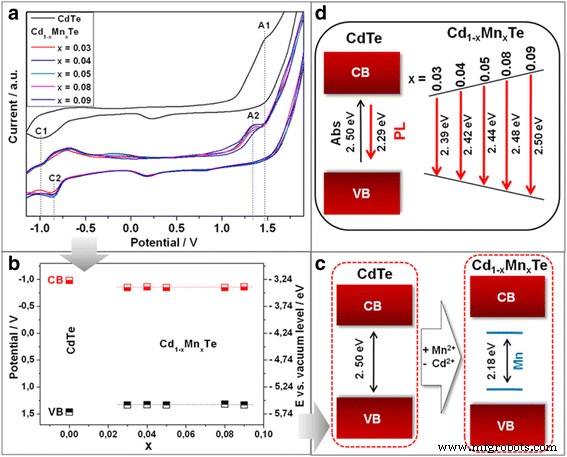
Voltamogramas cíclicos de CdTe coloidal y series de Cd 1-x Mn x QDs te-aleados con diferentes Mn 2+ contenido de iones ( a ). Gráfico de posiciones de borde de banda de valencia (VB) y conducción (CB) para CdTe y la serie de Cd 1-x Mn x QDs te-aleados, obtenidos de las respectivas posiciones pico anódico (A) y catódico (C) ( b ). Esquema de la electroquímica ( c ) y óptico ( d ) formación de señales
Basado en las propiedades ópticas de Cd 1-x Mn x QD con aleación de Te, esperábamos observar oxidación a potenciales más positivos y reducción a potenciales más negativos para Cd 1-x Mn x QDs te-aleados, con aumento de Mn 2+ contenido en Cd 1-x Mn x QDs te-aleados debido al aumento de la energía de la banda prohibida. Sin embargo, la separación entre el pico de oxidación A2 y el pico de reducción C2 es demasiado pequeña para correlacionarse con la energía de la banda prohibida calculada a partir de los espectros de fotoluminiscencia. Curiosamente, la diferencia de potencial de 2,18 V entre C2 y A2 es absolutamente idéntica para toda la serie de Cd 1-x Mn x Muestras de QDs te-aleados (Fig. 3a, b).
Como lo muestran Beaulac et al., Se observaron tiempos de desintegración de PL excitónicos de hasta 5 μs para el Cd coloidal 1-x Mn x Se ( x =0.004 ± 0.002) QDs (d ≈ 2.2 nm) a 293 K, que surgen como resultado del equilibrio térmico entre los estados excitónicos de CdSe y el estado excitado de campo de ligando de muy larga duración del Mn 2 + dopantes. Por lo tanto, el dopaje con Mn no apaga el PL excitónico de Cd 1-x Mn x Se QDs. En cambio, los efectos de extinción de Mn 2+ PL por transferencia de energía de retroceso asistida térmicamente al Cd 1-x Mn x Se producen estados excitónicos de QD. [4].
Podemos suponer que en el caso de Cd coloidal 1-x Mn x QDs te-aleados (d ≈ 2,3 nm) a temperatura ambiente, ocurre un fenómeno muy similar. Usando el método CV, la actividad electroquímica de los niveles de energía de manganeso "oscuro" dentro del Cd 1-x Mn x Se detectó una banda prohibida de QD con aleación de te (Fig. 3b, c). Propiedades ópticas de Cd 1-x Mn x Los QD con aleación de te muestran un aumento de la energía de la banda prohibida con un aumento de Mn 2+ contenido como resultado de fenómenos de transferencia de energía de retorno (Fig. 3d).
Análisis XRD
Archivo adicional 1:La Figura S2 muestra los espectros XRD para CdTe y la serie de Cd 1-x Mn x Muestras secas QD con aleación de Te que se precipitaron de una solución acuosa con alcohol isopropílico.
El espectro XRD para el barrido de QD de CdTe en el rango de dos theta de 20 ° -60 ° muestra un pico de difracción a 25 °, que se asigna a los planos cristalinos (111) de CdTe con estructura cristalina cúbica [19]. Este pico es significativamente más ancho que el de los materiales a granel debido al pequeño tamaño de los QD con una distribución de tamaño estrecha. La señal en los patrones XRD de todas las series de Cd 1-x Mn x Los QD con aleación de te se desplazan hacia ángulos más altos. El pico a 30 ° -35 ° se puede deconvolucionar en dos picos a 30 ° y 35 °, que se asignan a los planos (200) y (220) de Cd 1-x Mn x Te aleación. Estos resultados pueden indicar la formación de Cd 1-x Mn x Te con estructura cúbica. Dichos datos de XRD confirman que los QD de CdTe se sometieron al proceso de aleación de Mn con éxito. Cabe destacar que el pico centrado en 25 ° decae en el patrón XRD de Cd 0.97 Mn 0.03 Los QD aleados y desaparecen en los patrones XRD de las muestras con Mn 2+ más alto contenido. En el caso de Cd 0.97 Mn 0.03 La muestra de QDs, concluimos la formación de núcleo / capa CdTe / Cd 1-x Mn x Los QDs donde la señal de Cd 1-x Mn x El shell filtra la señal del núcleo de CdTe. Para todas las muestras posteriores, un pico de difracción amplio a 30 ° -35 ° puede atestiguar la aleación adicional de Mn de CdTe QD y la formación de un Cd 1-x más grueso. Mn x Te shell. Generalmente, esto conduce a la formación de QD con mayor contenido de manganeso.
Medidas de EPR
Los espectros EPR de Cd 0.97 Mn 0.03 Los QD con aleación de te se muestran en la Fig. 4. El espectro consta de seis líneas asimétricas que se superponen a la amplia señal subyacente. La presencia de seis líneas en el espectro es típica de Mn 2+ iones en los sistemas desordenados [2, 20, 21, 22]. Sin embargo, la forma del espectro es más compleja que la trivial Mn 2+ -señal relacionada. Un análisis detallado ha demostrado que el espectro EPR experimental se puede describir como una superposición de tres señales:gaussiana amplia con un ancho de línea de 50 mT y dos sextetos con líneas espaciadas por 10 y 6 mT, respectivamente.
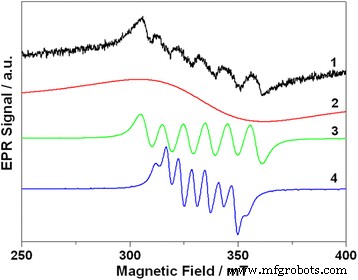
Espectro EPR de Cd 0.97 Mn 0.03 QDs te-aleados y su deconvolución:1 — espectro experimental; 2 — Curva gaussiana con ancho de línea pico a pico 50 mT. 3 — sexteto con división de ~ 10 mT. 4 — sexteto con división de ~ 6 mT. Ver detalles en el texto
Señal EPR de forma gaussiana centrada en g =2.0069 (señal 2 ) se puede atribuir a Mn 2+ iones interconectados por interacción dipolo-dipolo. Estos iones se encuentran en regiones con una alta concentración local de manganeso e interactúan entre sí. Debido a que las líneas se ensanchan, una fuerte interacción dipolo-dipolo entre los iones de manganeso enmascara las características espectrales específicas que son características de los iones de manganeso aislados y conduce a una señal EPR de una sola línea. Las otras dos señales EPR (marcadas como 3 y 4 ) debe asignarse a Mn 2+ aislado iones. Para determinar los parámetros de Mn aislado 2+ iones y su ubicación se utilizó el spin-hamiltoniano que contiene la interacción Zeeman nuclear y electrónica, la interacción hiperfina y la interacción del espín del electrón con el campo cristalino (término de división de campo cero):
$$ \ widehat {H} =g \ beta \ mathbf {BS} - {g} _ {\ mathrm {N}} {\ beta} _ {\ mathrm {N}} \ mathbf {BI} + A \ mathbf { SI} + \ suma \ límites_ {n, m} {b} _m ^ m {O} _m ^ m $$donde β y β N denotan los magnetons de Bohr y nucleares, respectivamente; B es el campo magnético externo; g y g N son los tensores g de electrones y nucleares, respectivamente; A es el tensor de la interacción hiperfina; S y yo son los operadores de espín mecánico cuántico nuclear y de electrones, respectivamente; y b n m y O n m son las constantes del campo cristalino y los operadores de la mecánica cuántica, respectivamente. Los valores de g , g N , β , β N y А se supone que son isotrópicos (que es característico de Mn 2+ iones en compuestos II-VI). El conjunto de b n m los parámetros están determinados por los alrededores de Mn 2+ y depende de la simetría de las posiciones de los iones.
La señal 2 se puede describir con los parámetros g =2.0069 y A =- 94,5 × 10 −4 cm −4 que se puede asignar al Mn 2+ aislado iones ubicados en la posición cercana a la superficie de los QD. Al mismo tiempo, señal 3 se encontró que se caracterizaba por los parámetros g =2.0069, A =- 57,5 × 10 −4 cm −4 y b 4 0 =27,7 × 10 −4 cm −4 . Este conjunto de parámetros es típico de Mn 2+ en posición catiónica (Mn Cd ) de cristales de CdTe a granel.
Conclusiones
La síntesis de Cd 1-x emisor de azul Mn x Se desarrollaron QDs te-aleados de pequeño tamaño. Se ha proporcionado el estudio sistemático de sus propiedades ópticas y electroquímicas. El cambio azul del PL alcanza un pico de 542 a 496 nm durante el aumento de Mn 2+ contenido en Cd 1-x Mn x Se observaron QD con aleación de te. Los análisis XRD y EPR confirman el reemplazo exitoso de cadmio por iones de manganeso en el proceso de síntesis. Cd coloidal 1-x Mn x Los QD con aleación de te muestran un aumento de la energía de la banda prohibida con el aumento de Mn 2+ contenido a temperatura ambiente como resultado de la transferencia de energía de retorno asistida térmicamente.
Abreviaturas
- CV:
-
Voltamperometría cíclica
- EPR:
-
Resonancia paramagnética de electrones
- PL:
-
Fotoluminiscencia
- QD:
-
Puntos cuánticos
- TEM:
-
Microscopía electrónica de transmisión
- TGA:
-
Ácido tioglicólico
- XRD:
-
Difracción de rayos X
Nanomateriales
- Síntesis fácil y propiedades ópticas de nanocristales y nanovarillas de selenio pequeños
- Compuesto híbrido Nanoestructurado de sílice / oro-celulosa-Amino-POSS mediante el proceso Sol-Gel y sus propiedades
- Síntesis de puntos cuánticos de tipo II / tipo I de ZnSe / CdS / ZnS con supresión de reabsorción y su aplicación para el ensayo inmunoabsorbente
- Síntesis de puntos cuánticos de carbono codopados N, S ricos en piridínicos como imitadores enzimáticos eficaces
- El efecto del plasma de no equilibrio por contacto sobre las propiedades estructurales y magnéticas de Mn Х Fe3 - X О4 Espinelas
- Propiedades de síntesis y luminiscencia de nanopartículas de α-NaGdF4 / β-NaYF4:Yb, Er Core-Shell solubles en agua
- Síntesis ecológica de puntos cuánticos de núcleo / carcasa de InP / ZnS para su aplicación en diodos emisores de luz sin metales pesados
- Síntesis de puntos cuánticos de sulfuro de antimonio solubles en agua y sus propiedades fotoeléctricas
- Síntesis sonoquímica de un solo paso y propiedades fotocatalíticas fáciles de compuestos de puntos cuánticos de grafeno / Ag3PO4
- Material y propiedades ópticas de los puntos cuánticos de carbono fluorescente fabricados a partir de jugo de limón mediante una reacción hidrotermal
- Nanocristales de núcleo / capa de ZnInS / ZnS dopados con Cu sin Cd:Síntesis controlada y propiedades fotofísicas



