Puntos de carbono luminiscentes azules independientes de excitación de alta eficiencia
Resumen
Los puntos de carbono luminiscentes azules (CD) se sintetizaron mediante el método hidrotermal. Se observaron cambios al azul de la longitud de onda de emisión máxima de 480 a 443 nm cuando disminuyó la concentración de la solución de CD. Los espectros de fotoluminiscencia (PL) de CD a baja concentración mostraron un comportamiento independiente de la excitación, que es muy diferente de los informes anteriores. Pueden funcionar dos mecanismos de emisión diferentes:la luminiscencia intrínseca de sp 2 -Las redes de carbono pueden ser responsables de la parte de emisión de longitud de onda más corta (independiente de la excitación) a baja concentración y la alta polaridad de los grupos nanométricos condujo al comportamiento dependiente de la excitación de la parte de longitud de onda más larga a una alta concentración de solución de CD. La propiedad fotofísica y el comportamiento dependiente de la concentración de los CD ofrecieron nuevos conocimientos sobre los CD desde los puntos de vista tanto de experimentos como de mecanismos, que promoverán diversas aplicaciones potenciales de los CD en un futuro próximo.
Antecedentes
Los puntos de carbono, como material fluorescente de la familia de los nanomateriales de carbono, han suscitado preocupaciones cada vez mayores en los últimos años. Normalmente, un CD tiene un núcleo de grafito o estructura de carbono amorfo, y la superficie del cual está recubierta con grupos que contienen oxígeno, polímeros y otras especies [1]. Mientras tanto, los CD, que no miden más de 10 nm, tienen características fotofísicas únicas, como alta fotoestabilidad, buena biocompatibilidad, excelentes propiedades ópticas y bajos riesgos ambientales [2, 3]. Inspirados por estas propiedades, los CD poseen varias aplicaciones potenciales, como administración de fármacos [4], tinta fluorescente [5], sensores [6, 7], optoelectrónica [8], fotocatálisis [9, 10] y dispositivos emisores de luz. [5, 11, 12, 13]. Hasta ahora, se han desarrollado varios métodos sintéticos para la preparación de CD, como la oxidación electroquímica del grafito [9], el método hidrotermal [5, 10] y la síntesis asistida por microondas [14, 15].
Una propiedad especial de los CD es la dependencia del pico de emisión con la longitud de onda de excitación. Bajo diferentes longitudes de onda de excitación, los CD tienen diferentes picos de fotoluminiscencia (PL) de violeta a rojo [10]. Se han informado muchas razones posibles para explicar este fenómeno, como el tamaño [9, 11], el dopaje de elementos [10, 14], la polaridad del disolvente [16], los defectos, los estados de la superficie [17], los grupos de superficie [18, 19] o pasivación superficial [20]. Sin embargo, rara vez se observa la propiedad independiente de la excitación de los CD.
Curiosamente, hemos descubierto que al diluir la solución de CD con agua desionizada, se observó el desplazamiento al azul del pico de emisión máximo de 480 a 440 nm. Además, la intensidad de emisión de CD se hizo más fuerte con la concentración decreciente. Los espectros PL mostraron un pico de emisión invariable a 443 nm a medida que variaba la longitud de onda de excitación, que es muy diferente de los informes anteriores. La alta polaridad del clúster de tamaño nanométrico y el sp 2 -Las redes de carbono pueden ser responsables de estos fenómenos.
Métodos
Reactivos y químicos
Se requirió ácido crítico monohidrato (99,5%) de SCR (Shanghai, China) y se obtuvo etilendiamina a partir del reactivo Tianzheng (Tianjin China). El agua desionizada se obtuvo de un sistema de purificación de agua purificador de agua con una resistividad de 18,25 m Ω cm (Sichuan, China). Todos los productos químicos se utilizaron tal como se recibieron sin más purificación o tratamiento.
Preparación de puntos de carbono
Los CD se prepararon de la siguiente manera:el ácido cítrico (1.0507 g) y la etilendiamina (335 μL) se agregaron a agua desionizada (10 mL). Luego, la solución bien agitada se transfirió a un autoclave revestido de teflón. La solución se calentó a 150 ° C durante 5 h. Después de la reacción, los reactores se enfriaron a temperatura ambiente de forma natural. El color de la solución de CD preparada era amarillento. Antes de la caracterización, la solución de CD se trató mediante los siguientes métodos:se tomó 1 ml de solución de CD original y luego se diluyó con 5–400 ml de agua desionizada. El color de la solución de CD cambió de amarillo a incoloro después de la dilución.
Caracterización
La fotoluminiscencia se realizó con un espectrofotómetro de fluorescencia Hitachi F4500 y un microscopio Raman confocal con un láser He-Cd de 325 nm. Los espectros de absorción se recogieron mediante un espectrómetro Shi-madzu UV-3101PC. El infrarrojo transformado de Fourier (FTIR) se registró con un espectrómetro Brucker VERTEX; Las imágenes de microscopía electrónica de transmisión (TEM) se registraron en un FEI Tecnai G2 20S-twin. El estudio de dispersión dinámica de luz (DLS) se realizó con un Malvern Zetasizer Nano ZS. Los patrones de difracción de rayos X (XRD) se recogieron con un sistema Bruker D8. El perfil de disminución de la fluorescencia se investigó usando un espectrómetro de fluorescencia Edinburgh FLS920. Los espectros Raman se realizaron en LabRAM HR Evolution (Horiba) con una excitación láser a 532 nm. El análisis de espectroscopía de fotoelectrones de rayos X (XPS) se midió con PHI 5000 Versa Probe (ULVAC-PHI, Japón). Las mediciones de microscopía de fuerza atómica (AFM) se llevaron a cabo con un microscopio de sonda de barrido MultiMode (MM-SPM).
Resultados y discusión
La formación de CD se confirma mediante microscopía electrónica de transmisión, difracción de rayos X (XRD) y mediciones de espectroscopía Raman. Como se muestra en la Fig. 1a, se obtienen nanopartículas de carbono esféricas con un diámetro medio de aproximadamente 3,6 nm. El recuadro muestra la distribución de tamaños de partículas entre 2,5 y 5 nm. La Figura 1b muestra que los CD tienen núcleos internos cristalizados con un espaciado reticular de 0,295 nm, que corresponde al plano (002) del carbono grafítico [4, 9, 14]. Las estructuras reticulares discernibles de los CD en las imágenes TEM indican que las nanopartículas resultantes tienen los núcleos internos de grafito. El patrón de difracción XRD de los CD muestra un pico ancho a 20,24 ° (archivo adicional 1:Figura S1), cerca del espaciado entre capas (002) de una estructura grafítica [5, 21]. La banda G a 1598 cm −1 y banda D a 1350 cm −1 de los CD no eran obvios en los espectros Raman (Archivo adicional 1:Figura S2). La caracterización Raman podría verse alterada por la fuerte fluorescencia de los CD. Además, la ausencia de los dos picos demuestra además que los CD están compuestos de un núcleo similar al grafito nanocristalino y sp 3 desordenado -carbono [21].
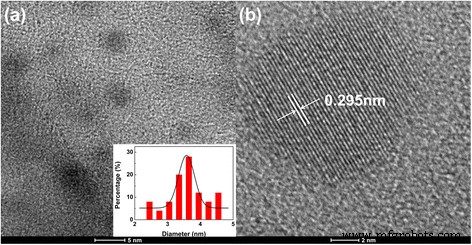
Imágenes TEM y HRTEM de los CD preparados. un La imagen de microscopía electrónica de transmisión (TEM) de los CD preparados ( recuadros que muestra la distribución del tamaño de partícula). b La imagen TEM de alta resolución de un CD representativo, que muestra su núcleo interno de grafito cristalizado
Como se muestra en la Fig. 2a, el color de la solución acuosa de CD preparada es amarillento (izquierda), que exhibe la luminiscencia azul brillante bajo la excitación de luz UV de 365 nm (derecha). En el espectro de absorción de la solución de CD, el pico de absorción a 243 nm se atribuye a \ (\ pi \) → \ (\ pi \) * de C =C, y el pico de absorción a 345 nm corresponde a n → \ (\ pi \) * transición del enlace C =O (Fig. 2a) [14]. El espectro de espectroscopía infrarroja por transformada de Fourier (FTIR) (Fig. 2b) de las CD sugiere la presencia de abundantes grupos que contienen oxígeno en sus superficies. Como se muestra en la Fig. 2b, los picos a 1120 cm −1 puede atribuirse a las vibraciones de estiramiento asimétricas y simétricas de C – O – C. El pico a 1445 y 1464 cm −1 se asignan a la vibración de flexión C – H; los picos a 1488 cm −1 indicar la existencia de vibración de flexión N – H; el pico a 1689 cm −1 se atribuye a la vibración de estiramiento C =O; los picos a 2935 cm −1 surgen de las vibraciones de estiramiento C-H de metilo / metileno; y la banda ancha centrada en 3100–3500 cm −1 se asignan a las vibraciones de estiramiento O – H y N – H [5, 10, 14]. Los resultados del análisis FTIR confirmaron la presencia de grupos que contienen oxígeno en la superficie de los CD preparados, como C =O y -OH. Las encuestas XPS respaldaron aún más los análisis FTIR. Como se muestra en el archivo adicional 1:Figura S3, los CD se componen principalmente de elementos de carbono, oxígeno y nitrógeno. El espectro XPS de alta resolución de C 1s muestra tres picos en 284.56, 285.66 y 287.7 eV, que indican la presencia de C =C / C – C, C – O y C =O. El espectro de alta resolución de N1 sugirió la presencia de N de tipo pirrólico (399,7 eV) y N de tipo grafítico / amino (400,7 eV). Los dos picos del espectro de alta resolución de O 1 a 531,55 y 532,31 eV se atribuyen a enlaces C =O y C – OH / C – O – C [21,22,23,24]. Los resultados del análisis XPS concuerdan bien con el espectro FTIR. Combinando todos estos datos de caracterización, se consideró que los CD estaban compuestos por un núcleo similar al grafito a nanoescala y grupos que contienen oxígeno que se encuentran en la superficie del núcleo.
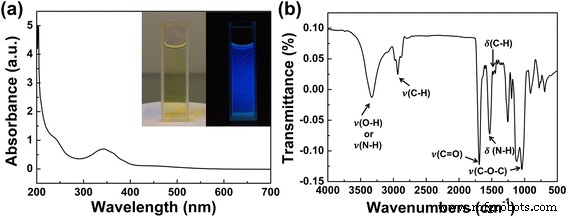
Espectro de absorción UV-vis y espectro FTIR de los CD preparados. un El espectro de absorción UV-vis de los CD. El recuadro Las fotografías muestran los CD preparados bajo luz natural ( izquierda ) y bajo irradiación de 365 nm ( derecha ). b El espectro FTIR de los CD
Los espectros de emisión de CD diluidos en 5 ml de agua desionizada muestran una característica típica dependiente de la excitación. El pico PL cambia a una longitud de onda más larga a medida que la longitud de onda de excitación aumenta gradualmente (figura 3a; las longitudes de onda de excitación aumentan progresivamente de 330 a 480 nm y la intensidad de emisión de 330 a 390 nm se multiplica por 25), lo que concuerda bien con otros informes. [1, 5, 14]. Los CD tienen una intensidad de emisión máxima a 481 nm con una excitación de 420 nm. Usando bisulfato de quinina (QY 0.56 en 0.1 M H 2 SO 4 ) como referencia, el rendimiento cuántico de los CD es del 74,8%. Se supone que el alto rendimiento cuántico es el estado de la molécula de los CD [5]. Además, tanto la longitud de onda de emisión como la intensidad PL de los CD obtenidos son sensibles al volumen de agua añadida; en otras palabras, son sensibles a la concentración de la solución de CD (fig. 3b-d). Este resultado es diferente de los CD sintetizados por otros métodos, que solo mostraron un ligero desplazamiento del pico de emisión con la variación del valor de pH [25]. Al agregar más agua desionizada (10, 25, 50, 100, 200, 300 y 400 ml) en 1 ml de solución de CD preparada, se observan los cambios en el azul de los picos de emisión de 480 a 440 nm (archivo adicional 1 :Figura S4), mientras que el correspondiente espectro de absorción de la solución de CD no ha cambiado (Archivo adicional 1:Figura S5). La intensidad de los picos de emisión en el rango de 330 a 400 nm se mejoran gradualmente, mientras que los picos de emisión en el rango de 420 a 480 nm desaparecen gradualmente (archivo adicional 1:Figura S4). Este desplazamiento al azul podría verse claramente en los espectros PL normalizados en la Fig. 3b, cuando los CD con diferentes concentraciones son excitados por la misma longitud de onda de 330 nm. En la Fig. 3b, c, el cambio de longitud de onda de emisión se produce principalmente cuando el volumen de agua desionizada añadida es inferior a 25 ml, que varía de 505 a 450 nm. Con una mayor dilución, la longitud de onda de emisión cambia bastante pequeña. En la Fig. 3c, la intensidad PL del pico de emisión aumenta continuamente con la concentración decreciente de CD. Esta mejora de la intensidad puede beneficiarse de la reducción de la extinción por colisión y la extinción por autoabsorción en soluciones de alta concentración [5, 26].
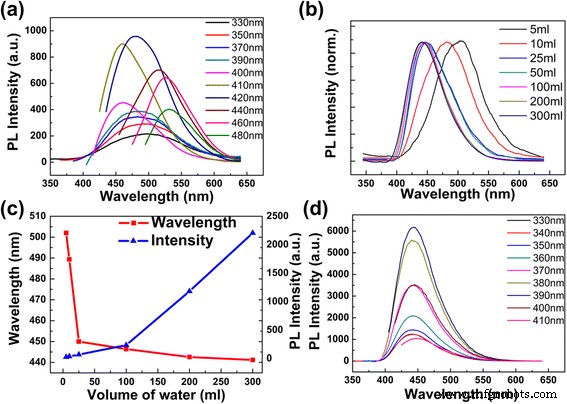
Espectros PL de CD en diferentes volúmenes de agua desionizada. un Espectros PL de 1 ml de CD preparados con 5 ml de agua desionizada (pH 10,41). b Espectros de emisión de fluorescencia normalizados de CD en diferentes volúmenes de agua con la longitud de onda de excitación de 330 nm. c La intensidad máxima de PL y el pico de emisión en función de diferentes volúmenes de agua añadida. d Espectros de emisión de diluir 1 ml de solución de CD preparada con 300 ml de agua desionizada
Después de diluirse con 300 ml de agua desionizada, los espectros PL muestran un pico de emisión única a 443 nm, que es invariable a medida que varía la longitud de onda de excitación (Fig. 3d; las longitudes de onda de excitación aumentan progresivamente de 330 a 410 nm). La intensidad de emisión más alta se obtiene bajo la longitud de onda de excitación de 390 nm. Incluso cuando se diluye con más volumen de agua (archivo adicional 1:Figura S4), los espectros de emisión no se desplazan.
Cuando se agregan diferentes volúmenes de agua desionizada en las soluciones de CD preparadas, se cambia el valor de pH de la solución. Los fenómenos que observamos pueden deberse a los diferentes valores de pH. Para verificar si el valor del pH es la causa principal del fenómeno, se analizó en detalle la solución de CD de diferentes valores de pH. El valor de pH de la solución de CD diluida con 5 ml de agua desionizada es 10,41. Al diluir la solución de CD preparada con 300 ml de agua desionizada, el valor de pH cambia a 10,2. Luego, ajustamos el valor de pH de la solución de CD diluida de 300 ml de 10.2 a 10.41 agregando NaOH. La Figura 4a muestra los espectros PL de la solución de CD después de ajustar el valor de pH a 10,41 (las longitudes de onda de excitación aumentan progresivamente de 330 a 410 nm). A partir de las dos figuras (Figs. 3d y 4a), obviamente podríamos notar que incluso cuando el valor de pH se ajusta de 10.2 a 10.41, la posición e intensidad del pico PL son casi invariables. Luego, ajustamos los valores de pH de la solución de CD que contiene 5 ml de agua desionizada y la solución que contiene 300 ml de agua desionizada al mismo valor de 12.08 agregando NaOH (en la Fig.4b, las longitudes de onda de excitación aumentan progresivamente de 330 a 480 nm , la intensidad de emisión de 330 a 380 nm se multiplica por 15 y la intensidad de emisión de 390 nm se multiplica por 6; en la figura 4c, las longitudes de onda de excitación aumentan progresivamente de 330 a 410 nm); en comparación con las Fig. 3a, d, las posiciones e intensidades de las emisiones de PL tampoco cambian. Los resultados anteriores muestran que el pH no es la razón del pico de emisión invariable en nuestro experimento. Así, se puede concluir que la concentración es el punto clave para ajustar la longitud de onda de emisión y fijar el pico de emisión. Hasta donde sabemos, este es el primer informe que muestra que la longitud de onda de emisión y la intensidad PL de los CD se pueden sintonizar fácilmente ajustando la concentración de la solución de CD con agua desionizada.
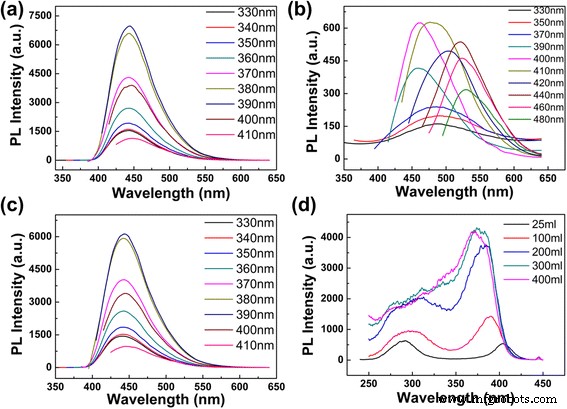
Espectros de emisión y excitación de CD en diferentes volúmenes de agua y pH. un Espectros de emisión de CD con 300 ml de agua desionizada (pH 10,41). b Espectros de emisión de CD con 5 ml de agua desionizada (pH 12,08). c Espectros de emisión de CD con 300 ml de agua desionizada (pH 12,08). d Espectros de excitación de CD a 445 nm en diferentes volúmenes de agua
Para proporcionar información sobre las características independientes de la excitación de los CD, medimos los espectros de excitación de diferentes longitudes de onda de emisión y lo mostramos en el archivo adicional 1:Figura S6. Para la solución de CD con alta concentración (1 ml de solución preparada diluida con 25 ml de agua desionizada), hay dos picos de excitación fuertes ubicados a 290 y 400 nm, por separado. Con la concentración disminuyendo de mayor a menor, el pico de excitación a 290 nm se debilita y el pico a 400 nm aumenta y el azul se desplaza a 370 nm (Fig. 4d). Las características de los espectros de excitación a diferentes concentraciones revelan que la luminiscencia de los CD puede tener múltiples centros. Para hacer una prueba más, la vida útil de la fluorescencia de los CD (1 ml de solución preparada diluida con 25 ml de agua desionizada) se midió con la longitud de onda de excitación en 280 nm y longitudes de onda de emisión en 447 nm (archivo adicional 1:Figura S7). La vida útil promedio es de 11,85 ns, y la curva de caída puede ajustarse mediante una función doble exponencial con vidas útiles de 5,11 ns (35,08%) y 13,28 ns (64,92%). La vida útil múltiple de la muestra podría deberse a los diversos fluoróforos o niveles de energía presentes en las superficies de las muestras [18].
Algunos estudios de CD mostraron la existencia de partículas pequeñas, así como agregados de partículas, incluso si se utilizó una solución diluida [27]. Iijima [28] también observa un tipo similar de agregación, donde se encuentran pequeñas partículas de carbono que se agregan en estructuras de nanocuernas de 80 nm de tamaño. Las pequeñas partículas son atraídas entre sí por las fuerzas de Van der Waals. Hemos estimado los tamaños de partícula de CD con diferentes volúmenes de agua desionizada mediante la medición de dispersión dinámica de luz (DLS) (archivo adicional 1:Figura S8), y el resultado muestra que los diámetros hidrodinámicos de los CD son diferentes, que van de 34 a 15 nm. En la solución de CD preparada (alta concentración), el diámetro medio es de 34 nm. Después de diluir con 100 ml de agua desionizada, los CD presentan un diámetro medio de 15 nm. Los tamaños medios de los CD en solución acuosa han mostrado una tendencia decreciente con la concentración decreciente (Archivo adicional 1:Figura S8). En consecuencia, se puede concluir que cuando están en alta concentración, una serie de CD individuales se han agregado para formar los grupos de tamaño nanométrico, lo que conduce al aumento del diámetro promedio. Los CD individuales y los clústeres nanométricos coexisten en la solución. Mientras que a baja concentración, los grupos de tamaño nanométrico se han separado en CD individuales. Los tamaños medios de los CD evaluados mediante la medición de DLS son mayores que los de los resultados de TEM (4-6 nm), lo que se debe principalmente a que el DLS considera el diámetro hidrodinámico global que incluye partículas, así como moléculas e iones absorbidos [27]. Se midió la microscopía de fuerza atómica (AFM) de CD con diferente volumen de agua. Como se muestra en el archivo adicional 1:Figura S9, cuando la concentración es alta, la imagen revela que los CD individuales se han agregado para formar los grupos nanométricos, y el diámetro promedio es de 40 nm; a medida que la concentración disminuye de mayor a menor, los grupos de tamaño nanométrico se separan gradualmente en CD individuales y el diámetro medido es de aproximadamente 10 nm, que es menor que 40 nm, lo que coincide con el resultado de DLS.
La formación de CD a partir de materiales orgánicos en medios acuosos tiene el punto de vista común de que los CD están compuestos de núcleos nanocristalinos de sp 2 -Islas de tipo grafeno bidimensionales híbridas [10, 29] interrumpidas por sp 3 -inclusiones de tipo diamante hibridado [27, 29]. Durante la formación de nanopartículas, los grupos polares derivados de los materiales de partida se adhieren a la superficie de los CD, lo que permite que las partículas sean solubles en agua. Este punto de vista fue confirmado por los espectros Raman de los CD obtenidos de diferentes materiales de partida [27, 30], que demostraron la presencia de sp 2 - y sp 3 -Estructuras híbridas en proporciones similares. Mientras tanto, todos los CD solubles en agua estudiados obtenidos mediante el tratamiento térmico de materiales orgánicos contienen elementos oxigenados en forma de hidroxilos, carboxilos y carbonilos [16]. Los grupos polares en la superficie de la partícula son de particular importancia para la emisión de CD [16, 18, 31].
Del experimento anterior, podemos concluir que hay dos especies emisoras diferentes en la solución de CD. La luminiscencia intrínseca de sp 2 -Las redes de carbono y la alta polaridad de los cúmulos nanométricos podrían contribuir a los diferentes fenómenos de emisión (Fig. 5). El CD único se comporta como un dipolo eléctrico [32] debido a sus grupos de superficie polar, como –CO y –OH [15, 18, 31] (Fig. 2b). Los grupos que contienen oxígeno en la superficie de los CD pueden ser responsables de la parte de longitud de onda más larga de la emisión de fluorescencia [19]. Cuando están en alta concentración, varias CD se agregan por las fuerzas de Van der Waals [28] para formar nanoclusters, luego un gran número de –CO y –OH se unen, lo que conduce a una mayor polaridad en las superficies de los nanoclusters [15 ]. La alta polaridad de los grupos de tamaño nanométrico provoca las propiedades dependientes de la excitación [15, 19, 31]. Mientras tanto, el alto grado de oxidación y la mayor polaridad de los grupos de tamaño nanométrico conducen a una relajación rápida de los electrones desde los estados excitados a los subestados, lo que corresponde a una longitud de onda más larga. Luego, los subestados contribuyen a la emisión de fotos, lo que eventualmente da lugar a una emisión de longitud de onda más larga [15]. Por lo tanto, el fenómeno de la excitación dependiente se produjo en una parte de longitud de onda más larga cuando estaba en alta concentración. Después de agregar agua desionizada a la solución de CD preparada, la concentración de la solución disminuyó gradualmente. Luego, los CD que formaron nanoclusters se separan y se vuelven a dispersar en CD individuales, lo que conduce al debilitamiento de la polaridad y la desaparición de los espectros de emisión a longitudes de onda más largas. Además, la separación de los grupos también conduce a la desaparición del pico de excitación a 290 nm (Fig. 4d). En comparación con la emisión de los grupos polares (–CO y –OH) en la superficie de un solo CD, la luminiscencia intrínseca de sp 2 -Las redes de carbono juegan un papel preponderante con la disminución de la concentración de CD. Cuando está a baja concentración, el espectro fluorescente de un solo CD con solo luminiscencia intrínseca es asimétrico y se amplía a la región de mayor energía (longitud de onda corta), que muestra la fluorescencia independiente de la excitación como se muestra en la Fig. 4a [15, 33].
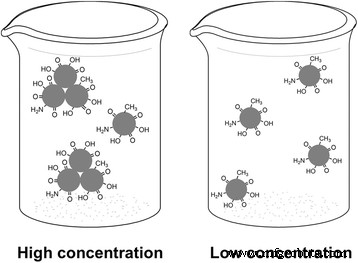
El esquema de CD a alta y baja concentración. Izquierda :cuando están en alta concentración, varios CD individuales formaron grupos de tamaño nanométrico; derecha :cuando están en baja concentración, los grupos de tamaño nanométrico se separan en CD individuales
Conclusiones
En resumen, hemos sintetizado los CD por método hidrotermal. Significativamente, los CD como se prepararon presentaron una excelente dispersabilidad acuosa y propiedades PL únicas, como la sensibilidad a la concentración y la longitud de onda de emisión independiente de la excitación. Se observaron cambios al azul de la longitud de onda de emisión máxima de 480 a 443 nm cuando la concentración de CD disminuyó de mayor a menor. Los espectros PL a baja concentración de CD mostraron un comportamiento independiente de la excitación con el pico de emisión a 440 nm, que es muy diferente de los informes anteriores. Se podría concluir que existen dos mecanismos emisores diferentes. La luminiscencia intrínseca de sp 2 -Las redes de carbono fueron responsables de la emisión en longitudes de onda cortas (independientes de la excitación) a baja concentración, y la alta polaridad de los grupos nanométricos condujo a la propiedad dependiente de la excitación de la parte de longitud de onda más larga cuando estaba en alta concentración. Las propiedades fotofísicas favorables y el comportamiento dependiente de la concentración de los CD proporcionarán una manera de sintonizar la longitud de onda de emisión y ofrecerán nuevos conocimientos sobre los CD desde los puntos de vista tanto de experimentos como de mecanismos, lo que promoverá diversas aplicaciones potenciales de los CD en un futuro próximo.
Abreviaturas
- AFM:
-
Microscopía de fuerza atómica
- CD:
-
Puntos de carbono
- DLS:
-
Dispersión de luz dinámica
- FTIR:
-
Infrarrojo transformado de Fourier
- PL:
-
Fotoluminiscencia
- TEM:
-
Microscopía electrónica de transmisión
- XPS:
-
Espectroscopia de fotoelectrones de rayos X
- XRD:
-
Difracción de rayos X
Nanomateriales
- Ámbar
- Carbono M2
- Creación y generación de imágenes de ciclocarbono
- Síntesis de puntos cuánticos de tipo II / tipo I de ZnSe / CdS / ZnS con supresión de reabsorción y su aplicación para el ensayo inmunoabsorbente
- Síntesis de puntos cuánticos de carbono codopados N, S ricos en piridínicos como imitadores enzimáticos eficaces
- Formación y propiedades luminiscentes de Al2O3:nanocompuestos de SiOC en la base de nanopartículas de alúmina modificadas por feniltrimetoxisilano
- Microesferas de carbono magnéticas como adsorbente reutilizable para la eliminación de sulfonamidas del agua
- Un enfoque simple para sintetizar puntos cuánticos de carbono fluorescente de aguas residuales de tofu
- Dependencia del espesor de la cáscara de la transferencia de energía entre partículas en el dopaje de puntos cuánticos de ZnSe / ZnSe Core-Shell con europio
- Material y propiedades ópticas de los puntos cuánticos de carbono fluorescente fabricados a partir de jugo de limón mediante una reacción hidrotermal
- ATL Composites contribuye al proyecto de remediación de pilares de hormigón



