Reducción de la conductividad de protones mejorada y la permeabilidad del metanol mediante biomembrana de óxido de grafeno sulfonado con electrolito de alginato de sodio
Resumen
El alto cruce de metanol y el alto costo de la membrana Nafion® son los principales desafíos para la aplicación directa de celdas de combustible de metanol. Con el objetivo de solucionar estos problemas, una membrana electrolítica de polímero no Nafion con baja permeabilidad al metanol y alta conductividad protónica basada en el polímero de alginato de sodio (SA) como matriz y óxido de grafeno sulfonado (SGO) como relleno inorgánico (0.02-0.2 % en peso) se preparó mediante una técnica de moldeo en solución simple. La fuerte atracción electrostática entre -SO 3 El H de SGO y el polímero de alginato de sodio aumentaron la estabilidad mecánica, optimizaron la absorción de agua y así inhibieron el cruce de metanol en la membrana. Las propiedades y rendimientos óptimos fueron presentados por la membrana SA / SGO con una carga de 0.2% en peso de SGO, que dio una conductividad de protones de 13.2 × 10 −3 Scm −1 y la permeabilidad del metanol fue de 1,535 × 10 −7 cm 2 s −1 a 25 ° C, muy por debajo de Nafion (25,1 × 10 −7 cm 2 s −1 ) a 25 ° C. Las propiedades mecánicas del polímero de alginato de sodio en términos de resistencia a la tracción y alargamiento a la rotura se mejoraron mediante la adición de SGO.
Antecedentes
La simple conversión de energía química de un combustible a través de una reacción química en electricidad solo puede realizarse mediante un dispositivo de pila de combustible. Con respecto a esta capacidad, la pila de combustible de metanol directo (DMFC) ha recibido gran atención porque puede funcionar utilizando solo un 17% de metanol como combustible para producir electricidad con emisiones contaminantes reducidas en comparación con otros métodos y también es seguro de usar durante el vuelo [1]. . DMFC tiene amplias capacidades en muchas aplicaciones, como herramientas médicas, audífonos y herramientas portátiles. Desafortunadamente, su aplicación se ha visto obstaculizada por su falta de comercialización, lo que se atribuye a cuestiones como el alto costo de producción (aproximadamente 1000 USD m −2 ) [2], alta permeabilidad al metanol de las membranas comercializadas (Nafion) y baja reactividad y baja durabilidad de los electrocatalizadores actuales (paladio y rutenio) [3]. La membrana de electrolito de protones es el componente más vital en DMFC porque funciona como un separador de combustible y oxidante, así como un camino para conducir protones; en consecuencia, puede tener un efecto sustancial en la eficiencia general del sistema. Entre las características requeridas de la membrana, la membrana debe tener una alta conductividad de protones y la capacidad de bloquear eficazmente el metanol para que no cruce la membrana para evitar el envenenamiento del lado del cátodo [4]. Además, es importante garantizar el uso de materias primas económicas y no peligrosas para la membrana. La membrana comercial actual (Nafion) no cumple estos importantes requisitos; por lo tanto, no es una buena membrana para aplicaciones de DMFC debido a su alta permeabilidad al metanol, alto costo y uso de materiales peligrosos. Además, su conductividad de protones se ve afectada por estos problemas, lo que limita su eficacia en las aplicaciones de DMFC. Actualmente, los biomateriales están recibiendo atención por ser seguros y amigables con el medio ambiente, clasificándolos como materiales de tecnología verde. Como biomaterial nuevo y excelente, los alginatos han intrigado a muchos investigadores de diversas áreas para aplicaciones que incluyen ingeniería de tejidos, biomedicina, vehículos de administración de medicamentos, envasado de alimentos y DMFC [5]. El alginato es un polisacárido soluble en agua prominente que se encuentra en las algas pardas y consta de unidades de ácido β-d-manurónico (M) y ácido α-l-gulurónico (G) enlazadas (1-4). Tiene una absorción de agua muy alta y puede absorber de 200 a 300 veces su propio peso en agua [6]. La capacidad de conducción de protones del alginato prístino es baja debido a la ausencia de vías de transferencia continua y la débil capacidad de conducción del polímero [6,7,8,9]. Estudios anteriores demostraron que el método más eficaz para mejorar las propiedades mecánicas y especializar las otras propiedades de este material polimérico es introducir un material inorgánico y una estructura polimérica [7]. Los materiales compuestos pueden ampliar o proporcionar capacidades novedosas que son difíciles de obtener utilizando cada componente individualmente. Por ejemplo, la resistencia mecánica del alginato se ha mejorado con éxito mediante la introducción de nanotubos de carbono y óxido de grafeno en la matriz del polímero de alginato [3, 10, 11]. Estudios previos sobre el desarrollo de membranas basadas en biopolímeros han mostrado un buen potencial cuando se combinan con otros materiales como polímeros inorgánicos o sintéticos, por ejemplo, quitosano de doble capa (1,67 × 10 −6 cm 2 s −1 ) [12], quitosano-PVA / Nafion (2,2 × 10 −6 cm 2 s −1 ) [13], quitosano-SHNT (0,76 × 10 −2 Scm −1 ) [14], quitosano-zeolita (2,58 × 10 -2 S cm −1 ) [15], quitosano-PMA (1,5 × 10 -2 S cm −1 ) [16], quitosano-alginato de sodio (4,2 × 10 -2 S cm −1 ) [17], alginato-carragenano (3,16 × 10 −2 S cm −1 ) [18], quitosano sulfonado-SGO (72 × 10 −2 S cm −1 ) [19], PVA-alginato de sodio (9,1 × 10 −2 S cm −1 ) [20], biocelulosa-Nafión (7,1 × 10 −2 S cm −1 ) [21], quitosano-SPSF (4,6 × 10 -2 S cm −1 ) [22], quitosano-sílice / nanotubo de carbono (CNT) (2,5 × 10 −2 S cm −1 ), quitosano-PVP (2,4 × 10 −2 S cm −1 ) [23], nanocelulosa / polipirrol (1,6 mW cm −2 ) para pila de combustible enzimática [24], nanofibras de celulosa (CNF) (0,05 × 10 −3 S cm −1 ) y nanocristales de celulosa (CNC) (4,6 × 10 −3 S cm −1 ) [25], celulosa bacteriana (BC) / poli (ácido 4-estireno sulfónico) (PSSA) (0,2 S cm −1 ) [26], y celulosa nanocristalina dopada con imidazol (2,79 × 10 −2 S cm −1 ) [27]. Sin embargo, el número de membranas basadas en biopolímeros desarrollados es demasiado pequeño en comparación con los estudios que involucran polímeros sintéticos en muchas áreas, incluidas las pilas de combustible. Además, es innegable que el quitosano ha recibido más atención que los otros polímeros de carbohidratos.
El óxido de grafeno es un material prometedor a base de carbono con un alto potencial en muchas aplicaciones, incluida la electrónica, los nanocompuestos, la biomedicina y las pilas de combustible. El óxido de grafeno tiene excelentes propiedades, como una alta relación de aspecto, alta conductividad, alta resistencia mecánica, estructura plana grafitizada única y propiedades de aislamiento eléctrico [28]. Como material aditivo en una matriz de polímero hidrófilo, proporciona una alta resiliencia para resistir el hinchamiento causado por la humedad. Además, el óxido de grafeno sería preferible al CNT debido a su costo mucho menor, lo que lo convierte en el candidato más adecuado para membranas en aplicaciones de DMFC [29]. Estudios anteriores demostraron que el GO reforzó los polímeros naturales, como las películas de quitosano y los monolitos porosos de gelatina y quitosano [19, 30]. Bayer y col. [31] preparó un documento GO, que mostró una permeabilidad al hidrógeno tres veces menor que la del Nafion y una conductividad del protón de 49,9 mScm −1 utilizando una técnica en plano. El rendimiento de la celda de combustible líquido directo (DLFC) fue excelente cuando Lue et al. [32] introdujo GO en Nafion. Sin embargo, el rendimiento de GO como conductor de protones es limitado porque carece de grupos funcionales que puedan ser portadores de protones en la membrana, lo que afecta negativamente a la conductividad de los protones y disminuye el rendimiento de la pila de combustible [19]. Karim y col. [33] informó que la conductividad de la nanohoja GO en su estudio era de 15 mS cm −1 y las conductividades de GO informadas por Hatakeyama et al. [34] y Bayer et al. [35] fueron 0,4 mScm −1 y 0,55 mScm −1 , respectivamente. Con base en estas debilidades, el GO sulfonado se considera una mejor opción que el GO para esta aplicación porque el GO sulfonado ha mostrado una mayor conductividad de protones y facilita la formación de una membrana homogénea debido a la alta compatibilidad entre el GOS y el SO 3. H [19]. Keith y col. [36] presentó un artículo de SGO que mostraba una alta densidad de potencia máxima de 113 mWcm −2 a 0,39 V para pila de combustible de membrana de electrolito de polímero (PEMFC). Las ventajas de –SO 3 La incorporación de H es la siguiente:(i) los grupos ácidos pueden ofrecer sitios de salto suplementarios para el movimiento de protones, y (ii) las atracciones electrostáticas mejorarán las estabilidades térmicas y mecánicas al interferir con la movilidad y empaquetamiento de la cadena de alginato. Según nuestra investigación, todavía no se ha producido ningún material nanocompuesto de alginato / SGO utilizando este método. El uso de biomateriales en la aplicación de dispositivos eléctricos conducirá a una investigación interdisciplinaria entre las ciencias biológicas y las tecnologías de energía sostenible. Por lo tanto, esta investigación combinará las ventajas del alginato y SGO para formar una nueva biomembrana con alta durabilidad, buena conductividad de protones y permeabilidad al metanol con el objetivo de que funcione mejor que Nafion u otras membranas comerciales de intercambio de protones (PEM) como además de ser mucho más económico de producir que Nafion.
Métodos
Materiales
El grafito natural TIMREX PG25 se compró a TIMCAL Ltd. Ácido sulfúrico concentrado (H 2 SO 4 , 95%), metanol (CH 3 OH, 99,7%), permanganato de potasio, ácido clorhídrico, solución acuosa de peróxido de hidrógeno (H 2 O 2 , 35%), cloruro de calcio, etanol, ácido sulfanílico, solución de nitrito de sodio y glicerol se obtuvieron de Sigma Aldrich. Estos productos químicos se utilizaron tal como se recibieron sin purificación adicional. En todos los experimentos se utilizó agua desionizada (DI) a través de un sistema Millipore (Milli-Q).
Preparación de la membrana
El método de Hummer se modificó y aplicó para proporcionar un GOS a partir de grafito natural [10, 37]. Primero, se mezclaron 2 g de grafito con 150 ml de H 2 SO 4 (95%) en un matraz de 500 ml. La mezcla se agitó durante 30 min en un baño de hielo. Con agitación continua y vigorosa, se añadieron a la mezcla 15 g de permanganato de potasio. La velocidad de adición se controló cuidadosamente para mantener la temperatura de reacción a 20 ° C. Después, la mezcla se agitó y se dejó durante la noche a temperatura ambiente, seguido de la adición de 180 ml de agua con agitación vigorosa y reflujo a 98ºC durante 24 h; esto hizo que la solución se tornara de color amarillo. Ochenta mililitros de 35% H 2 O 2 se añadió a la mezcla de reacción, que se dejó enfriar a temperatura ambiente para detener la reacción con KMnO 4 . El GO resultante se lavó enjuagando con HCl al 5% seguido de centrifugación. Finalmente, el producto se enjuagó con agua desionizada varias veces, se filtró y se secó al vacío.
Se añadieron cincuenta mililitros de óxido de grafeno a 8 ml de una solución de ácido sulfanílico 0,06 M a 70 ° C. Con agitación continua, se añadieron gota a gota a la mezcla 2 ml de solución de nitrito de sodio y se dejó reposar durante 12 ha una temperatura constante de 70ºC. Una vez completada la reacción, la mezcla se lavó y se recogió mediante centrifugación. El SGO recogido se lavó varias veces más con agua hasta alcanzar pH 7. Las partículas de SGO se caracterizaron por espectroscopía de fotoelectrones de rayos X (XPS). El alginato de sodio se disolvió al 1% ( w / v ) agua bidestilada para obtener una solución de alginato. El contenido de SGO añadido a la solución de alginato varió, con valores de 0,02, 0,05, 0,09, 0,13, 0,17 y 0,2% en peso para producir una película compuesta. La mezcla se agitó continuamente durante 60 min con un agitador magnético. La solución heterogénea se transfirió a un sustrato de vidrio y se dejó a 60 ° C durante 72 h para permitir el proceso de formación de película delgada. La membrana seca de alginato / óxido de grafeno sulfonado se reticuló luego usando una solución de cloruro de calcio / glicerol para aumentar la resistencia mecánica y reducir las propiedades hidrófilas del alginato. La membrana se sumergió durante 30 min en 100 ml de solución de reticulación cuya concentración de cationes se mantuvo al 1,5% w / v . Finalmente, los cationes libres se eliminaron de la superficie de la membrana lavando con agua desionizada y la membrana se secó a 25 ° C. El método de preparación se resume en el Esquema 1.
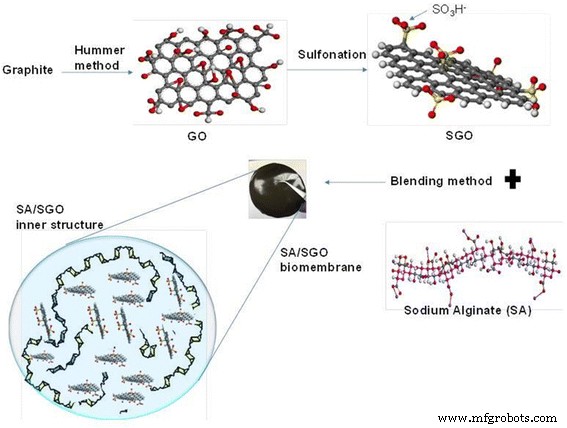
Relleno de óxido de grafeno sulfonado (SGO) y método de preparación de biomembrana SA / SGO
Caracterización de membranas
Se analizaron los espectros infrarrojos por transformada de Fourier (FTIR PERKIN ELMER) de óxido de grafeno, óxido de grafeno sulfonado y la membrana. La longitud de onda de FTIR estaba en el rango de 4000 a 500 cm −1 . La microestructura de las membranas de la película se examinó utilizando un microscopio electrónico de barrido de emisión de campo (FEI QUANTA 400 FESEM) con un voltaje de funcionamiento de 5 kV como precaución para la muestra basada en biomaterial. El análisis de microscopía electrónica de transmisión de alta resolución (HRTEM) se llevó a cabo utilizando o Digital TEM HT7700 operado a un potencial de aceleración de 300 kV.
Las muestras se prepararon en rejillas con una película de soporte de carbón de encaje. Se utilizó XPS para determinar la composición química de la superficie de la muestra utilizando un Axis Ultra DLD. La resistencia mecánica de la membrana SA / SGO se probó con una máquina de prueba universal, incluida la resistencia a la tracción, el módulo de Young y el alargamiento a la rotura. La carga utilizada fue de 3 kN a temperatura ambiente. Los cambios en el peso y la longitud (o espesor) de las membranas húmedas y secas pueden determinar la tasa de absorción de agua y la proporción de hinchamiento de la membrana. Normalmente, la membrana se sumergió en agua durante 2 días a 30 ° C. Para la membrana húmeda, se registraron el peso y la longitud, y luego, se eliminaron el agua en la membrana y las gotas de líquido en la superficie de la membrana. Además, la membrana húmeda se secó bajo presión de vacío y temperatura de 120 ° C durante al menos 24 h. También se registraron el peso y la longitud de la membrana en estado seco. Usando las Ecs. 1 y 2, se puede determinar la ingesta de agua (WU%) y el índice de hinchamiento (SW%), donde L mojado representa la masa húmeda y L seco representa la masa seca obtenida de la longitud de las membranas húmedas y secas, respectivamente.
$$ \ mathrm {WU} \% =\ frac {{\ mathrm {masa}} _ {\ mathrm {húmedo}} - {\ mathrm {masa}} _ {\ mathrm {seco}}} {{\ mathrm { masa}} _ {\ mathrm {seco}}} \ veces 100 $$ (1) $$ \ mathrm {SW} \% =\ frac {L _ {\ mathrm {húmedo}} - {L} _ {\ mathrm { seco}}} {L _ {\ mathrm {seco}}} \ veces 100 $$ (2)El cálculo de la absorción de metanol es el mismo que el cálculo de la absorción de agua, excepto que la solución para inmersión se cambia a metanol en lugar de agua desionizada.
La conductividad del protón de la membrana preparada se calculó usando una celda de conductividad de cuatro electrodos conectada a un potenciostato / galvanostato (WonATech) que opera en un rango de frecuencia de 1 MHz hasta 50 Hz. Las membranas (de 1 cm × 4 cm de tamaño) deben sumergirse en agua durante 24 h para las lecturas de conductividad en el estado completamente hidratado. Se ejecutó el potenciostato para obtener la gráfica de voltaje versus corriente. El gradiente de la línea recta es la resistencia de la membrana. El esquema 1 presenta la celda de la prueba de conductividad de protones. La conductividad del protón se puede calcular mediante la siguiente fórmula:
$$ \ sigma =\ frac {L} {RWT} $$ (3)donde L es la distancia entre los dos electrodos, W es el ancho de la membrana, T es el grosor de la membrana y R es la resistencia de la membrana, similar al método en trabajos anteriores [38, 39].
Dos celdas de permeabilidad líquida de tanque con 20 v / v Se usó% de metanol para determinar la permeabilidad al metanol de la membrana. Las diferencias en la concentración de metanol dan como resultado un cruce de metanol a través de la membrana y se puede determinar la permeabilidad del metanol. La ecuación 3 se utiliza para calcular la permeabilidad del metanol:
$$ P =\ frac {1} {Ca} \ left (\ frac {\ Delta Cb (t)} {\ Delta t} \ right) \ left (\ frac {LVb} {A} \ right) $$ ( 4)donde P es la permeabilidad a la difusión de la membrana para el metanol (cm 2 s −1 ), C a es la concentración de metanol en la cámara de alimentación, es decir, celda A (mol L −1 ), ∆Cb ( t ) / ∆t es la variación de la concentración molar de metanol en la celda B en función del tiempo (mol L −1 s), V b es el volumen de cada depósito de difusión (cm 3 ), A es el área de la membrana y L es el espesor de la membrana (cm).
Las características de la membrana se pueden determinar calculando la selectividad de la membrana, que se puede lograr mediante una alta conductividad de protones y una baja permeabilidad al metanol. La fórmula utilizada para calcular la selectividad es la siguiente:
$$ \ varphi =\ frac {\ sigma} {P} $$ (5)donde φ representa selectividad, σ representa la conductividad iónica y P representa la permeabilidad del metanol.
Resultados y discusión
Caracterización de óxido de grafeno sulfonado (SGO) y biomembrana SA / SGO
Los espectros FTIR en la Fig. 1a, b muestran la diferencia entre GO y SGO, que se puede observar claramente. La figura 1b es el aumento de la figura 1a para obtener una vista más clara de los picos en los espectros SGO. El espectro de SGO muestra una nueva banda a 1244 cm −1 , que es la absorbancia típica de un grupo de ácido sulfónico (-SO 3 H), mientras que el espectro GO no contiene esta banda [40]. Además, el espectro muestra nuevos picos en las longitudes de onda de 1012, 1036 y 1125 cm −1 , que se consideran las vibraciones de estiramiento simétricas y asimétricas de SO 3 H - grupos. Este nuevo espectro revela que la solución de óxido de grafeno se modificó con éxito en óxido de grafeno sulfonado utilizando el método simple descrito anteriormente. Al mismo tiempo, la modificación de la sulfonación aún mantenía los grupos funcionales en GO, como el grupo hidroxilo, a 3319 cm −1 y el grupo carboxilo a 1636 cm −1 . Confirmación adicional de la presencia de SO 3 H - Los grupos se pueden determinar mediante análisis XPS.
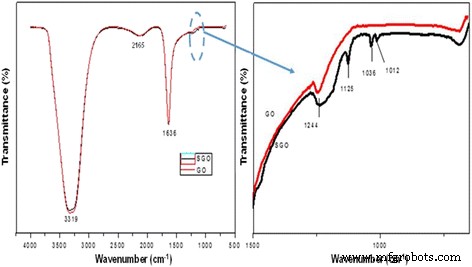
un , b Espectros FTIR para óxido de grafeno (GO) y óxido de grafeno sulfonado (SGO)
La Figura 2 muestra los espectros XPS de las membranas GO y SGO en los que los espectros de barrido están en el rango de 0 a 800 eV para reconocer la superficie de los elementos existentes mediante un análisis medible. Se puede observar que las señales C1s y O1s aparecieron en 286 y 531 eV, respectivamente, tanto en el espectro GO como en el SGO. También se observa que después de que se introdujeron los grupos de ácido sulfónico en GO, apareció un nuevo pico de S2p a 168 eV. Los grupos sulfónicos en SGO contribuyeron a una intensidad ligeramente mayor en los espectros de O1s en comparación con el de GO. El espectro de alta resolución de C1s, que se conoce como deconvolución espectral gaussiana, confirmó que el GO se personalizó con éxito mediante la modificación química [41]. La figura dentro de la Fig. 2b es el espectro S2p para GO funcionalizado con un aumento mayor. La energía de unión de los grupos sulfónicos contribuyó a la aparición del pico S2p a 168 eV, y este pico confirmó que los grupos de ácido sulfónico se unieron con éxito al esqueleto de la nanoplaca GO [41, 42].
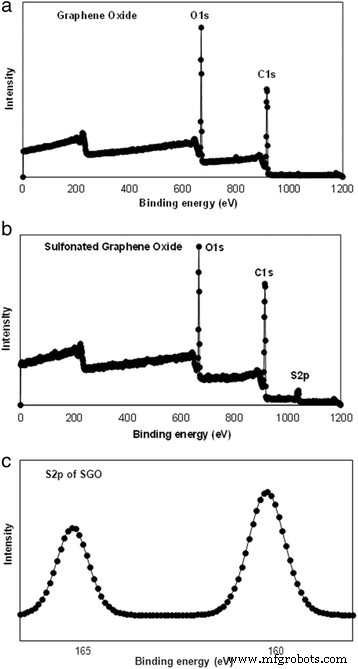
XPS de a , b amplios espectros GO y SGO y c Espectros S2p de SGO
La producción exitosa de GO a través del método de Hummer fue confirmada por la morfología de GO en forma de hoja como se muestra en la imagen de FESEM (Fig. 3a). Bai y col. [43] también generó GO con el método de Hummer. Los resultados de sus estudios mostraron que las morfologías de GO y RGO parecían estar ligeramente dobladas y formaban algunas arrugas, que se asemejan a la morfología de GO de este estudio.

un Imagen de FESEM de GO. b , c Imágenes FESEM de SGO con varios aumentos y d EDX de SGO
La imagen FESEM de SGO en la Fig. 3b, c tiene una superficie arrugada y más rugosa en comparación con la superficie de GO, lo que probablemente se deba a los efectos del proceso de sulfonación, lo que confirma que el método de modificación también se aplicó con éxito [41, 44 ]. Esto se correlaciona con la existencia de un nuevo pico en los espectros de transmitancia FTIR, que pertenece al grupo sulfónico. Además, la presencia de grupos sulfónicos también se confirmó en la hoja GO mediante el análisis XPS. SGO era diferente de GO, que tenía una estructura de varias capas sin agregación. El método de modificación aplicado conduce a la formación de una estructura en capas y apilada; así, SGO demostró su flexibilidad. El resultado de los rayos X de energía dispersiva (EDX) presenta que existe un 1,76% en peso de elemento azufre en las láminas de SGO (Fig. 3d).
La imagen de la superficie y la sección transversal de las biomembranas SA y SA / SGO se muestran en la Fig. 4. La Figura 4a-c es una imagen de la superficie, y la Fig. 4d-f es una imagen de la sección transversal de membranas con diferentes contenidos de SGO. Tanto los aumentos bajos como los altos muestran que la hoja de SGO está completamente dispersa de manera homogénea en la matriz polimérica general y está guiada por interacciones intermoleculares; Se reconoce que los enlaces de hidrógeno se producen entre los grupos de ácido sulfónico en SGO y los grupos polares (-O-, C =O) en la membrana SA / SGO [45]. SGO se coloca en la matriz del polímero para funcionar como una barrera a las moléculas de metanol. La imagen de SA / SGO6 se ve mejor con la extensión completa a toda la matriz de polímero de alginato de sodio. La Figura 5 es una imagen TEM para el compuesto formado en el que las nanohojas SGO están bien distribuidas en la matriz de polímero de alginato de sodio. El alginato de sodio existe en la estructura de partículas de la nanoesfera, que es similar al estudio anterior informado por Marrella et al. [46].
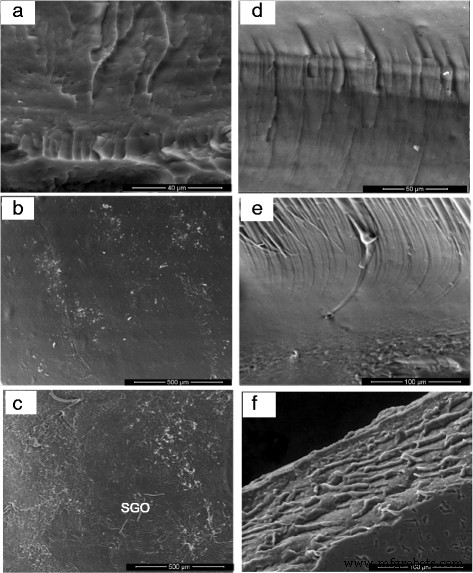
Imágenes FESEM de morfología superficial y sección transversal para a , d alginato de sodio, b , e SA / SGO4 y c , f Biomembranas SA / SGO6

Imagen TEM de nanohojas SGO distribuidas en una matriz de polímero de alginato de sodio
El análisis FTIR muestra la presencia de interacciones de enlaces de hidrógeno entre SGO y la matriz de polímero de alginato. Los resultados de FTIR para las membranas de alginato y de alginato SGO se muestran en la Fig. 6. Parece que se produce un ligero cambio para los espectros del sitio de enlace de hidrógeno de acuerdo con las interacciones de enlace de hidrógeno. Las bandas del grupo O-H en la membrana de alginato aparecieron a 1413 y 3440 cm −1 ; sin embargo, las bandas se cambiaron a 1406 y 3404 cm −1 en la membrana SA / SGO debido al enlace de hidrógeno entre los grupos polares en SGO y los grupos O – H en el alginato [45]. Las bandas del grupo C =O en la membrana de alginato también cambiaron a 1046 desde 1082 cm −1 . La ubicación del grupo sulfónico (–SO 3 H) bandas en la membrana de alginato también cambiaron de 1284 a 1277 cm −1 . Por tanto, los resultados muestran que existe un enlace de hidrógeno entre el SGO y el alginato [47]. Una dispersión completa de las partículas de SGO a lo largo de la matriz de polímero puede facilitar la ruta de conducción de protones en todas las direcciones de la membrana. Como resultado, se asumió que las propiedades de las membranas SA / SGO eran superiores a las de las membranas de alginato prístino de acuerdo con la estructura interior del SEM y los espectros FTIR.
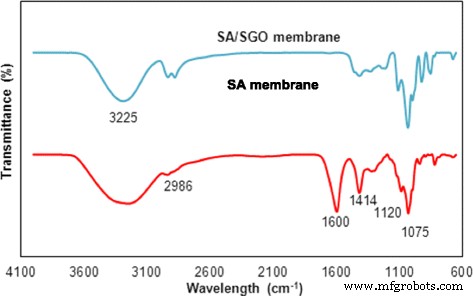
Espectros FTIR de membrana SA y SA / SGO
Estabilidad térmica y propiedades mecánicas
La Figura 7 muestra la comparación del análisis TGA para todas las biomembranas SA / SGO con diferentes contenidos de SGO. Las pérdidas en la primera etapa ocurrieron por debajo de los 200 ° C debido a la liberación de moléculas de agua, lo que se conoce como proceso de evaporación. Generalmente, la descomposición térmica de GO se produce a una temperatura de aproximadamente 200 ° C debido a la descomposición del grupo lábil al oxígeno, mientras que para los polímeros de alginato, la descomposición térmica en la primera etapa es de 178 ° C [48, 49]. La biomembrana SA / SGO muestra una gran pérdida a una temperatura superior a 198 ° C. Este aumento de temperatura indica que existe una interacción entre el alginato de sodio y SGO, lo que aumenta la resistencia al calor de la biomembrana SA / SGO. Esto muestra que la presencia de SGO ha aumentado la estabilidad térmica de la biomembrana debido a interacciones interfaciales favorables, tales como enlaces de hidrógeno o interacciones electrostáticas entre la matriz de alginato de sodio y las nanoláminas de óxido de grafeno sulfonado, lo que hace que esta membrana sea apta para la aplicación de DMFC. La segunda etapa de pérdidas de peso se produce a una temperatura de 250 ° C debido a la descomposición de la cadena lateral de alginato de sodio. La tercera etapa (> 400 ° C) implica el proceso de descomposición de la cadena principal del polímero [50].
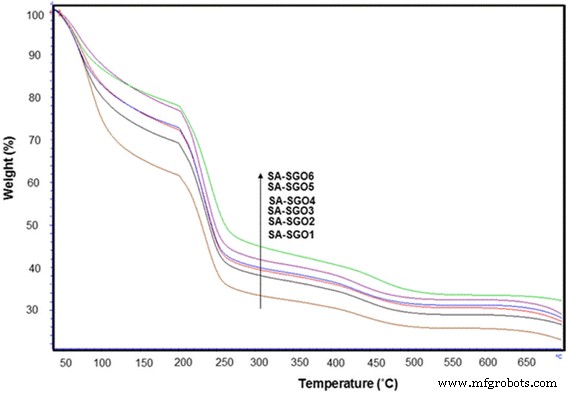
Curva TGA para biomembranas SA / SGO con varios% en peso de SGO
La Figura 8 presenta la tensión de tracción y el alargamiento a la rotura de la membrana a medida que varió el% en peso de SGO. Del 0,02 al 0,13% en peso de SGO, la tensión de tracción aumentó y luego disminuyó ligeramente a 0,17% en peso. Esto podría atribuirse al apilamiento de láminas de óxido de grafeno, que puede estar relacionado con las fuerzas de van der Waals en las nanohojas de GO. La mayor parte de las nanohojas de óxido de grafeno conduce al deslizamiento y reduce el efecto del óxido de grafeno en la mejora de las propiedades mecánicas de la membrana. Las tensiones de tracción de Nafion y otras biomembranas en estudios anteriores se enumeran en la Tabla 1 [51, 52, 53, 54, 55]. La membrana Nafion tiene una mayor tensión de tracción en comparación con la biomembrana SA / SGO6. Sin embargo, es comparable entre las categorías de biomembranas. El propio óxido de grafeno tiene muy buenas propiedades mecánicas, con un módulo de elasticidad de 1100 GPa y una resistencia intrínseca de 125 GPa; esta es la razón principal por la que SGO puede aumentar las propiedades mecánicas de la membrana de alginato [45].
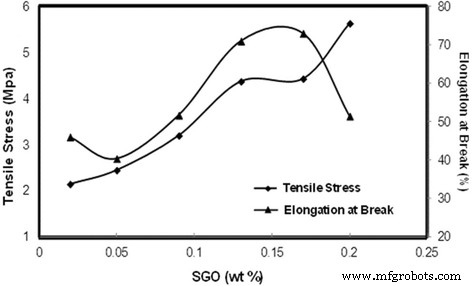
Esfuerzo de tracción y alargamiento a la rotura de la biomembrana con varios% en peso de SGO
Además, la formación de enlaces de hidrógeno entre SGO y el polímero de matriz de alginato puro también puede dar como resultado buenas propiedades mecánicas. Una mayor formación de enlaces de hidrógeno da como resultado una adhesión interfacial más fuerte, mejorando consecuentemente la resistencia mecánica de la membrana. El patrón de alargamiento en la rotura contrasta con el patrón de tensión de tracción. Un esfuerzo de tracción menor da como resultado un mayor porcentaje de alargamiento en el porcentaje de rotura. El alargamiento a la rotura indica hasta qué punto la película de la membrana se puede estirar hasta el punto máximo, lo que también se conoce como flexibilidad. La Tabla 1 compara varias membranas de estudios previos con la membrana del estudio actual en términos de elongación a la rotura [51,52,53,54,55,56]. Los diferentes patrones entre la tensión de tracción y el alargamiento a la rotura son lógicos. Como se mencionó anteriormente, la presencia de SGO en la membrana aumenta el enlace interfacial debido al enlace de hidrógeno, reduciendo así la flexibilidad de la membrana.
Relación de absorción de líquido e hinchazón de la membrana
Se reconoce que el agua es el componente prominente en la membrana de intercambio de protones porque actúa como un conductor de protones en el que el agua adsorbida facilita el transporte de protones [39]. La Figura 9 presenta los resultados de la absorción de agua y la absorción de metanol de la membrana SA / SGO con valores variables de% en peso de SGO. Como se presenta, la membrana SA / SGO tiene una menor capacidad de absorción de agua con diferentes contenidos de GO sulfonado (WU más bajo - 57,9% por SA / SGO6) en la membrana en comparación con el alginato puro. Una cantidad creciente de SGO reduce la absorción de agua debido a su capacidad de bloqueo como relleno en la membrana [5]. La adición de SGO facilita la contracción de las vías iónicas, lo que dificulta el movimiento del agua y el metanol. Un mayor contenido de SGO da como resultado una barrera más fuerte para la absorción de agua de la membrana. El enlace de hidrógeno entre el relleno SGO y el polímero de alginato de sodio refuerza la adhesión interfacial del compuesto de la membrana, reduciendo así la capacidad de absorción de agua [19]. La formación de enlaces de hidrógeno en la membrana SA / SGO involucra los grupos –OH en GO, los grupos –O- y C =O en las cadenas SA, y las contribuciones de los grupos sulfonato (–SO 3 H) [3, 19]. De manera similar al patrón del resultado de la absorción de agua, la absorción de metanol de la membrana SA / SGO también disminuyó al aumentar el% en peso de SGO en la membrana. La presencia de la misma tendencia muestra que hubo una buena red y unión entre SGO y el polímero de alginato, lo que impidió el cruce del combustible. From the experimental result, the presence of graphene oxide-based materials lowered the water uptake capacity of the SA membrane and maintained its mechanical strength. The swelling ratio decreased from 106% to 61.12% with increasing SGO wt% in the alginate polymer matrix (Fig. 9) due to the blocking effect [10]. The strong hydrogen bonding also diminished the pathways for absorbance of the ionic group into the polymer [32].
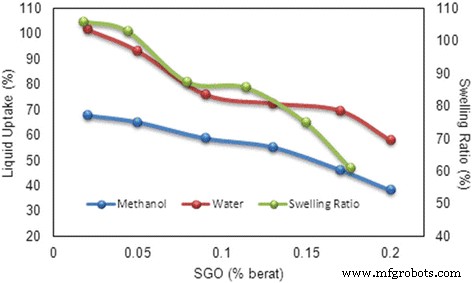
Liquid uptake and swelling ratio of SA/SGO membrane with wt.% of SGO
IEC, Proton Conductivity, Methanol Permeability, and Selectivity
Ion exchange capacity (IEC) calculation is important since it is responsible for measuring the number of milliequivalents ions in 1 g of the prepared membranes and is an indicator for proton conductivity in DMFCs.
Table 2 shows the IEC values of the membranes. A higher IEC value is achieved by the SA/SGO membrane containing a higher wt% of SGO. This is due to the function of sulfonic acid groups in the SGO nanosheets. An increment in the IEC value increases the proton conductivity value of the SA/SGO biomembrane. The proton conductivities of the SA/SGO membrane versus temperature are presented in Fig. 10. Increasing the temperature leads to the enhancement of proton conductivity. The SA/SGO membrane features a consistently increasing pattern in proton conductivity as the SGO particle amount increases, with a maximal value of 13.2 mS cm −1 at 0.2 wt% of SGO loading at temperature of 30 °C. The ln σ vs. 1000/T plot is also shown in Fig. 11. Assuming that the conductivity follows an Arrhenius behavior, the ion transport activation energy E a of the SA/SGO membranes can be obtained according to the Arrhenius equation:
$$ {E}_a=-b\ x\ R $$donde b is the slope of the line regression of ln σ (S/cm) vs. 1000/T (K −1 ) plots, and R is the gas constant (8.314472 JK −1 mol −1 ). The ion transport activation energy of the SA/SGO6 composite membrane is 8.17 kJ mol −1 , which is slightly greater than the E a of Nafion® 115 (6.00 kJ mol −1 ) [57] and lower than that of Nafion 117 (12 kJ mol −1 ) [58]. This can be attributed to the hydrophilic properties of the sodium alginate matrix, which provide high water content, and the introduction of SGO still allows this property to remain due to the hydrophilic properties of oxygenated functional groups. The abundant water forms a continuous transferring channel and makes the movement of ion easy.
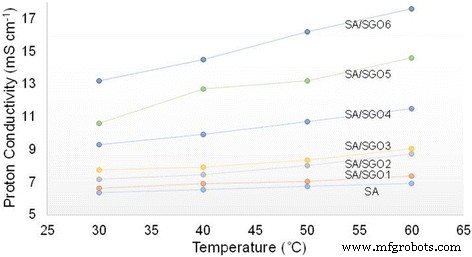
Proton conductivity of SA/SGO biomembranes with various content of SGO at different temperature
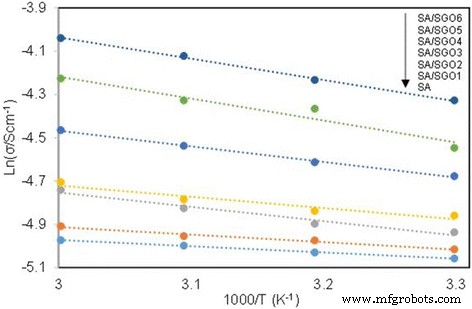
ln σ vs. 1000/T plot for the cross-linked QAPVA membranes, the lines indicate the linear regression
Figure 13a presents the suggested proton mobility mechanism in SA/SGO plasticized with glycerol in which high synchronization exists between H + and electron lone pairs belonging to the oxygen atoms carrier in glycerol and the hydrophilic sulfonic acid groups in SGO nanosheets. We believe that the proton transport applies both Grotthus and vehicle mechanisms, strengthened by the SGO particles.
The SA/SGO biomembranes show very low methanol permeability, and the lowest was achieved by SA/SGO6 (1.535 × 10 −7 cm 2 s −1 ), as listed in Table 2. The low methanol permeability can be explained in terms of the membrane microstructure between sodium alginate, SGO, and glycerol plasticizer. The introduced SGO particles serving as fillers in the SA polymer create substantial obstacles to the linked hydrophilic passages. The SGO filler blocks the migration of methanol passing through the membrane, and this is known as the blocking effect, which reduces the methanol permeability. The methanol permeability also decreases because of the interfacial interaction between the SGO and SA biopolymer [41]. The methanol permeability of the SA/SGO6 bio membrane at four different temperature conditions is shown in Fig. 12. As seen, the methanol permeability increases at a higher temperature, which can be related to the structure changes of the bio membrane. The higher temperature provides more heat, which can shake the membrane chains and molecules, thus leading to more free volume, which consequently reduces the methanol blocking effect. Less resistance causes easier movement of methanol diffusion [59]. Mu et al. [60] reported the decrease in methanol crossover in the presence of Au nanoparticles self-assembled on a Nafion membrane, which consequently improved the overall performance.
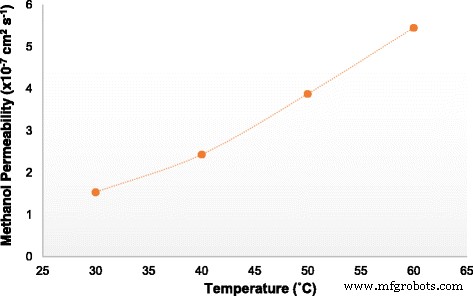
Methanol permeability of membrane SA/SGO6 vs. temperature
The interfacial interaction between SGO filler, glycerol, and SA polymer confines the hydrophilic passage formation in the membrane, and this wide hydrophilic passage is a significant factor in methanol migration [19]. Thus, the presence of SGO facilitates methanol permeability reduction [6]. The proposed mechanism of methanol rejection is presented in Fig. 13b.
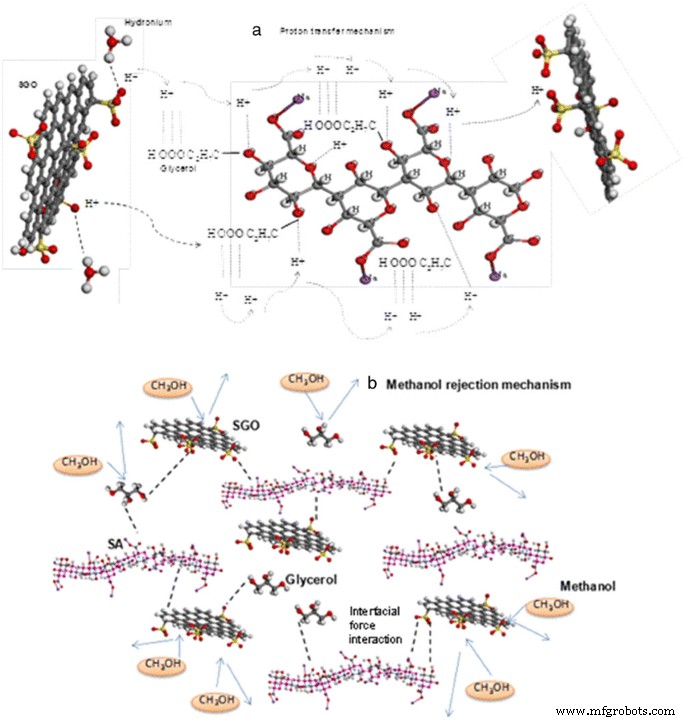
Suggested mechanism of a proton mobility and b methanol rejection
It was noticed that a higher selectivity value resulted in a higher DMFC capability. The selectivity values of the SA/SGO can be observed in Table 2, which compares the selectivity among SA and SA/SGO biomembranes as well as Nafion 117 membranes from previous work. The presence of SGO enhanced the selectivity of the SA/SGO polymer membrane (8.555 × 10 4 S s cm −3 for 0.2 wt% SGO loading), which is higher than that of SA (3.7678 × 10 4 S s cm −3 ) and fortunately also higher than that of Nafion 117 (7.99 × 10 4 S s cm −3 ) [38], 4.05 × 10 4 S s cm −3 [61], and 4.22 × 10 4 S s cm −3 [62], in which the low methanol permeability is the main factor to be considered.
Single Cell
Single-Cell Performance Evaluation
Figure 14 indicates the cell polarization result for pure alginate, SA/SGO6 composite biomembrane and Nafion 117 under ambient temperature, 4 M methanol concentration and passive mode condition. The SA/SGO6 composite biomembrane was applied due to the high selectivity factor and obviously had a higher open-circuit voltage (0.63 V), which can be related to the low methanol permeability equaling to that the sodium alginate biomembrane. The OCV of Nafion 117 (0.52 V) in the current study is lower than SA/SGO and sodium alginate, which might be due its higher methanol permeability. The crossing of methanol through the membrane leads to the reduction in the OCV value. The higher OCV of SA/SGO and alginate membrane is the big indicator that synthesized membrane has lower methanol permeability compared to Nafion, which the main objective of this study is successfully achieved. The improvement in the power density of SA/SGO6 is due to the sulfonic acid group that functions as a proton transferral pathway as well as a methanol inhibitor, thus achieving 5.9 mW cm −2 compared to the sodium alginate, which achieved only 2.83 mW cm −2 . However, Nafion 117 achieved a higher power density, which was 6.62 mW cm −2 . Thiam et al. [38] reported the performance of Nafion 117 membrane under the same condition with a power density of 7.95 mW cm −2 . No doubt, Nafion achieves a better performance in DMFC application due to the excellent proton conduction. However, the power density performance between Nafion 117 and SA/SGO biomembranes does not show a big difference quantitatively. Hence, SA/SGO can be an alternative membrane for DMFC in the future. However, the properties of the membrane still need to be enhanced, and higher wt% of SGO filler can probably be used to obtain a higher power density. To the best of our knowledge, there is only one previous work by Pasini Cabello et al. that has examined the single-cell performance in DMFC application using an alginate biopolymer-based membrane [18]. They tested an alginate/carrageenan membrane at temperatures of 50, 70, and 90 °C in 2 M methanol concentration in the active mode, which achieved maximum power densities of 10.4, 13.9, and 17.3 mW/m 2 , respectivamente. The active mode has an advantage due to the continuous flow of the methanol feed into the cell that allows the reaction to occur continuously and thus is capable of achieving a higher power density. The higher power density could be achieved at a higher temperature due to the higher number of activated protons. Nevertheless, this work is an indicator that biopolymer-based membrane has a big potential that can be explored and applied in DMFC systems.
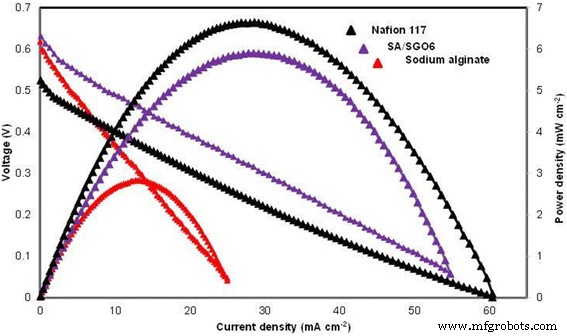
Single-cell performance test for sodium alginate, SA/SGO6, and Nafion 117 (4 M methanol and 25 °C temperature, passive mode)
Conclusiones
In conclusion, a membrane with low methanol permeability, high proton conductivity, and high selectivity was successfully prepared through the simple technique known as the blending method. The presence of sulfonated graphene oxide enhanced the properties of the alginate-based polymer membrane in terms of proton conductivity and methanol permeability. The sulfonate groups facilitated the networking between the alginate polymer and the graphene oxide filler. The blocking effect of SGO also reduced the methanol crossover in the membrane. The primary weaknesses of the alginate polymer, which are its mechanical properties of tensile strength and elongation at break, were also improved by the addition of SGO into the polymer matrix. The presence of SGO improved the SA/SGO membrane to a high level comparable to commercial membranes.
Abreviaturas
- BC:
-
Bacterial cellulose
- CNC:
-
Cellulose nanocrystal
- CNFs:
-
Cellulose nanofibers
- CNT:
-
Nanotubos de carbono
- DI:
-
Deionized
- DLFC:
-
Direct liquid fuel cell
- DMFC:
-
Direct methanol fuel cell
- EDX:
-
Energy dispersive X-ray
- FESEM:
-
Field emission scanning electron microscope
- FTIR:
-
Infrarrojos por transformada de Fourier
- GO:
-
Óxido de grafeno
- GOS:
-
Graphene oxide sheet
- HRTEM:
-
High-resolution transmission electron microscopy
- IEC:
-
Ion exchange capacity
- L :
-
Distance between the two electrodes
- OCV:
-
Open circuit voltage
- P:
-
Membrane diffusion permeability for methanol
- PEMFC:
-
Polymer electrolyte membrane fuel cell
- PEMs:
-
Proton exchange membrane
- PMA:
-
Phospho molybdic acid
- PSSA:
-
Poly-styrene sulfonic acid
- PVA:
-
Poly vinyl alcohol
- PVP:
-
Poly (vinyl pyrrolidone)
- R :
-
Resistance of the membrane
- RGO:
-
Reduced graphene oxide
- SA:
-
Sodium alginate
- SA/SGO:
-
Sodium alginate/sulfonated graphene oxide membrane
- SGO:
-
Sulfonated graphene oxide
- SHNT:
-
Sulfonated halloysite nanotube
- SPSF:
-
Sulfonated polysulfone
- SW%:
-
Swelling ratio percentage
- T :
-
Membrane thickness
- TGA:
-
Thermal gravimetric analysis
- W :
-
Width of the membrane
- WU%:
-
Water uptake percentage
- XPS:
-
Espectroscopia de fotoelectrones de rayos X
Nanomateriales
- Grafeno en altavoces y auriculares
- Nanofibras y filamentos para una mejor administración de fármacos
- Nanotubos de titanato Nanocompuestos de óxido de grafeno decorados:preparación, retardo de llama y fotodegradación
- Bioseguridad y capacidad antibacteriana del grafeno y el óxido de grafeno in vitro e in vivo
- Fabricación y caracterización de un nuevo catalizador anódico compuesto de nanofibras de carbono Tio2 para celdas de combustible de metanol directo mediante el método de electrohilado
- Síntesis fácil de óxido de estaño mesoporoso similar a un agujero de gusano a través del autoensamblaje inducido por evaporación y las propiedades mejoradas de detección de gas
- Diseño y ajuste de la función de trabajo del grafeno mediante tamaño, modificación, defectos y dopaje:un estudio de teoría del primer principio
- Evaluación de estructuras de grafeno / WO3 y grafeno / ceO x como electrodos para aplicaciones de supercondensadores
- Preparación de molienda de bolas en un solo paso de óxido de grafeno / CL-20 a nanoescala para una sensibilidad y un tamaño de partículas significativamente reducidos
- Preparación de polimerización in situ de nanocompuesto de polietileno / grafeno de peso molecular ultra alto mediante una estructura esférica y en sándwich Soporte de grafeno / Sio2
- Sílice recubierta de titanio sola y modificada con alginato de sodio como absorbentes de iones de metales pesados



