Estabilidad mejorada de nanopartículas magnéticas de oro con poli (ácido 4-estirenosulfónico-ácido co-maleico):propiedades ópticas personalizadas para la detección de proteínas
Resumen
Las nanopartículas magnéticas de oro (GoldMag) han atraído una gran atención debido a sus características físicas y químicas únicas que combinan las del Fe 3 individual O 4 y nanopartículas de Au. El recubrimiento de GoldMag con polímeros no solo aumenta la estabilidad de las partículas compuestas suspendidas en el tampón, sino que también juega un papel clave para establecer pruebas ópticas en el punto de atención para biomoléculas clínicamente relevantes. En el presente artículo, se utilizó poli (ácido 4-estirenosulfónico-ácido co-maleico) (PSS-MA), un polielectrolito cargado negativamente con grupos aniónicos tanto sulfonato como carboxilato, para revestir la superficie GoldMag (30 nm) cargada positivamente. El complejo GoldMag recubierto con PSS-MA tiene un pico de adsorción de resonancia de plasmón estable a 544 nm. Se ha acoplado un par de anticuerpos anti-dímero D en esta superficie de nanopartículas compuestas GoldMag y se detectó una proteína diana, el dímero D, en el rango de 0,3 a 6 μg / ml. El cambio del pico característico, causado por el ensamblaje de GoldMag debido a la formación de puentes sándwich de dímero D-anticuerpo, permitió la detección.
Antecedentes
Aprovechando una propiedad de magnetización específica, es decir, el superparamagnetismo, las nanopartículas magnéticas se han investigado ampliamente para aplicaciones biomédicas, como la administración de fármacos / genes, imágenes por resonancia magnética y ensayos biológicos [1, 2, 3]. Nanopartículas magnéticas de oro (GoldMag), compuestas de Fe 3 O 4 / Au, no solo tiene las propiedades fisicoquímicas de las nanopartículas de óxido de hierro, sino que también presenta las características de las nanopartículas de oro, como una fácil funcionalización de la superficie y propiedades ópticas únicas. Estas características distintivas han atraído gran atención en el campo de la biología [4, 5], especialmente en la detección de biomoléculas basada en propiedades ópticas. Como ejemplo, Wang et al. usó Fe 3 O 4 -Barras au como sondas ópticas para la detección multiplex de patógenos [6]. Sin embargo, al igual que con otras nanopartículas, la alta energía de la superficie fuerza a las partículas GoldMag una hacia la otra para que formen grupos en la solución tampón. Esto limita enormemente su aplicación para la detección óptica en el área biomédica. Por lo tanto, es crucial prevenir la agregación de GoldMag y garantizar una solución coloide estable. La personalización de GoldMag para la detección de moléculas objetivo en función del recubrimiento con polímeros tiene una gran utilidad. Se ha informado que la dispersión de GoldMag puede mejorar mediante la modificación de la superficie con varios compuestos orgánicos macromoleculares, como el ácido 11-mercaptoundecanoico (MUA) [7], poliestirenosulfonato (PSS) [8] y polietilenimina (PEI) [9]. MUA se introdujo en la superficie de GoldMag utilizando la estrategia de intercambio de ligando. Mejoró la estabilidad de las soluciones coloidales GoldMag mediante la modificación de la superficie con MUA [7]. Estos MUA-GoldMag se han utilizado en la detección de proteínas basándose en propiedades ópticas. Sin embargo, la cadena de MUA era demasiado corta para proporcionar suficiente impedimento estérico para asegurar suficiente dispersión de partículas. Además, la baja densidad de grupos carboxilo en MUA limita la cantidad de proteína que puede ser absorbida por GoldMag. Estas desventajas restringen la aplicación de partículas MUA en instrumentos ópticos y limitan la sensibilidad requerida para la detección de biomarcadores.
Poli (ácido 4-estirenosulfónico-co-ácido maleico) (PSS-MA) (PSS-MA 3:1, Mw ~ 20.000), un copolímero de bloque, se obtiene mediante la unión covalente de PSS y ácido polimaleico y contiene sulfonato y grupos carboxilato. La repulsión electrostática proporcionada por la gran cantidad de grupos carboxilo y grupos sulfonato, así como el impedimento estérico proveniente de la larga cadena polimérica de PSS-MA hacen que este polímero sea muy útil para mantener la estabilidad de las nanopartículas. De hecho, el PSS-MA se ha utilizado como estabilizador en la preparación de nanopartículas, como nanomateriales de óxido de hierro, nanoestructuras bimetálicas de paladio y Ag-Au [10,11,12]. Johnston y col. reportaron que los nanoclusters de óxido de hierro recubiertos de copolímero aseguran un mayor grado de estabilización electrostérica que los nanoclusters de óxido de hierro recubiertos de polímero de una sola macromolécula [13]. Además, la gran cantidad de grupos carboxilo en el resto de ácido polimaleico de PSS-MA permite la modificación química con biomoléculas para aplicaciones biomédicas.
Los dímeros D son productos finales estables de la degradación de la fibrina reticulada, como resultado de una mayor formación de fibrina y fibrinólisis [14]. La determinación del nivel de dímero D en sangre se usa ampliamente en el diagnóstico de eventos tromboembólicos e infarto de miocardio [15, 16]. Aquí, utilizamos el dímero D como modelo para evaluar el potencial de usar PSS-MA-GoldMag para la detección óptica de proteínas específicas. Usamos un par de anticuerpos anti-dímero D para la inmovilización en PSS-MA-GoldMag con el fin de formar sondas para la detección del dímero D mediante el inmunoensayo sándwich de doble anticuerpo.
Por lo tanto, en el presente estudio, se utilizó PSS-MA para la modificación de la superficie de GoldMag. Esto no solo mejoró la estabilidad de las nanopartículas magnéticas, sino que también media la conjugación entre las nanopartículas y los anticuerpos para la detección de dímeros.
Métodos
Materiales y reactivos
GoldMag (5 mg / mL) fue proporcionado por Xi’an GoldMag Nanobiotech Co., Ltd. (Xi’an, PRC). Se adquirieron ácido bórico, bórax, bromuro de cetiltrimetilamonio (CTAB), poli (ácido 4-estirenosulfónico-ácido co-maleico) (PSS-MA) (PSS-MA 3:1, Mw ~ 20.000) de Sigma-Aldrich, EE. UU. Se adquirieron de Roche un par de anticuerpos monoclonales de dímero D (anticuerpo 1:M-2.1.16; anticuerpo 2:M-1.2.57). El dímero D se adquirió en Meridian Chemicals, EE. UU.
GoldMag modificado en superficie con PSS-MA
Los GoldMag se sintetizaron como se describió anteriormente [17]. Se añadieron 13,3 ml de CTAB (50 mmol / L) a 13,3 ml de GoldMag (aproximadamente 3 mg / ml). La mezcla se agitó mecánicamente (200 rpm) combinada con ultrasonidos (SB-5200DTD, China) durante 30 min, seguido de agitación adicional sin ultrasonidos durante otros 30 min. Las partículas se lavaron minuciosamente con agua desionizada. Los CTAB-GoldMag se redispersaron en 10 mL de agua desionizada y 16 mL de 25% ( w / w ) Se añadió una solución de PSS-MA seguido de agitación (180 rpm) durante 90 min. Las partículas modificadas se lavaron dos veces con agua desionizada y se dispersaron en agua desionizada.
Caracterización
Los PSS-MA-GoldMag se observaron utilizando un microscopio electrónico de transmisión (TEM, Hitachi H-600, Hitachi Corporation, Japón). La distribución de tamaño fue analizada por DLS (zeta-sizer, Malvern Instruments, Reino Unido). Se utilizó espectroscopia infrarroja por transformada de Fourier (FTIR, Thermo Nicolet 5700, Thermo Nicolet Corporation, EE.UU.) para caracterizar los grupos funcionales de PSS-MA-GoldMag. Se utilizó un analizador termogravimétrico (TGA) Metter Toledo SDTA 851e para analizar la proporción de capa de superficie de polímero entre los PSS-MA-GoldMag. El espectro de resonancia de plasmón de superficie (SPR) de GoldMag se registró con un espectrofotómetro UV-2550 (Shimadzu, Japón) en el rango de longitud de onda de 450 a 700 nm.
Preparación de la sonda Anticuerpo anti-dímero D-PSS-MA-GoldMag
Se suspendió un miligramo de GoldMag en 1 ml de tampón de bórax / borato (0,02 M, pH 7,4), que contenía 75 mg / ml de 1-etil-3- (3-dimetil-laminopropil) carbodiimida (EDC). Luego, se añadieron 100 µg de anticuerpo anti-dímero D a la suspensión seguido de ultrasonidos durante 1 h. Se añadieron tres mililitros de tampón de bloqueo (tampón de borax / borato 0,02 M, pH 7,4, que contenía BSA al 5%) a la mezcla y se incubaron durante 1,5 h. Después de la separación bajo un campo magnético externo, el compuesto de anticuerpo anti-dímero D-PSS-MA-GoldMag se mantuvo en tampón de bórax / borato por debajo de 4 ° C. La conjugación del anticuerpo anti-dímero D en la superficie de PSS-MA-GoldMag se confirmó mediante espectroscopía SPR y medición de dispersión dinámica de luz (DLS).
La solución de dímero D se preparó diluyendo una solución madre de dímero D (40 mg / ml) con suero de ternera. Se utilizaron tres concentraciones de dímero D (0,6, 2 y 6 μg / ml) para optimizar el tiempo de reacción entre el dímero D y el complejo anticuerpo anti-dímero D-PSS-MA-GoldMag. Se mezclaron diez microlitros de anticuerpo anti-dímero D-PSS-MA-GoldMag (0.3 mg / mL) con 80 μL de solución de dímero D (0.6, 2 y 6 μg / mL), y la mezcla se incubó a 25 ° C durante 10, 20, 30 y 40 min. La longitud de onda del pico SPR del compuesto PSS-MA-GoldMag se leyó usando un espectrofotómetro UV-2550.
Se prepararon soluciones de dímero D con concentraciones de 6, 3, 1.5, 0.75 y 0.3 μg / mL para analizar la relación entre la concentración de dímero D y el cambio del espectro de SPR. Se mezclaron diez microlitros de anticuerpo anti-dímero D-PSS-MA-GoldMag (0.3 mg / mL) con 80 μL de solución de dímero D (6, 3, 1.5, 0.75 y 0.3 μg / mL) y la mezcla se incubados a 25 ° C durante 30 min. La longitud de onda del pico SPR de PSS-MA-GoldMag se leyó usando un espectrofotómetro UV-2550.
Para evaluar si los triglicéridos, la bilirrubina y la hemoglobina pueden interferir con nuestro sistema de detección de proteínas, se prepararon soluciones de dímero D (0 y 3 μg / ml) y 22 mg / ml de triglicéridos, 0,2 mg / ml de bilirrubina y 2 mg / ml de Se agregaron muestras de hemoglobina de mL por separado. Se agregaron diez microlitros de anticuerpo anti-dímero D-PSS-MA-GoldMag a las mezclas anteriores, y se leyó la longitud de onda del pico SPR del compuesto PSS-MA-GoldMag usando un espectrofotómetro UV-2550.
Resultados y discusión
El esquema 1 ilustra los procedimientos desarrollados para la modificación de la superficie y la funcionalización de partículas para la detección colorimétrica de proteínas. Para estudiar la adsorción e incorporación de PSS-MA en las estructuras de PSS-MA-GoldMag, se realizaron análisis espectroscópicos FTIR, espectroscopía SPR y TGA. La Figura 1a muestra el espectro FTIR para PSS-MA, PSS-MA-GoldMag y GoldMag puros, respectivamente. La banda ancha y fuerte a 3000–3700 cm −1 corresponde al estiramiento de los grupos –CO – OH y los grupos hidroxilo de –SO 2 –OH en cadenas poliméricas [18]. Vibraciones simétricas de grupos sulfonato:(SO 3 - ) estaban en 1037 y 1126 cm −1 y las vibraciones de estiramiento de C =C del benceno fueron de 1403 y 1637 cm −1 [19]. Estas bandas de absorción características de PSS-MA se observaron en PSS-MA-GoldMag demostrando que las partículas crudas se recubrieron con éxito con PSS-MA. El cambio de los grupos químicos de la superficie del GoldMag se confirmó mediante un desplazamiento azul claro de 11 nm de 555 a 544 nm en la banda SPR después de la modificación (Fig. 1b). La posición y el ancho del pico SPR se relacionó con la superficie, el medio ambiente y la dispersión de las nanopartículas [20, 21, 22, 23]. El análisis de TGA indicó que la relación en peso de material orgánico a GoldMag era casi 1:4 (Fig. 1c). A baja temperatura, la pérdida de peso se puede atribuir a la deshidratación; cuando la temperatura aumenta, la pérdida de peso puede atribuirse a la descomposición oxidativa de las moléculas orgánicas en la superficie de las partículas modificadas [19, 24]. Durante la modificación, CTAB-GoldMag se cargó positivamente (+ 12,2 mV) y la superficie de la partícula se cargó negativamente (- 24,5 mV) después del recubrimiento de PSS-MA sobre la superficie de las partículas (Fig. 1d). Todos los resultados anteriores muestran que los PSS-MA se adhieren con éxito a la superficie de las nanopartículas.
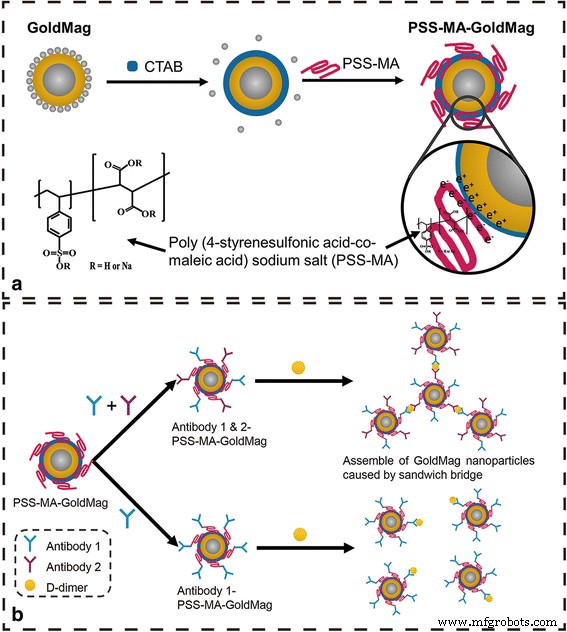
un La ilustración esquemática del proceso "general" de modificación de la superficie de las partículas magnéticas de oro (GoldMag) y la estructura molecular del poli (ácido 4-estirenosulfónico-ácido co-maleico) (PSS-MA). b Representación esquemática de la interacción del dímero D con el anticuerpo 1 y 2-PSS-MA-GoldMag, así como la interacción entre el dímero D y el anticuerpo 1-PSS-MA-GoldMag
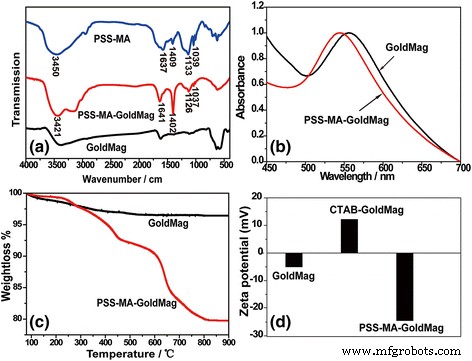
un Espectroscopía FTIR de PSS-MA, PSS-MA-GoldMag y GoldMag. b Espectroscopía SPR de GoldMag y PSS-MA-GoldMag suspendidos en agua. c Análisis TGA de GoldMag y PSS-MA-GoldMag. d El cambio de potencial zeta como resultado de la modificación
Las micrografías (Fig. 2a, b) de GoldMag y PSS-MA-GoldMag obtenidas usando TEM muestran que estas partículas eran mono-dispersas, después de la modificación. La capa de polímero en la superficie de las partículas es claramente visible bajo la imagen de microscopio electrónico de alta resolución, lo que indica además que el recubrimiento de polímero sobre GoldMag fue exitoso (Fig. 2b). La Figura 2c muestra que el diámetro medio de PSS-MA-GoldMag es de 116 nm. La suspensión de PSS-MA-GoldMag tiene un color rojo vino que indica una buena estabilidad de las nanopartículas (1 año en agua).
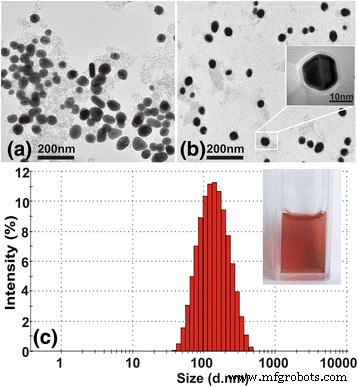
un Imágenes TEM de GoldMag. b Imágenes TEM de PSS-MA-GoldMag. El recuadro muestra partículas por paquete de polímero. c Distribución de tamaño de GoldMag y PSS-MA-GoldMag. El recuadro muestra la fotografía de la solución PSS-MA-GoldMag, que muestra un color rojo
La estabilidad de las características ópticas de GoldMag y PSS-MA-GoldMag en soluciones tampón con diferentes valores de pH se analizaron mediante espectroscopía SPR [7]. Como se muestra en la Fig. 3a, el pico característico de SPR se desplazó a la longitud de onda más larga de 555 nm cuando GoldMag se suspendió en tampón de bórax / borato con un pH de 6,0 a 9,0. La composición de la solución tampón también influye en la estabilidad de la suspensión GoldMag. La posición del pico característico de SPR se movió a longitudes de onda más altas (558 nm) cuando GoldMag se suspendió en tampón PB (pH 7,4), tampón de bórax / borato (pH 7,4) y solución de NaCl (10 mM) en comparación con los del agua desionizada. (550 nm) (figura 3c). Sin embargo, el pico SPR característico (545 ± 2 nm) no cambió significativamente cuando se dispersó PSS-MA-GoldMag en solución de electrolito o en solución tampón con diferentes valores de pH (Fig. 3b, d). Xia y col. y Storhoff et al. También han informado de que la agregación de nanopartículas puede hacer que el espectro SPR cambie a longitudes de onda más largas [25, 26]. También se midió el potencial zeta de GoldMag y PSS-MA-GoldMag (Fig. 3e, f). Se ha informado de que un potencial zeta bajo (menos de ± 30 mV) conducirá a la aglomeración de partículas [27, 28]. Cuando GoldMag se suspendió en tampón PB (pH 7,4), tampón de bórax / borato (pH 7,4) y solución de NaCl (10 mM), el potencial zeta de GoldMag fue - 16,7 ± 1,1 mV, - 14,3 ± 2,1 mV y - 8,9 ± 1,5 mV, respectivamente. El potencial zeta de GoldMag fue - 14,2 ± 1,7 mV, - 17 ± 1,1 mV, 13,9 ± 1,7 mV y - 18,1 ± 1,6 mV cuando las partículas se suspendieron en tampón de bórax / borato con un pH de 6,0 a 9,0. Sin embargo, la adherencia de PSS-MA a GoldMag reduce drásticamente su potencial zeta en diferentes soluciones de electrolitos, así como a diferentes valores de pH. En todos los casos, el potencial zeta fue inferior a - 30 mV. Estos resultados indican que la modificación de la superficie de GoldMag con PSS-MA mejora significativamente su resistencia a los cambios de composición y de los valores de pH de las soluciones tampón y asegura un alto nivel de dispersión [29].
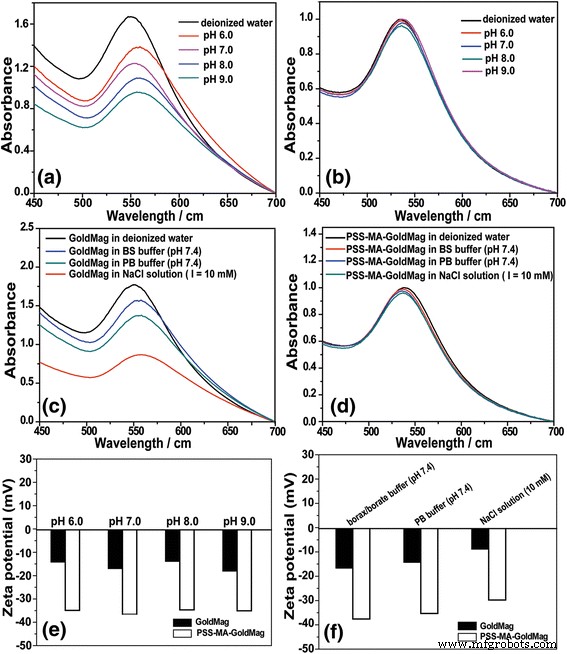
un Los espectros SPR de GoldMag en tampón de bórax / borato (0.02 mol / L) con diferentes valores de pH que van desde 6.0 a 9.0. b Los espectros de SPR de PSS-MA-GoldMag en tampón de bórax / borato (0.02 mol / L) con diferentes valores de pH que van desde 6.0 a 9.0. c Los espectros de SPR de GoldMag suspendidos en tampón de bórax / borato (0,02 mol / L, pH 7,4), tampón PB (0,2 mol / L, pH 7,4) y en una solución electrolítica. d Los espectros de SPR de PSS-MA-GoldMag suspendidos en tampón de bórax / borato (0,02 mol / L, pH 7,4), tampón PB (0,2 mol / L, pH 7,4) y en solución electrolítica. e El cambio de potencial zeta de GoldMag suspendido en tampón de bórax / borato (0.02 mol / L) con diferentes valores de pH que van desde 6.0 a 9.0. f El cambio de potencial zeta de GoldMag suspendido en tampón de bórax / borato (0,02 mol / L, pH 7,4), tampón PB (0,2 mol / L, pH 7,4) y en solución de electrolitos
Para investigar la interacción entre la proteína y PSS-MA-GoldMag, se conjugaron anticuerpos anti-dímero D con PSS-MA-GoldMag a través de la reacción entre los grupos amino de la proteína y los grupos carboxilo del polímero mediada por EDC. Como se muestra en la Fig. 4a, se observó un desplazamiento hacia el rojo del pico SPR después de la reacción de PSS-MA-GoldMag con anticuerpos anti-dímero D, lo que indica la conjugación de anticuerpos en nanopartículas [30, 31]. El aumento del diámetro medio de las partículas de 116 a 130 nm confirma la introducción del anticuerpo anti-dímero D al PSS-MA-GoldMag (Fig. 4b) [24]. La influencia de la masa de anticuerpos en la propiedad óptica de PSS-MA-GoldMag se evaluó mediante espectroscopía SPR después de agregar diferentes cantidades de anticuerpo anti-dímero D (de 20 a 200 μg) a la suspensión de PSS-MA-GoldMag. Como se muestra en la Fig. 4c, el pico de SPR no cambió y se mantuvo en 548 ± 3,0 nm, independientemente de la cantidad de anticuerpo añadido.
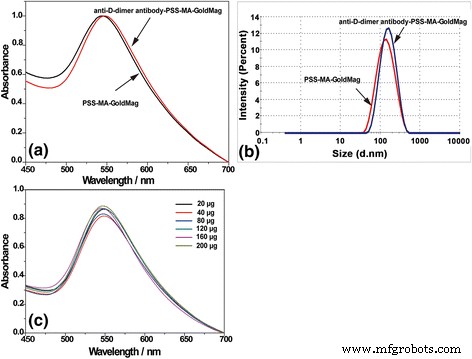
un Los espectros SPR de PSS-MA-GoldMag y anticuerpo anti-dímero D-PSS-MA-GoldMag. b La distribución de tamaño de anticuerpo-PSS-MA-GoldMag y PSS-MA-GoldMag. c El pico de partículas de SPR no se modificó con el aumento de las concentraciones de anticuerpos
Para evaluar la actividad de los anticuerpos después de la conjugación en PSS-MA-GoldMag, se prepararon la sonda A y la sonda B inmovilizando un par de anticuerpos (anticuerpo 1 y anticuerpo 2), y el anticuerpo 1 en PSS-MA-GoldMag, respectivamente. La interacción entre los dos tipos de sonda y dímero D se analizó mediante espectroscopía SPR. El mejor tiempo de reacción se obtuvo al observar el cambio del máximo del pico de SPR durante 40 min después de agregar tres concentraciones de dímero D (0.6, 2 y 6 μg / mL) a la sonda A. Como se muestra en la Fig. 5a, Se observó un cambio significativo en la banda de plasmón superficial como resultado de la agregación de PSS-MA-GoldMag a través de enlaces cruzados entre el puente sándwich antígeno-anticuerpo a lo largo del tiempo. A baja concentración (0,6 μg / mL), no hubo cambios significativos en el espectro de SPR de 20 a 40 min, lo que indica que 20 min es suficiente para la reacción de 0,6 μg / mL o concentraciones más bajas de dímero-D. Sin embargo, usando concentraciones medias y altas de dímero D (2 y 6 μg / mL), la longitud de onda siguió aumentando 30 min. Esto indica que el mejor tiempo de reacción es de 30 min. Como se muestra en la Fig. 5b, el espectro SPR de las partículas compuestas reveló un cambio rojo distinto en la resonancia del plasmón superficial de λ max =550 a 570 nm y disminución de la intensidad del pico característico a medida que la concentración de dímero D aumentó de 0,3 a 6 μg / ml. Esto es provocado por la agregación de PSS-MA-GoldMag causada por la conexión cruzada del dímero D con el anticuerpo 1 y el anticuerpo 2 en la sonda A. La agregación de PSS-MA-GoldMag resultó en el cambio de las propiedades ópticas del oro. parte de PSS-MA-GoldMag. Jiang y col. y Li et al. También han informado de que la agregación de nano-oro puede hacer que el espectro SPR de las nanopartículas se desplace hacia el rojo y el borde [32, 33]. Sin embargo, no se observó desplazamiento hacia el rojo en la Fig. 5d porque la interacción entre el dímero D y el anticuerpo 1 no pudo conducir al ensamblaje de nanopartículas. Además, se observó un desplazamiento al rojo distinguible (5 nm), incluso la cantidad de dímero D añadido a la sonda A fue tan baja como 0,3 μg / ml, lo que indica que el límite de detección está por debajo de los valores de corte de diagnóstico (0,5 μg / mL) para este biomarcador. Se encontró una relación lineal entre la posición del pico espectral SPR y la concentración de dímero D en el rango de 0.3 a 6 μg / mL ( r 2 =0,9944) (figura 5c).
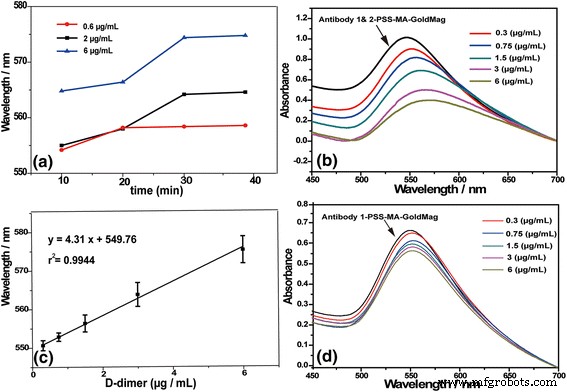
un La relación entre el tiempo de reacción y el espectro de SPR. b El corrimiento al rojo de los espectros SPR debido a la agregación de partículas GoldMag causada por la conexión cruzada del dímero D con la sonda A. c La curva trazada del pico de SPR de los materiales compuestos en función de la concentración de dímero-D. d La espectroscopia SPR de compuestos después de la adición de dímero D a la sonda B
Como se muestra en la Fig. 6, no se encontró un cambio significativo del pico característico de SPR de PSS-MA-GoldMag en presencia de triglicéridos, bilirrubina y hemoglobina, respectivamente. Este resultado indica que nuestro sistema de detección de proteínas no tiene reacciones que interfieran con los triglicéridos, la bilirrubina y la hemoglobina.
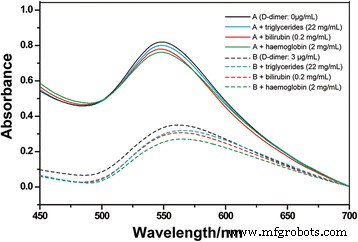
Los espectros de SPR del anticuerpo anti-dímero D-PSS-MA-GoldMag después de la reacción con muestras de dímero D en presencia y ausencia de triglicéridos, bilirrubina y hemoglobina
Estos resultados muestran que PSS-MA-GoldMag es una nanopartícula magnética prometedora para la inmovilización de proteínas y puede formar un puente sándwich en la superficie de la partícula a través del anticuerpo 1-proteína diana-anticuerpo 2. Esto hace que PSS-MA-GoldMag sea valioso como material de uso en la detección óptica de biomarcadores en el punto de atención.
En este estudio, PSS-MA se utilizó por primera vez para la modificación de GoldMag (esquema 1). La introducción de PSS-MA a la superficie de GoldMag mejoró significativamente su estabilidad en la solución tampón. Además del impedimento estérico causado por la larga cadena polimérica de PSS-MA, los grupos carboxilo y el grupo sulfo en PSS-MA causan repulsión electrostática entre las nanopartículas [29]. Esto mejora significativamente la estabilidad de PSS-MA-GoldMag. La gran cantidad de grupos carboxilo en la superficie de la partícula cumple con el requisito de conjugación con biomolécula.
Conclusiones
En el presente estudio, se informó sobre un método fácil y rápido para recubrir GoldMag con PSS-MA. Los resultados muestran que la estabilidad coloidal y la dispersión de GoldMag mejoraron significativamente mediante la introducción de PSS-MA. Las partículas presentan buena estabilidad en solución tampón con un amplio rango de pH. Además, la presencia del grupo carboxilo ofrece la opción de conjugar proteínas a las nanopartículas. Tomando el dímero D y su anticuerpo como modelo, se encuentra que la característica óptica se puede adaptar a través de la reticulación entre el antígeno y el compuesto de nanopartículas de anticuerpo. Los resultados muestran que el GoldMag modificado con PSS-MA puede servir como un candidato muy prometedor para la detección óptica basada en inmunoensayos.
Abreviaturas
- DLS:
-
Dispersión de luz dinámica
- FTIR:
-
Espectroscopía infrarroja por transformada de Fourier
- GoldMag:
-
Nanopartículas magnéticas de oro
- MUA:
-
Ácido 11-mercaptoundecanoico
- PEI:
-
Polietilenimina
- PSS:
-
Poliestirenosulfonato
- PSS-MA:
-
Poli (ácido 4-estirenosulfónico-co-ácido maleico)
- SPR:
-
Resonancia de plasmón superficial
- TEM:
-
Microscopio electrónico de transmisión
- TGA:
-
Analizador termogravimétrico
Nanomateriales
- Nanopartículas de oro para sensores de quimioterapia
- Preparación y propiedades magnéticas de nanopartículas de espinela de FeMn2O4 dopadas con cobalto
- La detección fotoelectroquímica mejorada de ácido úrico en electrodo de carbono vítreo modificado con nanopartículas de Au
- Biosensor ultrasensible para la detección de ADN de Vibrio cholerae con nanoesferas compuestas de poliestireno-co-ácido acrílico
- Síntesis hidrotermal de nanopartículas de In2O3, gemelos híbridos, discos hexagonales, heteroestructuras de ZnO para mejorar las actividades fotocatalíticas y la estabilidad
- Efectos sinérgicos de nanopartículas de Ag / BiV1-xMoxO4 con actividad fotocatalítica mejorada
- Nanocompuestos magnéticos de poli (N-isopropilacrilamida):efecto del método de preparación sobre las propiedades antibacterianas
- Comparación entre el ácido fólico y la funcionalización basada en péptidos gH625 de nanopartículas magnéticas de Fe3O4 para una internalización celular mejorada
- Las cáscaras de diatomeas de sílice diseñadas con nanopartículas de Au permiten el análisis sensible de moléculas para aplicaciones biológicas, de seguridad y medioambientales
- Propiedades microestructurales, magnéticas y ópticas de las nanopartículas de perovskita manganita La0.67Ca0.33MnO3 sintetizadas mediante el proceso Sol-Gel
- El poli (ácido γ-glutámico) promueve la decloración mejorada de p-clorofenol mediante nanopartículas de Fe-Pd



