Eliminación por adsorción de iones de cobre (II) de una solución acuosa utilizando un nano-adsorbente de magnetita de residuos de cascarilla de molino:síntesis, caracterización, adsorción y modelado cinético Estudios
Resumen
En este estudio, el nano-adsorbente de magnetita (MNA) se extrajo de productos de desecho de escala de laminación, se sintetizó y se aplicó para eliminar Cu 2+ de una solución acuosa. El producto de desecho de la cascarilla de laminación se trituró usando un molido convencional y se impactó usando un molino de bolas de alta energía (HEBM) durante 3, 5 y 7 horas de molienda. En este sentido, el MNA preparado se investigó mediante difracción de rayos X (XRD), microscopio electrónico de transmisión de alta resolución (HRTEM), microscopía electrónica de barrido por emisión de campo-espectroscopía de rayos X de dispersión de energía (FESEM-EDS), UV-Vis espectroscopía, infrarrojo por transformada de Fourier (FTIR), Brunauer-Emmett-Teller (BET) y potencial zeta. El tiempo de molienda resultante de MNA-7 h mostró una estructura cristalina con formas irregulares de 11,23 nm, una superficie específica de 5,98 m 2 g −1 , magnetización de saturación, Ms de 8.35 emug −1 y carga puntual isoeléctrica a pH 5,4. La capacidad de adsorción óptima, q e de 4,42 mg.g −1 para la eliminación de Cu 2+ iones se obtuvo a los 120 min de tiempo de contacto. Los datos experimentales se ajustaron mejor al modelo de isoterma de Temkin. Una comparación entre los estudios cinéticos experimentales y los aspectos teóricos mostró que el pseudo-segundo orden coincidía con las tendencias experimentales con un coeficiente de correlación de ( R 2 > 0,99). Además, se logró una eficiencia de regeneración del 70,87% después de tres ciclos de estudios de reutilización. El MNA ofrece un enfoque práctico, eficiente y de bajo costo para reutilizar productos de desecho de escala de laminación y proporcionar una separación ultrarrápida para eliminar Cu 2+ del agua.
Introducción
El agua es uno de los recursos naturales más valiosos de la naturaleza y juega un papel fundamental en la existencia de todos los seres vivos [1]. Con la revolución de la economía mundial y la rápida expansión de la industrialización contemporánea, los desafíos de la contaminación del agua se agravan [2]. La nocividad del medio ecológico a través de los metales pesados está creciendo intensamente en todo el mundo debido a la enorme cantidad de vertidos que emanan de rutas industriales y poblacionales. Los metales pesados no biodegradables son muy venenosos y tienden a acumularse en los órganos del ser humano y otros organismos que habitan, socavan el suministro de calidad del agua, desencadenan diversas dificultades en la vida acuática y provocan numerosas enfermedades y trastornos [3, 4, 5] . En particular, la liberación de aguas residuales que comprenden iones de cobre (II) (Cu 2+ ) resultante de las vías antropogénicas hacia las aguas domésticas ha resultado ser problemático para la salud pública y el medio ambiente [6, 7, 8]. Aunque Cu 2+ es un oligoelemento importante en el cuerpo humano y en diversas rutas biológicas y metabolismo de los animales [9], un consumo enorme en concentraciones elevadas podría provocar graves impactos toxicológicos, por ejemplo, convulsiones, calambres, vómitos o al mismo tiempo la muerte. Por ejemplo, la contaminación debida a Cu divalente inicia dramatización, queratinización, picazón en manos y pies, y exhibe influencias cancerígenas y mutagénicas [10-12]. Además, el consumo superfluo de cobre provocará trauma oxidativo y síndromes neurodegenerativos agudos, como la esclerosis lateral amiotrófica, el trastorno de Menkes, la enfermedad de Alzheimer y la enfermedad de Wilson [13, 14]. La contaminación del agua por Cu 2+ se considera una de las molestias ambientales más frecuentes desde Cu 2+ los compuestos están contenidos en el exceso de actividades industriales [15]. Por el contrario, la deficiencia de Cu 2+ en la nutrición animal puede causar diarrea, anemia y trastornos nerviosos [16]. La Organización Mundial de la Salud (OMS), estipuló que el nivel tolerable para Cu 2+ en el agua potable es de 2 mgL −1 [17, 18]. Además, la Agencia de Protección Ambiental de los Estados Unidos (USEPA) fijó la concentración máxima aceptable de cobre en el agua en 1.3 mgL −1 [19]. Por lo tanto, el nivel de Cu 2+ en la dieta diaria, particularmente en el agua potable y las aguas residuales, debe controlarse y reducirse a la menor cantidad antes de su liberación a los alrededores [20].
En un intento por frenar estos efectos peligrosos sobre el medio ambiente, se han utilizado numerosos métodos de remediación de efluentes, como la precipitación [21], el intercambio iónico [22], la precipitación química, la coprecipitación [23], los procesos de membrana [24, 25, 82]. ], coagulación [26] y adsorción [3, 27-30] para eliminar Cu 2+ de aguas residuales. En medio de estos enfoques, la adsorción es muy deseable debido a su extrema conveniencia, rentabilidad, facilidad de operación, flexibilidad, procedimiento de diseño simple, simplicidad, eficacia de eliminación superior, practicidad y reciclabilidad más amplias [10, 31-33]. Por lo tanto, el enfoque central se ha desplazado hacia la explotación de nuevos adsorbentes que comprenden diversos grupos funcionales que podrían acelerar Cu 2+ eliminación.
Se pueden aplicar varios adsorbentes para eliminar metales pesados del agua mediante adsorción, incluido el carbón activado [34], la biomasa agrícola [35], los óxidos metálicos [36], los nanomateriales de sílice [37, 38], los minerales arcillosos [31, 39, 40], otros [41]. Sin embargo, más aplicaciones de estos sorbentes están restringidas debido a su condición compleja o modificación de equipos específicos y baja adsorción. Además, los adsorbentes convencionales muestran una recuperación débil de los iones metálicos diana de grandes volúmenes de solución debido a las deficiencias de difusión, la capacidad de unión mínima y la insuficiencia de los sitios de superficie activa [42]. Por lo tanto, la necesidad de explorar nuevos nanoabsorbentes de bajo costo con una mayor eficacia de adsorción, una superficie de adsorción sustancial, una resistencia a la difusión mínima, una capacidad de adsorción superior y una separación rápida para grandes volúmenes de solución es indispensable.
Recientemente, se han utilizado varios absorbentes nuevos, incluidos nanomateriales, materiales mesoporosos, nanotubos de carbono (CNT), materiales recubiertos de iones y nanopartículas magnéticas [11, 43, 44, 45]. Entre estos, los nano materiales han recibido una gran atención por sus características biológicas, físicas y químicas, consecuencia de la gran relación superficie-volumen, mayor absorción de iones metálicos con una capacidad de adsorción superior [46,47,48]. El nanoabsorbente magnético tiene una fuerte tendencia a adsorber contaminantes de desechos líquidos gaseosos o acuosos, y la aplicación de estos absorbentes magnéticos para desenredar muchos obstáculos de contaminación ambiental ha ganado una atención cada vez mayor en los últimos años [11]. El adsorbente de magnetita es un precursor prometedor de bajo costo con varias propiedades únicas como su alta área de superficie, superparamagnético, alta anisotropía, alta coercitividad, baja temperatura de Curie altamente activa, facilidad de separación, alta susceptibilidad magnética, excelentes capacidades de reciclaje y reutilización, magnéticas propiedades de atracción, entre otras [49, 50, 83]. Además, las NP se consideran eficaces para la sorción de algunos iones metálicos, aniones, ligandos, cationes y colorantes, por lo que su aplicación resulta atractiva en un campo innovador de adsorción, recuperación o eliminación de algunos iones [51,52,53] .
A la luz de esto, se puede inferir que los estudios que utilizaron nano-adsorbente de magnetita a partir de astillas molidas industriales obtenibles localmente utilizando una técnica de molienda de bolas de alta energía para eliminar Cu 2+ de agua son bastante limitados y apenas se han aplicado a pesar de su impresionante potencial. En este sentido, este estudio se centra en la síntesis de un nuevo nanoadsorbente de magnetita (MNA) a partir de residuos de escamas de laminación mediante el método de molienda de bolas de alta energía y su aplicación como una eliminación económica de iones de cobre (II) de metales pesados en agua, a partir del modelo. de soluciones acuosas. Además, también se investigó el estudio cinético de superficie del MNA reciclado a partir de residuos de escamas de laminación utilizados como adsorbentes de metales en el tratamiento de aguas residuales. La ecuación del modelo cinético de la reacción de MNA se desarrolló y estudió cuidadosamente.
Materiales y métodos
Materiales y productos químicos
En este trabajo, las astillas de residuos de escamas de laminación en bruto se suministraron desde la fábrica de acero ubicada en Terengganu, Malasia. El agua desionizada (DI) utilizada en el experimento por lotes se obtuvo del sistema de refinamiento Milli-Q water. El nitrato de cobre (Cu (NO 3 ) 2 ) se adquirió de Aldrich (Chemical Industry Stock Co., Ltd., China) para la preparación de una solución estándar de cobre (1000 ppm). Se empleó un pH 5-SS (Probador de pH de lanza) en el experimento para medir el pH y agitar. Se utilizó el espectrofotómetro UV-Vis (HACH DR4000U) para analizar la concentración de cobre a una longitud de onda de 600 nm. La concentración inicial de cobre se midió utilizando el procedimiento estándar (APHA, 2005) [54], y la mayor parte restante de la muestra se conservó en un enfriador a 4 ℃.
Síntesis de nano-adsorbente de magnetita (MNA)
Los chips de residuos de escamas de laminación en bruto contienen partículas magnéticas e impurezas (partículas no magnéticas). Las impurezas se eliminaron para evitar la contaminación de la muestra. La Figura 1 describe el método utilizado para la síntesis de nano-adsorbente de magnetita (MNA) a partir de chips molidos. En primer lugar, las virutas molidas se lavaron extensamente con agua desionizada y se secaron a 104 ° C durante 24 horas y luego se trituraron en micrones utilizando una máquina de fresado convencional. Este procedimiento se llevó a cabo de manera constante durante 48 h, y la magnetita de tamaño micro resultante (Fe 3 O 4 ) se limpió posteriormente con la técnica de separación magnética (MST). El MST estimula la separación de partículas magnéticas y no magnéticas. Posteriormente, la magnetita de micrones limpia se secó en el horno durante 48 ha 104 ℃ y luego se transportó a un recipiente hermético. Además, las partículas magnéticas fuertes se separaron de las débiles mediante una técnica de separación de temperatura de Curie (CTST), como se indica en la Fig. 1. Este método está de acuerdo con el procedimiento adoptado por [55-57]. Las partículas magnéticas robustas separadas se secaron posteriormente al aire durante 24 hy luego se sometieron a un molido de bolas de alta energía (HEBM) durante tres tiempos de molienda diferentes de 3, 5 y 7 h para obtener una magnetita de tamaño nanométrico [58].

Procedimiento de síntesis de nano-adsorbente de magnetita usando el método HEBM
Caracterización del adsorbente de nanomagnetita preparado (MNA)
La morfología estructural del adsorbente sintetizado se analizó con TEM / EDS usando Hitachi Co., Modelo de Japón No. S3400N. El FTIR proporciona información sobre los grupos funcionales existentes en el adsorbente sintetizado. El aparato de infrarrojos Bruker-Tensor 27 con método estándar de pellets de KBr en el rango espectral de 400 a 4000 cm −1 con 2 cm −1 La resolución identificó los espectros FTIR del adsorbente de nano-magnetita. Se aplicó la técnica de difracción de rayos X (XRD) para analizar la estructura cristalina y la fase del MNA sintetizado utilizando el Difractómetro Philips Expert de difracción de rayos X (XRD) con radiación Cu Kα (λ =0.154 nm) obtenido en el rango 2θ de 20 a 80 ° con un tamaño de paso de escaneo de 2θ =0.033 con 5 s por paso como recuento. El espectro XRD observado se comparó con la base de datos estándar de ICSD. Las composiciones estructurales y morfológicas de la muestra de MNA se obtuvieron mediante una micrografía electrónica de barrido de emisión de campo (FESEM), JEM JEOL 2100, EE. UU., Con microscopio electrónico de transmisión de alta resolución (HRTEM). El ensayo Brunauer-Emmett-Teller (BET):Micromeritics II PLUS, EE. UU., Se realizó para identificar el área de superficie específica del MNA mediante adsorción-desorción de nitrógeno utilizando el analizador automático de área de superficie y porosidad NOVA2020e. Antes del análisis, el MNA se desgasificó a 100 ° C. Las mediciones del potencial zeta se realizaron utilizando un medidor zeta (Malvern ZS, Reino Unido). El medidor zeta proporcionó una titulación de varios valores de pH. La investigación sobre las propiedades magnéticas de la muestra en polvo de MNA se realizó utilizando un magnetómetro de muestra vibrante (VSM) Modelo:LAKESHORE 7404, con un campo externo aplicado de 0-13 kOe (kG).
Estudios de adsorción
Las pruebas de sorción se realizaron utilizando un sistema por lotes. Una solución madre de nitrato de cobre (Cu (NO 3 ) 2 ) (50 mgL −1 ) se preparó y se diluyó para dar las concentraciones adecuadas. El pH se ajustó usando 0,1 molL −1 HCl o 0,1 molL −1 NaOH. Las concentraciones inicial y final de Cu 2+ se determinaron utilizando un espectrofotómetro ultravioleta-visible (UV-Vis) (Modelo:HACH DR4000U) a λ =600 nm, según la curva de calibración preparada. Todas las pruebas de sorción se realizaron en matraces de 250 mL, a los que se les añadió una cantidad adecuada de adsorbente y 100 mL de la solución iónica. Los estudios cinéticos se realizaron utilizando una concentración inicial de 1 mg / L de ion Cu (II) con 0,5 g de Fe 3 O 4 . La temperatura y el pH se mantuvieron constantes a 25 ° C y pH 7, respectivamente. Las concentraciones iniciales de iones Cu (II) fueron 10, 20, 30, 40, 50 mg / L en 200 mL. El pH se varió a 2, 4, 6, 8, 10 y 12 mediante la adición de HCl y NaOH. Los estudios preliminares demuestran que el proceso de adsorción alcanzó una condición de equilibrio en 180 min. Para estudiar la dosificación que influyó en las capacidades de adsorción se utilizaron diferentes dosis de MNA, que oscilan entre 10 y 50 mg. El porcentaje de eliminación (% RE ) y capacidad de adsorción ( q e ) de Cu 2+ Los iones se determinaron usando las Ecs. 1 y 2, respectivamente [59, 60].
$$ \% RE =\ frac {{C_ {o} - C_ {e}}} {{C_ {o}}} \ times 100 $$ (1) $$ q_ {e} =\ frac {V} { m} \ izquierda ({C_ {o} - C_ {e}} \ derecha) $$ (2)donde C o y C e , representó las concentraciones inicial y final (mgL −1 ) de la solución, respectivamente. V es el volumen de la solución en litros, y m es la masa del adsorbente en gramos (g). q e (mg / g) es la cantidad de adsorbato por unidad de masa de adsorbente en el tiempo t.
Estudio cinético
Los experimentos se llevaron a cabo utilizando Jar Tester con 200 mL de solución de cobre a una temperatura constante de 28 ℃ y a pH 5,4. Las muestras se tomaron en un intervalo de tiempo diferente a los 0, 10, 20, 30, 40 y 50 min y se analizaron mediante UV-Vis. Los modelos cinéticos se estudiaron utilizando pseudo-primer orden y pseudo-segundo orden de Lagergren. El pseudoprimer orden de Lagergren se describe en la Ec. (3):
$$ q_ {t} =q_ {e} \ left ({1 - e ^ {{- k_ {1} t}}} \ right) $$ (3)donde q e (mg / g) y q t (mg / g) son las cantidades de adsorbato adsorbido en equilibrio y en el tiempo t , respectivamente, y k 1 (mínimo −1 ) es la constante de velocidad de adsorción de pseudo primer orden. Para la tasa de adsorción en el mecanismo de segundo orden, la ecuación de la tasa cinética de pseudo-segundo orden se puede expresar como Eq. (4):
$$ q_ {t} =\ frac {t} {{\ frac {1} {{k_ {2} q_ {e} ^ {2}}} + \ frac {t} {{q_ {t}}}} } $$ (4)donde k 2 (gmg −1 .min −1 ) es la constante de velocidad de equilibrio de la adsorción de pseudo segundo orden.
Estudio de regeneración
El MNA se volvió a reclamar mediante un enfoque de desorción de disolvente cuando los sitios de poros activos alcanzaron el equilibrio. El MNA se separó mediante un imán externo de la solución acuosa y, posteriormente, se sumergió en una solución de HCL y se mezcló durante 180 min a 26. El MNA resultante se enjuagó luego con agua destilada para lograr un pH neutro y luego se mantuvo durante 1 ha 60. El MNA regenerado se reutilizó luego junto con estudios previos [54, 55]. La eficiencia de reutilización (RE%) se calculó utilizando la Ec. 5:
$$ RE =\ frac {{q_ {reg}}} {{q_ {ori}}} \ veces 100 \% $$ (5)donde q reg y q ori son sus respectivas capacidades de adsorción por unidad de masa del adsorbente original y regenerado.
Análisis estadístico
Los datos experimentales se sometieron a un diseño completamente aleatorizado, y los datos obtenidos se analizaron mediante un análisis de varianza unidireccional (ANOVA) mediante un procedimiento de modelo lineal general (GLM) en el software SAS Versión 9.4 (SAS Institute Inc., Cary, NC , EE.UU). Se utilizó la prueba de rango múltiple de Duncan para separar las medias en p <0.05 nivel de significancia.
Resultados y discusión
Análisis estructural y de fase
Los resultados del examen XRD de las escamas de las plantas de desechos después de MST y CTST se muestran en la Fig. 2a. Después del proceso de MST (Fig. 2ai), la XRD confirmó la presencia de wuestita (FeO) y magnetita (Fe 3 O 4 ). La difracción de Bragg de wuestita se observó a 2θ de 36,33 ° (111), 61,40 ° (044), 73,25 ° (113), según se correspondía con ICSD:98–001-2335. La fase de magnetita se observó a 2θ de 35,61 ° (113) y 43,28 ° (004), acordado como referencia Fe 3 O 4 Archivo ICSD 98–010-9826.
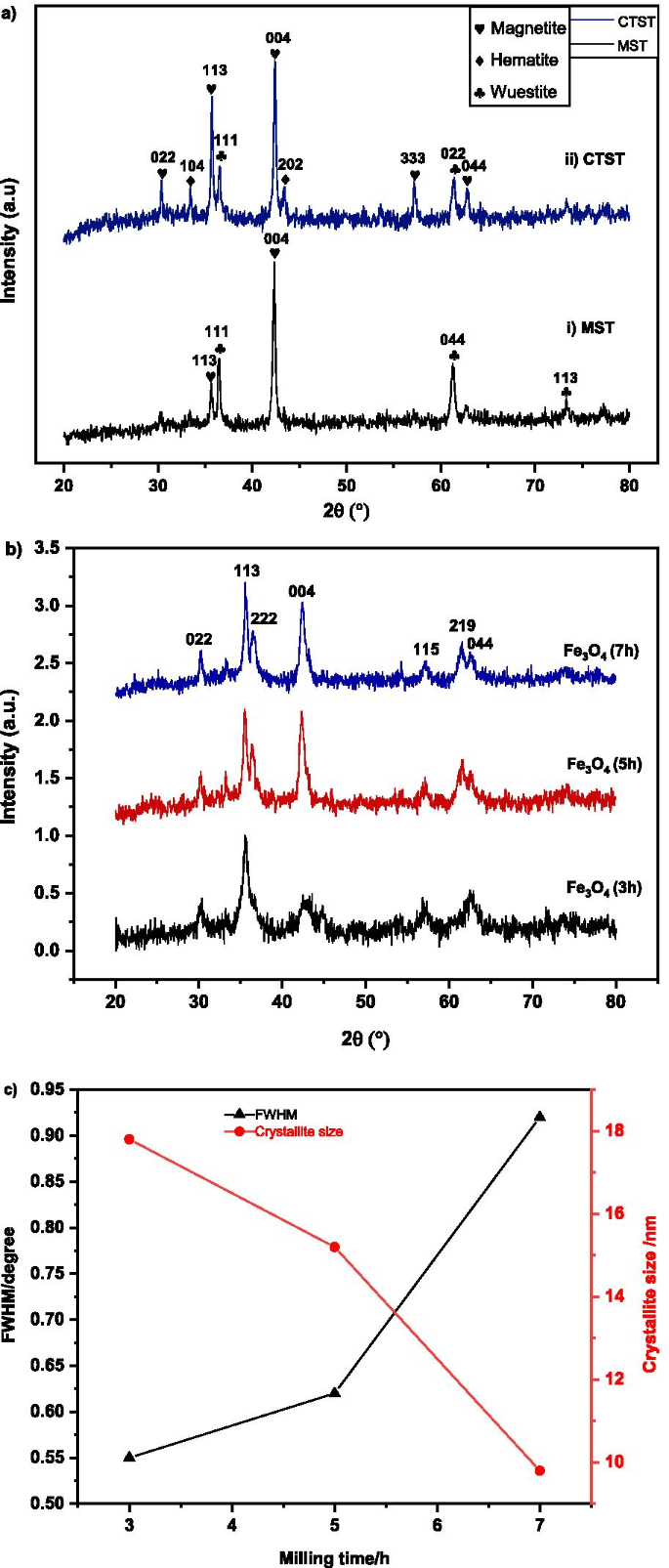
un Espectros de difracción de rayos X de escala de laminación después de someterse a MST y CTST, b espectros indexados de magnetita en diferentes tiempos de molienda de 3, 5 y 7 h, c El ancho completo a la mitad del máximo (FWHM) y el tamaño de cristalito de MNA con tiempo de molienda
Para el espectro XRD después del proceso CTST (Fig. 2aii), se observó la presencia de fase magnetita, hematita y wuestita. El ángulo de difracción de Bragg (2θ) de todos los picos fue esencial para identificar y coincidir con el archivo ICSD de referencia 98-010-9826 para magnetita con los picos son 30.23 ° (022), 35.61 ° (113), 43.28 ° (004), 57,24 ° (333), 62,86 ° (044). Los picos de hematita también se observaron a 33,44 ° (104), 48,48 ° (202) según se correspondía con ICSD 98–004-6407); y ángulos de difracción de wuestita de 36,33 ° (111) y 61,27 ° (022) según ICSD:98–001-2335. El resultado fue acordado y similar a lo informado en la literatura anterior [84].
La Figura 2b ilustra los patrones de difracción XRD de polvo de escamas de molino después del proceso de molienda de bolas de alta energía, en diferentes intervalos de tiempo de 3, 5 y 7 h. Los espectros de difracción de la muestra sintetizada revelaron la presencia de magnetita (Fe 3 O 4 ) fase con un diámetro nanométrico para todos los tiempos de molienda. El ángulo de difracción a 2θ de 30,24 °, 36,66 °, 36,57 °, 42,45 °, 57,26 °, 61,54 ° y 62,76 ° se puede indexar a (022), (113), (222), (004), (224), (115) y (044) confirmando los picos de firma de una celda unitaria cúbica Fe 3 O 4 , respectivamente. Los espectros XRD se hicieron coincidir con la referencia ICSD 98–01-11.241 de magnetita con un grupo espacial de Fd -3 m y parámetro de celosía ( a = b = c ) de 8,3440 Å. El adsorbente de nano-magnetita exhibe una alta pureza con un aumento en el tiempo de molienda como se demuestra en la Fig. 2b. La alta energía generada por la bola de acero que choca en los viales es responsable de romper el enlace de oxígeno y reduce la hematita (Fe 2 O 3 ) a la magnetita (Fe 3 O 4 ) fase. A medida que aumenta el tiempo de molienda, se observó que la formación de magnetita nanocristalina se determinó mediante el ensanchamiento de los picos de XRD. A medida que aumenta el tiempo de molienda, se observó que aumentaba el ensanchamiento del pico XRD, lo que indica la disminución del tamaño de las partículas. También se observó que las intensidades máximas de XRD disminuían, al aumentar el tiempo de molienda. El patrón indica la disminución del tamaño de partícula de las muestras [61]. A medida que disminuye el tamaño de las partículas, las deformaciones inducidas durante el proceso de molienda dan como resultado una disminución en la intensidad del pico y un ensanchamiento del pico de difracción. El tamaño medio de cristalito D de muestras se calculó usando la fórmula de Debye-Scherrer como en la Ec. (6) [62].
$$ D =\ frac {0.9 \ lambda} {{\ beta \ cos \ theta}} $$ (6)donde D es el tamaño medio de cristalito, λ es la longitud de onda de los rayos X (0,1541 nm), β es el ancho completo a la mitad del máximo (FWHM), y θ es el ángulo de difracción. Los espectros XRD se analizaron automáticamente con el software X’pert Highscore Plus. La relación de FWHM y tamaños de cristalitos se muestra en la Fig. 2c. El análisis muestra que el cambio en el polvo de MNA microscópico con el aumento en el tiempo de molienda de 3, 5 y 7 h con el cambio de variación en el FWHM y el tamaño de cristalito promedio de MNA como se muestra en la Fig. 2c. La tendencia de variación de FWHM reveló que con el aumento en el tiempo de molienda de 3, 5 y 7 h, el FWHM muestra una tendencia de aumento. Con el aumento del tiempo de molienda de 3, 5 y 7 h, el tamaño medio de cristalito disminuyó desde un valor mínimo de 17,8 nm, 15,2 nm y 9,8 nm, respectivamente.
Composición morfológica y microestructural
Las micrografías HRTEM del MNA molido en diferentes tiempos de molienda de 3, 5 y 7 h se presentan en la Fig. 3. Las micrografías muestran que las partículas de MNA exhiben una forma irregular durante los tres períodos de molienda como se muestra en la Fig. 3. Además, Se observó un tamaño medio de partícula de MNA de 5,53 nm a las 3 h de tiempo de molienda en comparación con 14,45 nm (5 h) y 19,16 nm (7 h). Esto implica que se podría lograr un tamaño de partícula de MNA más pequeño con un tiempo de molienda más corto. El tamaño de partícula promedio para 3, 5 y 7 h se obtuvo en el rango de 10 a 22 nm. A medida que aumenta el tiempo de molienda, también aumenta la microdeformación en la muestra [63]. Por lo tanto, las horas de molienda prolongadas producirán más tensión en las muestras. El aumento de la deformación de la red con el tiempo de molienda se debió a un fuerte efecto de distorsión causado por la dislocación y difusión del átomo en la red introducida durante el proceso de molienda. Sin embargo, se observaron efectos de aglomeración en la muestra de MNA como se muestra en la Fig. 3, debido al comportamiento de atracción magnética del polvo de magnetita.

Imágenes HRTEM con una barra de escala de 20 nm de MNA en a 3 h b 5 hy c 7 h de tiempo de molienda
Análisis de propiedades magnéticas
Las propiedades magnéticas de las muestras se investigaron utilizando un VSM a temperatura ambiente. La respuesta de magnetización ( M ) con el campo magnético externo aplicado ( H ) de las muestras se muestra en la Fig. 4. La magnetización de saturación ( M s ), remanencia ( M r ) y la coercitividad ( H c ) de las muestras se resumen en la Tabla 1. El valor de coercitividad del MNA está en el rango de 200-270 G, la remanencia entre 1.5 y 6.6 emu / gy los valores de magnetización de saturación entre 21 y 27 emu / g. Debido al diámetro del tamaño de partícula que es menor de 20 nm, las muestras tienen una propiedad superparamagnética. A partir de los parámetros de magnetización (Tabla 1), esto indica que las muestras consisten en una mezcla de compuestos superparamagnéticos y ferromagnéticos que contribuyen al aumento de la capacidad de adsorción. La muestra de MNA-7 h muestra los parámetros magnéticos más altos (Fig. 4) que contribuyeron a la mayor capacidad de adsorción del estudio de adsorción de Cu (Fig. 5).
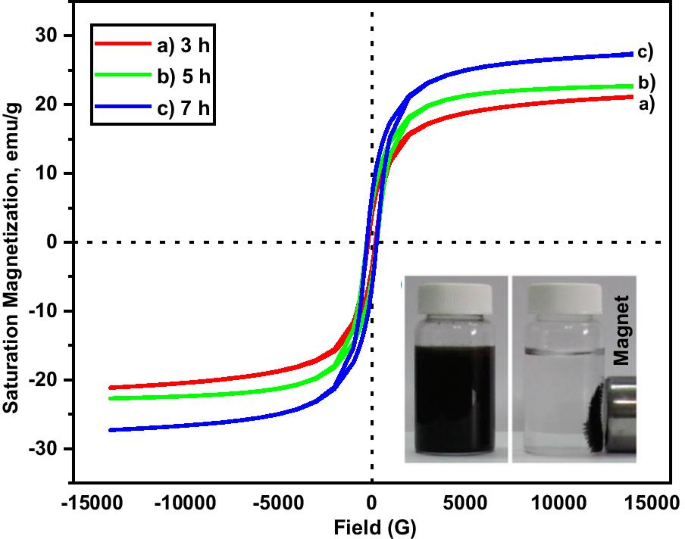
M-H gráfico de histéresis de muestras en diferentes tiempos de molienda a 3 h, b 5 hy c 7 h
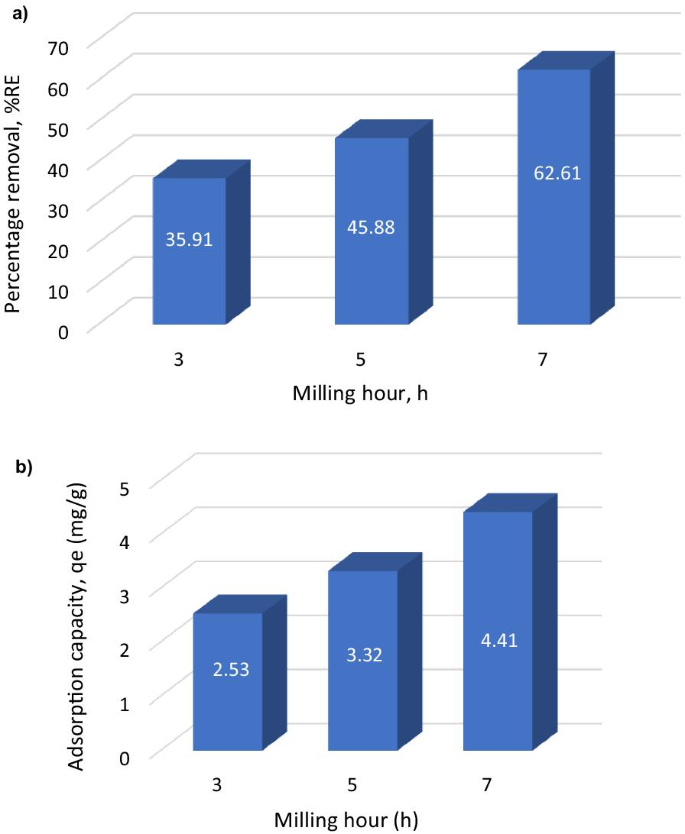
un El gráfico de barras de eliminación porcentual; b capacidad de absorción / adsorción de metales de MNP en Cu 2+ a diferentes horas de molienda
Efecto de los parámetros de adsorción
Se ha investigado un análisis adicional sobre el estudio de adsorción por lotes de MNA de 3, 5 y 7 h. La Figura 5 muestra el estudio de absorción que se llevó a cabo para el MNA en varios tiempos de molienda de 3, 5 y 7 h. El gráfico muestra la mayor capacidad de adsorción (captación de metal) ( q e ) y el porcentaje más alto de eliminación (% RE ). Las horas de molienda de MNA-7 h muestran la mayor capacidad de adsorción y el mayor porcentaje de eliminación de la solución acuosa. Por lo tanto, se eligió MNA-7 h como el nanoabsorbente de MNA para un análisis adicional de absorción por lotes en varios parámetros de tiempo de contacto, concentración inicial, dosis de absorbente, área de superficie, pH y temperaturas.
Análisis del área de superficie
La adsorción de nitrógeno usando BET se utilizó para evaluar el área superficial y las características de los poros del MNA durante 7 h de molienda. La Figura 6a muestra el resultado BET para MNA-7 h con un volumen de poro promedio de 0.011 cm 3 g −1 y una superficie específica de 5,98 m 2 g −1 . El N 2 La curva de adsorción-desorción de MNA-7 h se encuentra en la curva de histéresis de tipo III (Fig. 6b) según lo acordado con lo informado previamente por Sing et. Alabama. (1985) [65]. Los resultados de BET describen las interacciones adsorbente-adsorbato de las moléculas adsorbidas que se agrupan en la superficie del MNA [66]. Por tanto, la adsorción en el tipo III revela que las moléculas de gas se adsorbieron físicamente en el MNA [67].
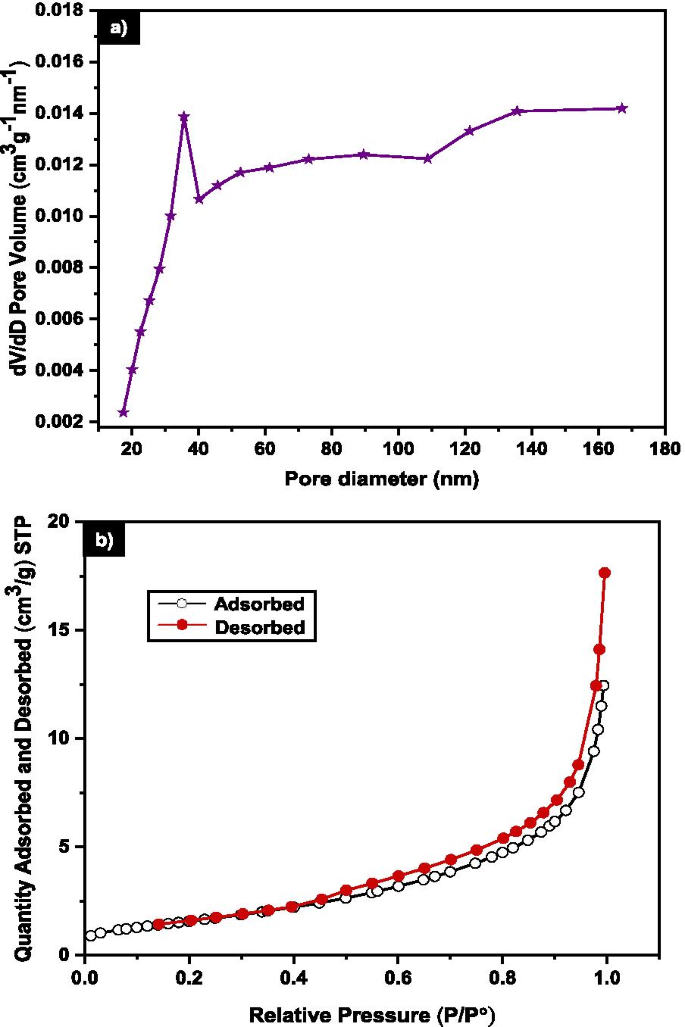
un Distribución del diámetro de poro de 7 h MNA b Isoterma de adsorción-desorción de nitrógeno
Análisis EDS
Los constituyentes elementales de MNA-7 h se ilustran en la Fig. 7. Los análisis FESEM y EDS revelaron la presencia del elemento Fe y O con un porcentaje de 78,25% y 21,75%, respectivamente, para MNA-7 h antes del proceso de adsorción (Fig. 7a). La Figura 7b representa los espectros de EDS que indican la presencia de elementos Fe, Cu y O después del proceso de adsorción. La existencia de cobre en los espectros muestra la adsorción de Cu 2+ por MNA. Esta tendencia también está de acuerdo con los espectros mostrados en los estudios informados por Lingamdinne et al. (2016) [64] ya que las nanopartículas de óxido de hierro se utilizaron para la eliminación por adsorción de metales pesados.
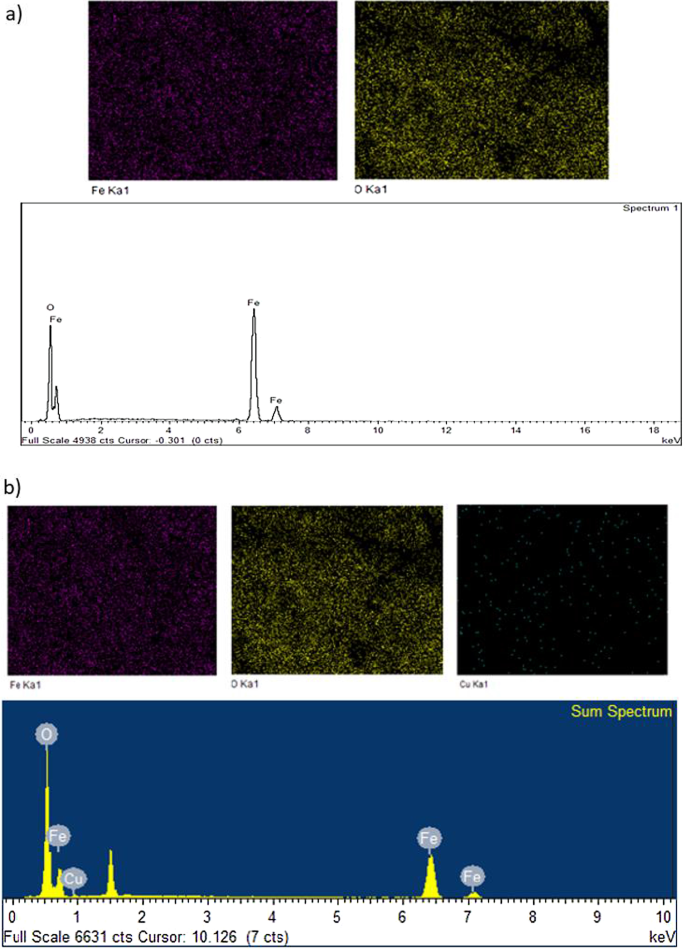
Análisis de espectro EDS ( a ) antes de la adsorción y ( b ) después de la adsorción de iones Cu (II)
Análisis FTIR
También se determinó una confirmación adicional de la adsorción de Cu sobre MNA-7 h mediante un análisis FTIR. Se investigó el FTIR para identificar el grupo funcional y la unión de Cu 2+ en MNA. La Figura 8 muestra los espectros FTIR del MNA-7 h antes y después de la adsorción de iones Cu (II). Los espectros FTIR revelan una banda de pico de características fuertes del Fe 3 O 4 nanopartículas. Después de la adsorción, el espectro FTIR revela los cambios en la intensidad de las bandas en el rango de 500 a 600 cm −1 y 2800–3600 cm −1 que conduce a Cu 2+ sorción. Además, las bandas de adsorción a 525 cm −1 y 576 cm −1 representan los sitios tetraédricos y octaédricos de las nanopartículas de magnetita de banda Fe-O [68]. El espectro de adsorción amplio y fuerte a 3478 cm −1 corresponde al grupo hidroxilo (- OH) y trazas de molécula de agua en la superficie del MNA [69]. La espectroscopia FTIR revela que el MNA tiene una estructura cristalina debido a la presencia de algunas sustancias químicas adsorbidas en la superficie del MNA.
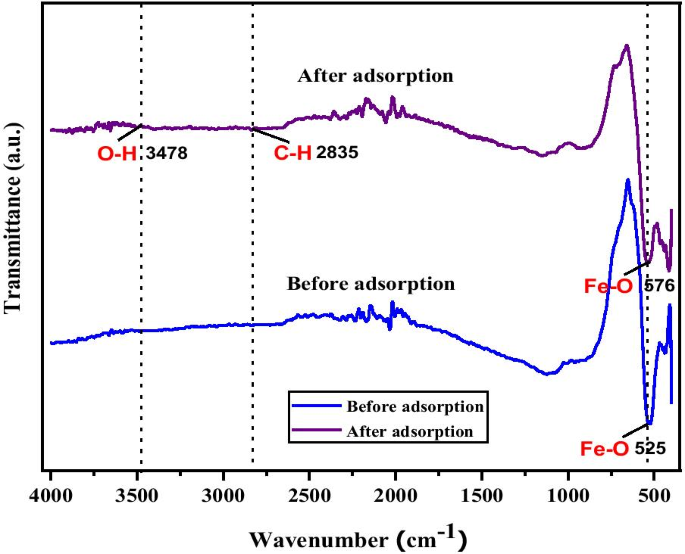
Los espectros infrarrojos por transformada de Fourier de MNA-7 h antes y después de la adsorción del ion Cu (II)
Análisis de potencial Zeta
La Figura 9 muestra el potencial zeta de superficie de MNA-7 h. Se investigó el potencial Zeta para obtener una determinación precisa y precisa de la carga de neutralización producida en el proceso de adsorción. Los datos del potencial Zeta proporcionan un valor medible para monitorear la dosis óptima de adsorbente durante el proceso de adsorción de Cu. Los resultados muestran que el punto isoeléctrico (pH pzc ) ocurrió a pH 5,4, el punto en el que Cu 2+ la adsorción sobre MNA que se produjo es óptima. En una solución acuosa, la superficie de los óxidos de hierro se cubre con OH - grupo, de modo que el FeOH en la superficie podría cambiar a otros grupos funcionales Fe como FeO o FeOH 2 , debido al proceso de protonación o desprotonación [70, 71]. El equilibrio de protonación y desprotonación depende del pH de la solución y del pH pzc del absorbente. Los resultados del potencial zeta sugieren que la adsorción fue eficaz a un pH de 5,4.
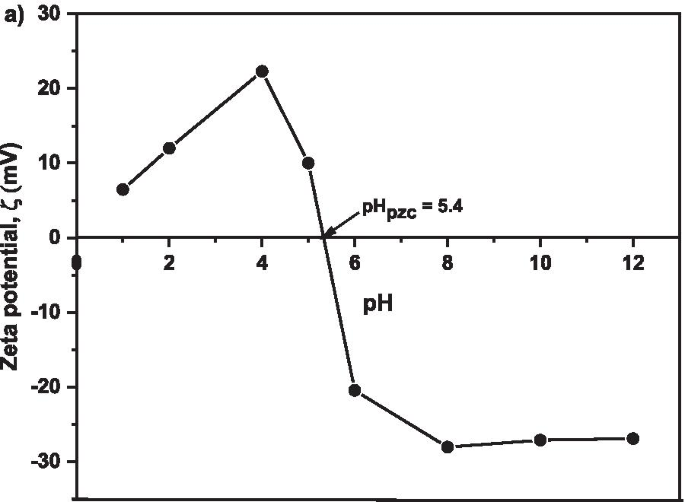
Potencial zeta para valores de pH de 1, 2, 4, 6, 8, 10 y 12 para MNA-7 h
Análisis de adsorción por lotes
Efecto del tiempo de contacto
Figure 10a shows the effect of contact time on adsorption capacity and rate of Cu 2+ uptake onto MNA after 250 min. It is evident that at longer contact time, the adsorption capacity reach equilibrium as the pH was kept at 5.4 and adsorbent dosage at 0.05 g. The maximum removal efficiency attained was 62.61% as shown in Fig. 10b. The Cu 2+ removal efficiency surges rapidly from the early first 5 min, and later slower and stable throughout the adsorption process. This is attributed to the fact that the rate of the adsorption capacity was high due to the abundant free binding and active sites of the Cu 2+ . Based on Fig. 10, it was noticed that the percentage removal and adsorption capacity increased rapidly with the increase in contact time at the initial stage. The contact time has a substantial influence on the efficacy of Cu 2+ removal and adsorption capacity. Increase in contact time from 0 to 240 min led to an increase in the removal efficiency of Cu 2+ from 0.81% to 62.61%. For contact time greater than 120 min, the removal efficiency of Cu 2+ remains steady, as the active sites has been saturated on the surface of the adsorbent. Similarly, the highest adsorption capacity of 4.41 mg/g was attained at 120 min of contact time. Thus, the equilibrium time was attained at 120 min.
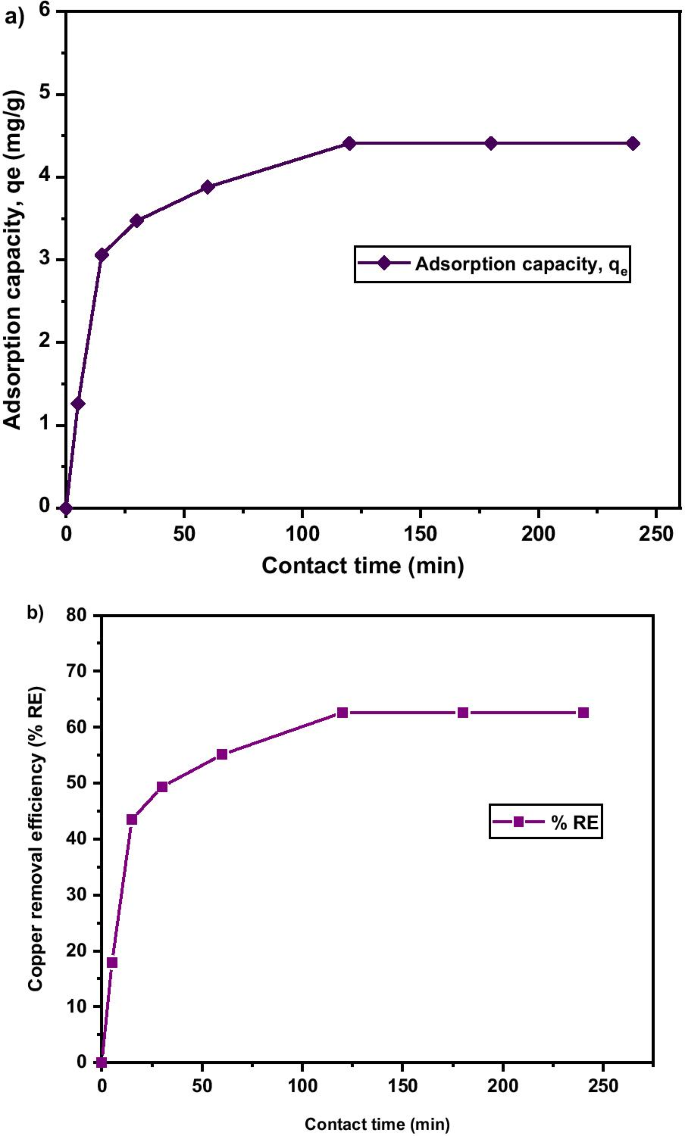
un Adsorption capacity; b Copper removal efficiency under various contact times of MNA-7 h (metal solution:200 mL; temperature:25 °C; initial pH:5.4; initial concentration:50 mg/L; adsorbent dosage:0.05 g)
The results of copper removal efficiency follow a definite trend (Table 2). It shows that the higher the time, the more the removal efficiency. There were significant differences (p < 0.05) among the removal efficiencies under varying contact times. Generally, as contact time progresses, the removal efficacy also improves. Table 3 shows the percentage of the copper removal at different adsorbent dosages. The result shows that as the time progresses, the removal percentage increases. 0.05 g adsorbent dosage recorded the highest copper removal efficiency (62.58 g) after 120 min contact time.
Effect of Initial Concentration
Figure 11 shows as the initial concentration increases, the equilibrium adsorption capacity also increases. Thus, the higher initial concentration due to 0.05 g adsorbent in the Cu 2+ solution to fill the active sites on the adsorbent and the quantity of copper adsorbed increases with the increase in Cu 2+ concentration [83]. The initial concentration of Cu 2+ increased from 10 mg/L to 50 mg/L with corresponding increase in adsorption capacity from 0.04 mg/g to 4.41 mg/g, which in turn provide a higher driving force for the ions from the solution to the adsorbents, resulting in more collisions between Cu 2+ and active sites on the MNA-7 h. Since nearly all the adsorption sites of MNA-7 h existed on their exterior, it is easy for the adsorbate to access these active sites, thereby facilitating a rapid attainment of equilibrium condition.
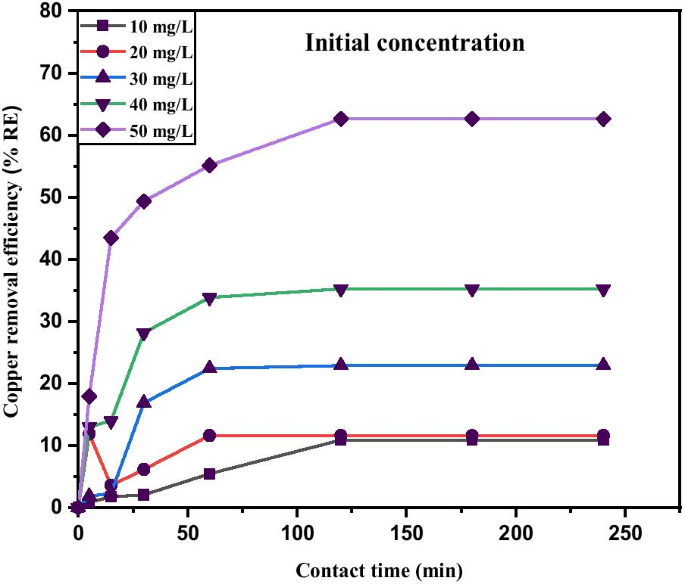
Copper removal efficiency under various initial concentration of MNA-7 h (metal solution:200 mL; temperature:25 °C; initial pH:5.4; adsorbent dosage:0.05 g)
Effect of MNA Dosage
Adsorbent dosage plays an important role during the adsorption process, as it controls the ability of the adsorbent for a given solution. The more the dosage, the more obtainable site for sorption to occur [67]. Figure 12a shows the adsorption capacity, q e of Cu 2+ with respect to different dosages of MNA-7 h at 0.05 g, 0.2 g, 0.5 g, and 0.8 g, respectively. The adsorption capacity was observed to be dependent on adsorbent dosage, which determines the availability of the active sites and the amount of the surface area for adsorption. This is due to the increase in surface area and the probability of collision and interaction between the particles of nano-adsorbent and Cu 2+ [72]. As shown in Fig. 12b, at 0.05 g dosage, 62.61% copper removal efficiency and 4.41 mg/g of adsorption capacity were recorded. The Cu 2+ removal increases sharply and becomes stable as the adsorbent dosage increases. As the adsorbent dosage increases, the larger surface interaction and the agglomeration effects develop. Thus, it causes a decrease in free specific area per unit mass of MNA surface, causing a reduction in contact surface with the adsorbate surface. This will lead to the decrease in q e and %RE. Besides, the decrease in q e and %RE , perhaps was due to the saturation of Cu 2+ in solution with respect to available adsorption binding sites [73]. Thus, a higher amount of adsorbent causes an aggregation which decreases the total surface area of the MNA, thereby leading to a decrease in adsorption capacity [74–76]. The aggregation could result to a decrease in total surface area of the adsorbent and an increase in diffusion path length [75].

un Adsorption capacity; b Copper removal efficiency under various adsorbent dosage of MNA-7 h (metal solution:200 mL; initial concentration:50 mg/L; temperature:25 °C; initial pH:5.4)
Effect of pH
The removal of Cu 2+ from the aqueous solution through adsorption is highly dependent on the solution pH which determines the surface charge of the adsorbent and the adsorbate speciation [77]. Adsorption is regarded to be minimal at acidic state owing to higher concentration of H3 O + which competes with the positively charged ions for the actively binding site on the adsorbent surface, and this usually led to low contaminant removal [77, 78]. The influence of pH on the adsorption of Cu 2+ on MNA was evaluated between the pH range of (2–12). Figure 13 shows the effect of pH on the adsorption capacity and removal efficiency of Cu 2+ . It was observed that increase in pH from 2 to 5.4, results in an increase in adsorption capacity from 0.58 mg/g to 4.408 mg/g and percentage removal of copper from 10.71% to 62.61%, respectively. However, the equilibrium adsorption capacity of Cu 2+ is low at a strong acidic condition recording 0.58 mg/g at pH 2 due to the presence of a high percentage of H3 O + ion which competes with Cu 2+ at the sorption sites of MNA. Besides, when pH is higher than 5.4, the adsorption capacity decreases from 49.32% to 44.69%. At a higher pH, higher concentration of OH − causes a decrease in the adsorption rate. Figure 13a and b shows that pH has a significant impact on Cu 2+ adsorption capacity and removal percentage (%RE ) of Cu. The removal rate for Cu 2+ increases with an increase in pH, from 10.71% to 28.04% and to 62.61% when pH is at 2, 4 and 5.4, respectively, before declining to 49.32%, 42.56% and 44.69 at pH 8, 10 and 12, respectively (Fig. 13a).
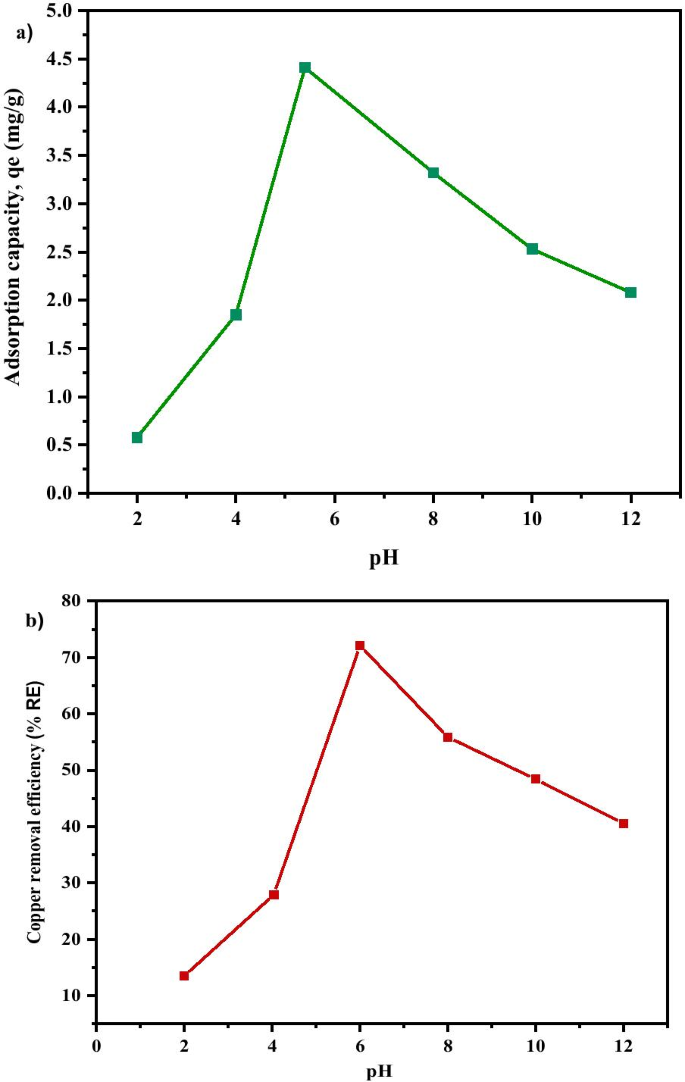
un Adsorption capacity; b copper removal efficiency under various pH of MNA-7 h (metal solution:200 mL; initial concentration:50 mg/L; temperature:25 °C; adsorbent MNA dosage:0.05 g)
Similarly, the adsorption capacity also increases from 10.71% to 62.61% with the increase in pH from 2 to 5.4 and decreases until it reaches pH 12. At pH 2 and 4, the amount of protonation of the adsorbent surfaces results in a decrease in Cu 2+ adsorption. The results also are in agreement with zeta potential graph as indicated in Fig. 9. Also, Fig. 9 describes the net charge of the MNA adsorbent surface at different pHs, with the point of zero charges (pHpzc ). As the pH increases, the H + ion is lower and causes the surface of the adsorbent to become negatively charged, with the increase in %RE of Cu 2+ , thereby increasing the electrostatic attraction force between the adsorbents in the solution [79]. Therefore, pH influences the surface zeta potential of MNA. The surface functionality of iron oxides varies depending on the nature of iron oxides and the pH value.
Copper Adsorption Kinetics
Kinetic studies are essential in the adsorption process to describe the uptake rate performance of MNA-7 h and influence the residual time for the entire adsorption process. The adsorption kinetics of Cu 2+ on MNA-7 h was determined using similar procedures to those used in the batch adsorption studies [55]. The Lagergren’s first-order kinetic model and second-order kinetic model for the removal of Cu 2+ at various initial concentrations from the aqueous solution using MNA at 0.05 g/L of the MNA dosage are shown in Fig. 14. The calculated q e values are in agreement with the theoretical values, and the graph shows good linearity with R 2 above 0.96. Therefore, the adsorption kinetics follows the pseudo-second-order model. The pseudo-second-order model represents the adsorption kinetics, involving donation or electron exchange between adsorbate and adsorbent. Table 4 shows the fitted parameter summary of Cu 2+ kinetics at different initial Cu 2+ concentrations (q e :mg/g, k 1 :min −1 , k 2 :g/mg/min) of MNA-7 h. For the parameters of initial concentration, C i (mg/L), adsorption capacity, q e (mg.g −1 ), k 2 is the rate constant of pseudo-first-order, k 2 is rate constant of pseudo-second-order, and the R 2 is the correlation coefficient. Two kinetic models:Lagergren’s first-order and pseudo-second-order order were applied to further study the rate of adsorption process for Cu 2+ . The kinetic parameters of pseudo-first-order and pseudo-second-order are presented in Table 4. According to Table 4, pseudo-second-order was best fitted for the adsorption of Cu 2+ . Pseudo-second-order revealed a higher correlation coefficient of R 2 = 0.999, for Cu 2+ removal.
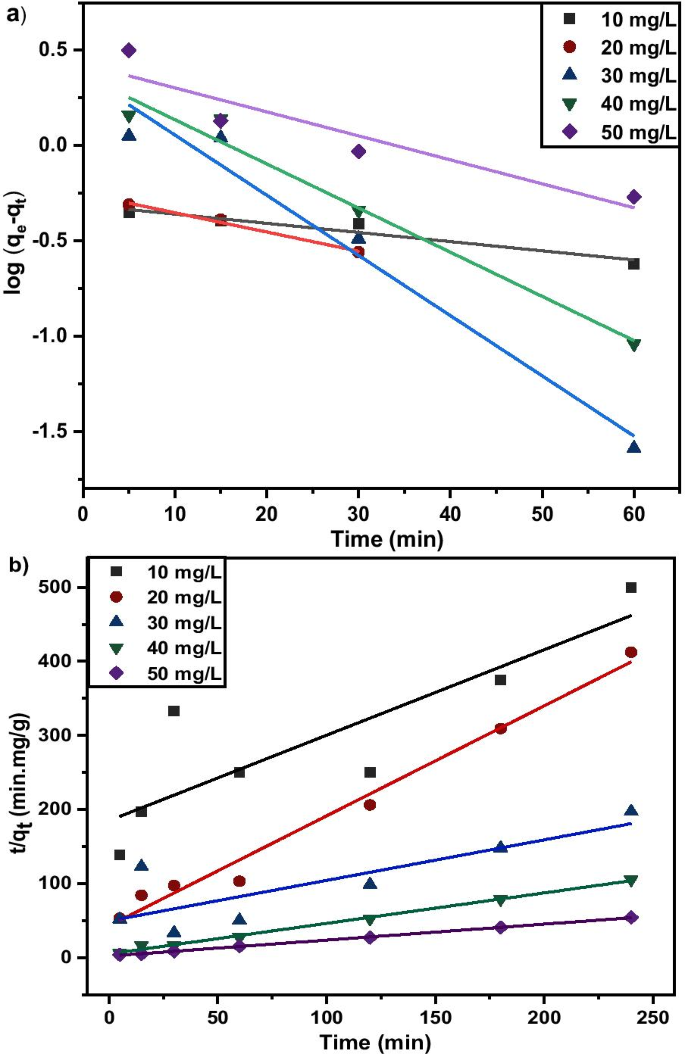
un Lagergren’s first-order kinetic model; b Pseudo-second-order kinetic model for the removal of Cu (II) ions at various initial concentrations from the aqueous solution using MNA at 0.05 g/L dosage of MNA-7 h
Copper Adsorption Isotherms
The adsorption isotherms experimental data were investigated using Freundlich isotherm model (Eq. 7) and Temkin isotherm model (Eq. 8). The adsorption isotherm is illustrated in Fig. 15a and b. The Freundlich isotherm is expressed as:
$$q_{e =} K_{F} \times C_{e}^{1/n}$$ (7) $$qe =B\log kt + B\log C_{e}$$ (8)where q e is adsorbent capacity at equilibrium (mg/g); B :(RT /b ) is the Temkin constant related to heat of adsorption (J/mol) R is universal gas constant (8.314 J/mol K); T is absolute temperature (K); 1/b indicates the adsorption potential of the adsorbent; kt is equilibrium binding constant corresponding to the maximum binding energy (L/mg); and Ce is adsorbate concentration at equilibrium (mg/L). From the graph, the straight line emerged, and the values of q m and K L constants can be calculated using the slope and the intercept of the straight line. Freundlich and Temkin models was used to examine the relationship between the adsorbent and adsorbate. As shown in Fig. 15, the initial concentrate correlation coefficient with an R 2 value of 0.914 and manifested Temkin adsorption isotherm to be more favourable for the removal of copper. The synopsis of the isotherm parameter of Freundlich, Temkin parameter with correlation coefficient, R 2 for adsorption of Cu (II) on MNA-7 h at room temperature is depicted in Table 5. 1/n constant reciprocal implies natural sorption; therefore, the adsorption process is beneficial. The values of n, 1/n , K F , and R 2 for the current work are also presented in Table 5. Temkin isotherm adsorption plot shows maximum Cu 2+ removal by MNA-7 h at optimal conditions and reveals the feasibility of the process. The data prove that the Temkin model well fitted the experimental data than Freundlich based on the correlation coefficient, R 2 (Cuadro 5). This could be due to the fact that the Temkin isotherm model considers the effect of indirect adsorbate on the adsorption process and assumes that the heat of the adsorption of molecules decreases linearly in the adsorption layer [80].
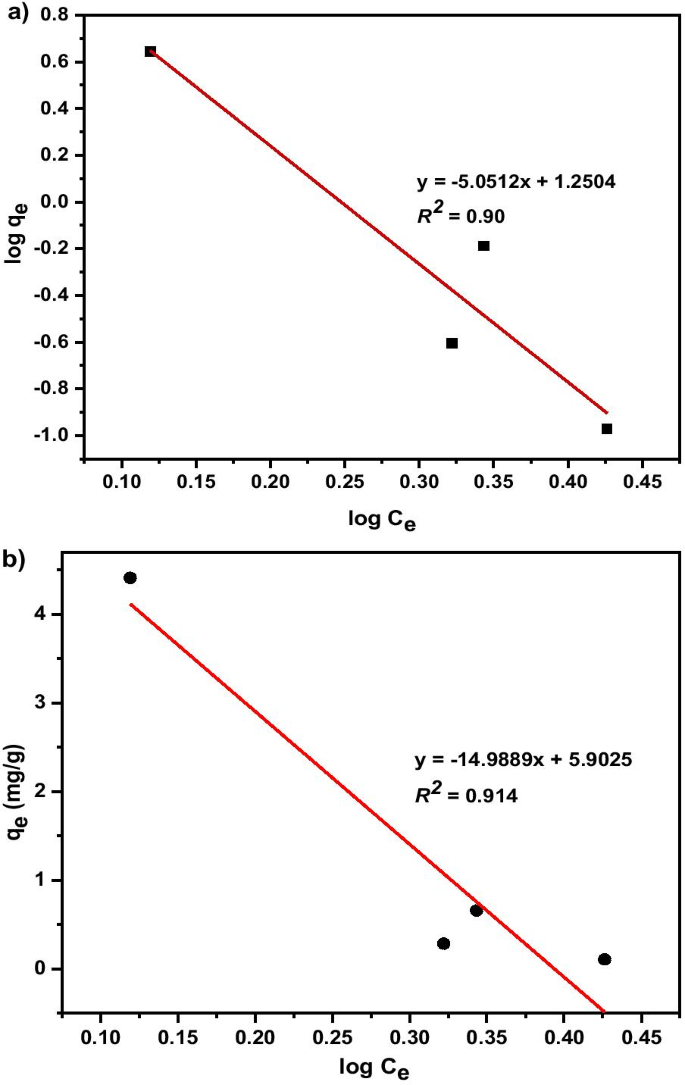
un Linearized Freundlich; b Linearized Temkin isotherm models for Cu 2+ adsorption by MNA-7 h at various adsorbent dosages:contact time 240 min; initial pH 5.4; room temperature
Regeneration and Desorption Study
The reusability of adsorbent is a prime issue since periodically regenerating adsorbent is strongly desirable for industrial applications [81]. In the reusability tests, the adsorption and desorption cycle of Cu 2+ onto MNA was repeated three times. The adsorption capacity of MNA was recycled, and the regeneration of the MNA of the adsorption–desorption cycle of Cu 2+ was repeated three times using the same MNA. The desorption process was studied for 3 cycles of MNA-7 h. The results proved that the magnetic nanoparticles have higher sustainability for industrial applications. The results also revealed that Cu 2+ could be desorbed from the adsorbent in the presence of deionized water as the desorbing agent. For repeated use of MNA, the adsorbed Cu 2+ were desorbed under suitable conditions. In this work, the percentage of desorption by MNA was obtained by 0.1 M HCl as shown in Table 6. Hence, MNA exhibits an enhanced recovery efficiency of 70.87%. Figure 16 displays the desorption efficiency of MNA. The adsorption capacity decreased by 10% during three adsorption–desorption cycles which indicates the stability and reusability of MNA.
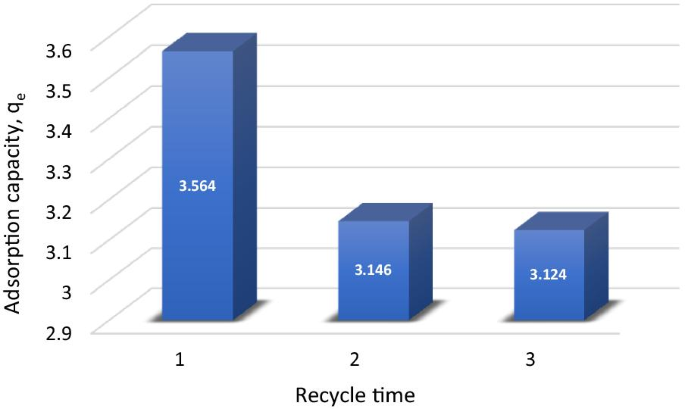
Desorption of copper onto MNA-7 h in three cycles
Conclusions
Novel magnetite nano adsorbent (MNA) from mill scale waste has been successfully synthesized via conventional milling technique and impacted by high-energy ball milling procedure at varying milling time. The high-energy ball milling (HEBM) at 3, 5 and 7 h successfully produced the MNA in the range of 10–25 nm, as confirmed by HRTEM. The HEBM technique was used to reduce the microcrystalline size to nano-sized particles showing the potentials of MNA as an efficient precursor for Cu 2+ removal in an aqueous solution.
VSM results showing the MNA-7 h possess the highest magnetization property and indicate the best absorbent, with the specific surface area of 5.98 m 2 g −1 and the average pore size of 8.01 nm thereby showing the better adsorption capacity. The adsorption of Cu 2+ on MNA-7 h was confirmed by EDS and FTIR analysis. For the adsorption studies, pH at 5.4, dosage of 0.05 g and 240 min of contact time, the highest adsorption capacity, q e and removal efficiency of 4.408 mgg −1 and 62.61% were achieved. Also, at the initial concentration of 50 mgL −1 Cu 2+ , the q e of 4.41 mgg −1 was recorded. The reusability efficiency of 70.87% was attained even after three cycles of reapplications and desorption. The Temkin adsorption isotherm fits best with a correlation coefficient, R 2 of 0.91. Based on these findings, it can be inferred that MNA is a promising precursor for Cu 2+ removal.
Availability of data and materials
The datasets generated during and/or analysed during the current study are available from the corresponding author on reasonable request.
Nanomateriales
- Síntesis biogénica, caracterización y evaluación del potencial antibacteriano de nanopartículas de óxido de cobre contra Escherichia coli
- Hidrocincita soportada por aerogel de sílice e hidrotalcita intercalada con carbonato para la eliminación de alta eficiencia de iones de Pb (II) mediante reacciones de transformación por precipitac…
- Exfoliación líquida de alta eficiencia de nanoláminas de nitruro de boro utilizando una solución acuosa de alcanolamina
- Preparación de nanoesferas poliméricas impresas con iones de paladio (II) y su eliminación del paladio (II) de la solución acuosa
- Aptitud ecológica en la síntesis y estabilización de nanopartículas de cobre:actividades catalíticas, antibacterianas, citotóxicas y antioxidantes
- Síntesis y caracterización de BiOCl modificado y su aplicación en la adsorción de tintes de baja concentración a partir de una solución acuosa
- Síntesis rápida de nanocristales de Pt y materiales de Pt / La2O3 microporosos mediante levitación acústica
- Saponinas Platycodon de Platycodi Radix (Platycodon grandiflorum) para la síntesis verde de nanopartículas de oro y plata
- Síntesis y caracterización de nanoestructuras de cobre puro utilizando la arquitectura inherente de la madera como plantilla natural
- Síntesis fácil de nanocables de cobre ultralargos y delgados y su aplicación a electrodos conductores transparentes flexibles de alto rendimiento
- Una síntesis hidrotermal de nanopartículas híbridas de Fe3O4 @ C y rendimiento de adsorción magnética para eliminar iones de metales pesados en una solución acuosa



