Actividad antibacteriana de la solución de nanopartículas de plata / quitosano preparada in situ contra cepas de Staphylococcus aureus resistentes a la meticilina
Resumen
Antecedentes
Investigación de nuevos fármacos eficaces contra las cepas de Staphylococcus resistentes a la meticilina aureus (MRSA) es un problema urgente de la medicina moderna. Los antisépticos como alternativa a los antibióticos son preparaciones fuertes, sostenidas y activas contra cepas resistentes y no violan la microbiocenosis.
Materiales y métodos
La actividad de la solución de nanopartículas de quitosano-Ag preparada in situ (Ag NP) con diferentes proporciones de componentes se probó contra MRSA aislado de pacientes. Las NP de Ag se sintetizaron mediante un método de reducción química utilizando un enfoque de química verde. Para mejorar la actividad antimicrobiana y la dispersabilidad de las NP de Ag, se realizó la modificación de la superficie de las NP de Ag con bromuro de cetrimonio (CTAB).
Las NP de Ag y la solución de NP de quitosano-Ag se caracterizaron mediante difracción de rayos X, microscopía electrónica de transmisión, espectroscopía infrarroja y mediciones espectrofotométricas.
Resultados y conclusiones
Los resultados de las mediciones de XRD, FTIR, UV-Vis y TEM confirmaron la composición química del quitosano y los NP de Ag y su alta pureza.
Las soluciones de quitosano-AgNP han demostrado su eficacia antimicrobiana superior en comparación con sus formas puras. Al mismo tiempo, la preparación in situ de la solución de NP de quitosano-Ag (polvo de quitosano 6,0 µg / ml, NP de Ag / CTAB) no fue posible debido a la precipitación de los componentes. Este resultado es muy prometedor y puede considerarse como una solución eficaz en la lucha contra las bacterias resistentes a los medicamentos.
Antecedentes
Las infecciones siguen siendo una de las principales causas de morbilidad y mortalidad en todo el mundo a pesar de la presencia de un número significativo de antibióticos y antisépticos. En infecciones moderadas y graves, la terapia con antibióticos suele iniciarse de forma empírica antes de obtener los resultados del examen bacteriológico. El uso constante de antibióticos creó condiciones favorables para la selección y multiplicación de microorganismos resistentes a los antibióticos [22]. Actualmente se documenta una alta prevalencia de multirresistencia a agentes de todos los procesos infecciosos [6]. La bacteria resistente a múltiples fármacos más notoria es Staphylococcus aureus resistente a la meticilina. (MRSA) [9]. El patógeno es responsable de un amplio espectro de enfermedades humanas y animales que van desde infecciones de la piel hasta trastornos tan graves como neumonía, endocarditis y septicemia, y estas infecciones pueden afectar la salud humana [32]. El análisis de las causas etiológicas de las infecciones en pacientes con una terapia inadecuada reveló que la terapia fue inadecuada en el 32,6% de los casos de infecciones por SARM [12] y se asoció con 3.000 a 4.000 millones de dólares estadounidenses en costos anuales de atención médica [32].
La investigación de nuevos fármacos eficaces contra el MRSA es un tema urgente de la medicina moderna. Los antisépticos como alternativa a los antibióticos son preparaciones fuertes, sostenidas y activas contra cepas resistentes y no violan la microbiocenosis. Superar estos problemas requiere preparaciones nuevas e innovadoras. El enfoque de combinar diferentes mecanismos de acción antibacteriana mediante el diseño de nanomateriales híbridos proporciona un nuevo paradigma en la lucha contra las bacterias resistentes [18]. Los metales, como el cobre y la plata, son extremadamente tóxicos para las bacterias en concentraciones excepcionalmente bajas. Debido a la actividad biocida, los metales se han utilizado ampliamente como agentes antimicrobianos en una multitud de aplicaciones relacionadas con la agricultura, la salud y la industria en general. A diferencia de otros agentes antimicrobianos, los metales son estables en las condiciones que se encuentran actualmente en la industria, lo que permite su uso como aditivos [19].
Las propiedades antimicrobianas de la plata se conocen desde la antigüedad, y la creciente resistencia a los antibióticos de las bacterias y la ineficacia de los antibióticos sintéticos contra algunas cepas bacterianas han llevado al resurgimiento del interés por la plata, las sales de plata, los compuestos de plata y la plata nanocristalina como agentes antibacterianos. Las nanopartículas de plata (Ag NP) tienen un efecto antibacteriano y antifúngico significativo [26]. Los NP de Ag muestran sinergismo con otros antibióticos y antisépticos (ceftazidima, estreptomicina, kanamicina, polimixina) [25, 38]. Pero J. Jains demostró que el cloranfenicol disminuye el efecto antibacteriano de la solución de NP de Ag [16].
Las principales desventajas que limitan el uso de Ag NP son su fácil agregación, la liberación incontrolada de iones de plata y su potencial de citotoxicidad [40]. La combinación de NP de Ag con agentes naturales, como quitosano, propóleo, arcillas o zeolitas [33, 35], proporciona efectos adicionales. La combinación de polímeros y nanoplata puede mejorar sinérgicamente sus efectos antimicrobianos, y el uso de métodos de síntesis in situ permite su incorporación a la matriz del polímero logrando distribuciones uniformes y evitando la agregación [28].
En los últimos años, la eficiencia de los métodos de química verde para la síntesis de NP metálicas ha aumentado significativamente [1]. Los extractos de plantas se utilizan a menudo como agentes reductores, estabilizantes y de cobertura [23], lo que proporciona métodos rentables y ambientalmente benignos para la síntesis de NP. Entre los extractos de plantas, el extracto de jengibre es de gran interés científico gracias a sus propiedades químicas y biológicas [8]. El extracto de hoja de jengibre ya se ha utilizado para la síntesis de NP de plata [37]; sin embargo, las partículas producidas tenían una distribución de tamaño de partícula bastante amplia (10-100 nm). El rizoma de jengibre se usa ampliamente como especia y medicina popular; su extracto contiene compuestos fenólicos específicos:gingerol y sus derivados, una serie de constituyentes fenólicos y no fenólicos bioactivos [31]. Estos compuestos exhiben un amplio espectro de actividades, incluidas las antimicrobianas, antifúngicas y antivirales. El extracto de rizoma de jengibre parece ser un sustrato muy prometedor para el desarrollo de nanopartículas bioactivas y biocompatibles, ya que también presenta propiedades antioxidantes y antiinflamatorias.
La quitina y el quitosano son materiales prometedores para aplicaciones médicas debido a sus propiedades bacteriostáticas / bactericidas y biocompatibilidad con los tejidos humanos [20]. El quitosano es un derivado de la quitina, que se puede obtener mediante desacetilación de la quitina. Ambos contienen los mismos monómeros, N -acetil-2-amino-2-desoxi-D-glucopiranosa y 2-amino-2-desoxi-D-glucopiranosa, que difieren en la proporción de monómeros acetilados y desacetilados. El quitosano es un material prometedor para formar compuestos con diferentes sustancias, incluidas nanopartículas metálicas como Ag y Cu [33]. Por otro lado, el bromuro de cetrimonio (CTAB) puede estabilizar nanopartículas en solución y disminuir la toxicidad de algunas nanopartículas, como ZnO, TiO2 y Ni [17]. Pero los datos sobre las actividades antibacterianas del complejo CTAB-NP son limitados [7].
El propósito de esta investigación es encontrar la proporción óptima de NP de quitosano y Ag, modificada por CTAB para la composición de la solución (quitosano / Ag) que sería activa contra las cepas clínicas de MRSA.
Métodos
Materiales
Nitrato de plata, ácido L-ascórbico y bromuro de cetrimonio (C 16 H 33 ) N (CH 3 ) 3 Br (CTAB) se adquirieron de Sigma-Aldrich y se usaron tal como se recibieron. Jengibre ( Zingiber officinale , Zingiber acae ) El rizoma se compró en un supermercado local (Poznan, Polonia). Se compró quitosano de 200 kDa, grado de desacetilación 82% de CJSC “Bioprogress” (Rusia, Moscú) y se usó sin purificación adicional. Agua ultrapura (resistividad> 17 MΩcm - 1 ) de un sistema de agua GZY-P10 se utilizó a lo largo de los experimentos. Todos los medios y discos con antibióticos se compraron en Hi Media (India).
Preparación in situ de soluciones NP de quitosano / Ag
Para preparar las soluciones de quitosano / Ag in situ, al principio se sintetizaron y modificaron NP de Ag.
Síntesis de NP de Ag
Las NP de Ag se sintetizaron mediante un método de reducción química utilizando un enfoque de química verde. Siguiendo este enfoque, usamos jengibre ( Zingiber officinale ) extracto como tensioactivo y ácido ascórbico (vitamina C) como agente reductor. Para preparar el extracto de rizoma de jengibre, se lavaron a fondo 250 g de rizoma con agua destilada y luego se cortaron en trozos pequeños. El rizoma de jengibre picado se mantuvo en una solución de agua-etanol (250 ml, relación 1:1) durante 5 días (a temperatura ambiente, en un lugar oscuro). Luego, el sobrenadante se filtró al vacío (a través de un papel de filtro Whatman) y se almacenó (a 4 ° C). Para sintetizar NP de Ag, se disolvió nitrato de plata (840 mg) en agua (20 ml) y se añadió extracto de rizoma de jengibre (20 ml). Luego, se añadió gota a gota una mezcla de solución de ácido L-ascórbico (10%, 10 ml) y extracto de jengibre (20 ml) a la solución de nitrato de plata bajo dirección magnética. La mezcla de reacción se volvió oscura. Luego, se calentó (60ºC, 1,5 h) a reflujo. Luego, las NP de Ag recién sintetizadas se lavaron con agua, hasta que el pH alcanzó 7, mediante centrifugación (4000 rpm, 30 min).
Con el fin de mejorar la actividad antimicrobiana y la dispersabilidad de las NP de Ag, se realizó la modificación de la superficie de las NP de Ag por CTAB, que es bien conocida por sus propiedades tensioactivas y antisépticas [17]. Normalmente, la dispersión de NP de Ag (3 ml, 76,4 mg / ml) se mezcló con una solución de CTAB (20 ml, 6,7 mg / ml) y se sonicó (3 h). Luego, se recogió el sobrenadante para las mediciones de UV-Vis y las NP de Ag se lavaron con agua, mediante centrifugación (4000 rpm, 30 min), tres veces. El contenido de CTAB en el sobrenadante se determinó mediante la técnica espectrofotométrica (UV-Vis) controlando la intensidad del pico de 190 nm. La adsorción de Ag NP (en mg / g) hacia CTAB se calculó a partir de la diferencia entre el contenido inicial de CTAB en la solución y su contenido en el sobrenadante después de la interacción con la muestra. La adsorción y el contenido de carga de CTAB se calcularon a partir de las siguientes ecuaciones:
Adsortividad (mg / g) =(peso de CTAB en solución - peso de CTAB en sobrenadante) / (peso de NP de Ag),
Contenido de carga de CTAB (%) =(1 - (peso de NP de Ag) / (peso de NP de Ag cargado de CTAB)) × 100%.
Preparación in situ de soluciones NP de quitosano / Ag
Para obtener soluciones de quitosano / Ag NPs, se disolvió quitosano de 200 kDa (1 g) en ácido acético al 2% (100 ml) a temperatura ambiente durante 24 h para formar una solución de quitosano al 1%. Se utilizaron dos muestras de NP de Ag en los experimentos:NP de Ag puro y NP de Ag-CTAB.
Caracterización fisicoquímica de NP de Ag y quitosano
Los estudios de difracción de rayos X en polvo (XRD) se realizaron en un difractómetro Empyrean (PANalytical), utilizando radiación Cu Kα (1,54 Å), un rotor de transmisión de reflexión (etapa de muestra) y un detector PIXcel 3D, que opera en la geometría de Bragg-Brentano. . Los escaneos 2Theta se registraron a temperatura ambiente en ángulos que van desde 10 ° a 95 ° con un tamaño de paso de 0,007 °, en modo de escaneo continuo.
Las mediciones de microscopía electrónica de transmisión (TEM) se realizaron utilizando un microscopio electrónico de transmisión JEM-ARM-200F que opera a un voltaje de aceleración de 200 kV.
Los espectros de infrarrojos se obtuvieron utilizando un espectrómetro Tensor 27 (Bruker Optics) equipado con una fuente global y un detector MCT. Las muestras se prepararon usando bromuro de potasio como material de matriz y se mezclaron en proporciones de 1 mg de muestra a 200 mg de KBr. Los gránulos se prepararon utilizando la técnica estándar bajo una presión de 10 ton / cm 2 con un cañón de 16 mm de diámetro. Las medidas se realizaron a temperatura ambiente. Para cada espectro, 512 exploraciones en el rango espectral de 4000 a 400 cm - 1 se tomaron con una resolución de 4 cm - 1. Los datos se procesaron utilizando el paquete de software Opus.
Las mediciones espectrofotométricas (UV-Vis) se realizaron utilizando el espectrómetro UV / VIS / NIR Lambda 950 (Perkin Elmer) a longitudes de onda de 200 a 800 nm con agua como solución de referencia.
Pruebas microbiológicas
Cultivo bacteriano
Se recogieron cultivos bacterianos de la región del meato nasal medio y de la garganta de los 70 pacientes hospitalizados mediante el uso de hisopos de alambre con punta de algodón estériles. Las muestras se transportaron inmediatamente al laboratorio en medio de transporte y luego se inocularon en agar sangre. Los cultivos bacterianos se identificaron morfológica y bioquímicamente mediante procedimientos estándar de laboratorio de acuerdo con el Manual de Métodos para Bacteriología General en el laboratorio bacteriológico de la Universidad Estatal de Sumy. Aislamos 50 Staphylococcus aureus son. Cada cultivo se sometió a tinción de Gram y se evaluó la producción de catalasa, coagulasa libre, pigmento amarillo, fermentación de manitol, crecimiento en alta concentración de sal y producción de lipasa en medio de agar con yema de huevo (Hi Media, Mumbai).
Prueba de susceptibilidad antimicrobiana
Se realizaron pruebas de susceptibilidad a los antibióticos en todas las S . aureus aislamientos para determinar sus perfiles de resistencia a los antibióticos. Se utilizó el método de difusión en disco de Kirby-Bauer para evaluar la susceptibilidad a los antibióticos de los aislamientos. Se realizaron pruebas de sensibilidad a los antimicrobianos en agar Muller-Hinton frente a azitromicina, levofloxacina, claritromicina, ciprofloxacina y meticilina (Comité Nacional de Estándares de Laboratorio Clínico, 1999). Se prepararon y usaron cultivos frescos durante la noche en las pruebas. Cepa estándar de S . aureus Se utilizó ATCC 25923 como control. Se esparció una alícuota (100 μl) de cada suspensión aislada en placas de agar Mueller Hinton. Los discos de antibióticos se presionaron suavemente sobre el agar Mueller Hinton inoculado para asegurar un contacto íntimo con la superficie, y las placas se incubaron aeróbicamente a 37 ° C durante 18-24 h. Se midieron los diámetros de la zona de inhibición. Las cepas clínicas se clasificaron como susceptibles y resistentes según los criterios de evaluación desarrollados por las directrices del Clinical and Laboratory Standards Institute (CLSI) [24]. Las cepas de Staphylococcus aureus que resultaron resistentes a la meticilina se analizaron como MRSA.
Determinación de concentraciones inhibitorias mínimas de soluciones NP de quitosano-Ag
Las actividades antimicrobianas de la solución de quitosano, las NP de Ag y las soluciones de NP de quitosano-Ag se determinaron de acuerdo con las recomendaciones de NCCLS (1999) mediante el uso de un método de macrodilución en caldo. Determinamos la concentración inhibitoria mínima (MIC) para las soluciones de prueba contra cada Staphylococcus aureus resistente a la meticilina. (un total de 10 cepas de MRSA). El tubo con la concentración más baja que inhibe completamente el crecimiento visual de bacterias (sin turbidez) se consideró como MIC.
Brevemente, al principio, se prepararon siete concentraciones de NP de Ag puras y NP de Ag / CTAB utilizando caldo nutritivo con el método de dilución en serie de 2 veces. Había tres filas idénticas de cada tipo de dilución de Ag NP. Luego, en cada tubo de cada fila, agregamos 1, 2 o 3 ml de solución de quitosano al 1%. La concentración final de quitosano y Ag NP en los tubos probados se muestra en la Tabla 1.
Las cepas bacterianas de prueba se cultivaron en un caldo apropiado, se lavaron una vez en solución salina estéril y se diluyeron en agua destilada. La concentración bacteriana se estandarizó a una densidad óptica de 0,08 a 600 nm (aproximadamente 1,5 × 10 8 UFC / mL) utilizando la escala de McFarland. Luego, 100 μl de S . aureus La suspensión se inoculó en tubos con NP de Ag, solución de quitosano y solución de NP de Ag-quitosano. Se utilizaron como controles tubos que contenían medio de cultivo y muestras analizadas sin inóculos. Todos los tubos se incubaron aeróbicamente a 37 ° C durante 24 h. Todas las medidas fueron triplicadas.
Resultados
Caracterización de NP de Ag y quitosano usados para la preparación de soluciones in situ
Una parte de las NP de Ag sintetizadas fue modificada por CTAB (NP de Ag / CTAB) (con el fin de mejorar la bioactividad y la estabilidad de las dispersiones de NP de Ag). Se encontró que la adsortividad de Ag NP hacia CTAB era de 70,0 mg / g, lo que corresponde al contenido de CTAB en la muestra de aproximadamente 6,54%.
Los resultados de las mediciones de XRD de Ag NPs mostraron la presencia de cuatro picos agudos a 38.15, 44.33, 64.48, 77.47 y 81.54 ° 2Theta (Fig. 1a). De acuerdo con la Base de Datos de Estructura Cristalina Mineralogista Estadounidense (AMCSD) [5], estos picos se atribuyeron a la plata. El pico ancho entre 12.00-21.06 ° 2Theta puede atribuirse a compuestos orgánicos que se originaron a partir de la síntesis (ácido L-ascórbico y jengibre). El patrón XRD del quitosano (Fig. 1a, recuadro) exhibe picos de difracción a aproximadamente 9 y 20 ° 2Theta, que son huellas dactilares típicas del quitosano semicristalino [5]. La cristalinidad del quitosano se genera a partir de enlaces de hidrógeno entre el hidroxilo correspondiente y N -grupos acetilo. Cada pico cristalino caracteriza la estructura cristalográfica, que se genera a partir de alineaciones paralelas y antiparalelas de cadenas o láminas poliméricas. El quitosano semicristalino tiene regiones amorfas y cristalinas.
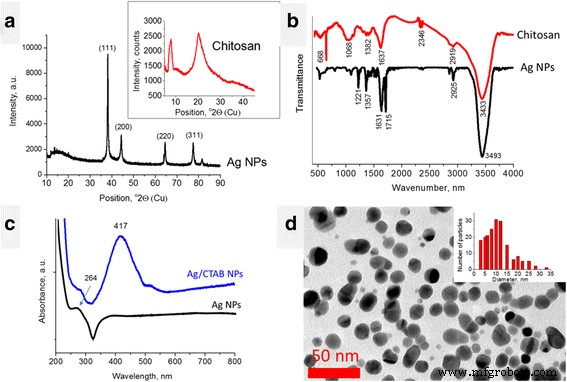
Caracterización de NP de Ag y quitosano. un Patrones XRD, b Espectros FTIR, c Espectro de absorbancia UV-Vis de Ag NP (agua), d Imagen TEM de Ag NPs
Los espectros FTIR de quitosano y Ag NP se muestran en la Fig. 1b. El espectro del quitosano muestra bandas amplias e intensas a 3450–3200 cm - 1 (vibraciones de estiramiento de OH con enlaces de hidrógeno) superpuestas con bandas de estiramiento de NH, banda de estiramiento de CH a 2783 cm - 1 y la banda para amida I a 1652 cm - 1 (Figura 1b). Las vibraciones de flexión de los grupos metileno y metilo también son visibles en ν =1375 cm - 1 y ν =1426 cm - 1 , respectivamente. Absorción en el rango de 1160 a 1000 cm - 1 se ha atribuido a vibraciones del grupo CO. La banda ubicada cerca de ν =1150 cm - 1 está relacionado con las vibraciones asimétricas de CO en el puente de oxígeno resultantes de la desacetilación del quitosano. Las bandas cercanas a 1080-1025 cm - 1 se atribuyen a ν CO del anillo COH, COC y CH 2 OH. El pico pequeño a ~ 890 cm - 1 corresponde al movimiento de la estructura sacárido del quitosano [11, 13].
El espectro FTIR de Ag NPs reveló varios picos intensivos a 1226, 1366, 1636, 1714, 2851, 2924 y 3438 cm - 1 . Estos últimos se atribuyeron a los grupos OH unidos a H. Los picos a 1226 y 1366 cm - 1 se deben a vibraciones de flexión de CO y CH; pico doble a 1636 y 1714 cm - 1 señalan la presencia de grupos C =C y C =O (vibraciones de estiramiento). Los picos a 2851 y 2924 cm - 1 están relacionados con las vibraciones de estiramiento del CH [13]. La presencia de grupos orgánicos en la superficie de los Ag NP se debe a los compuestos orgánicos utilizados para su síntesis, ácido L-ascórbico y jengibre, cuyos espectros FTIR son conocidos [10]. Si comparamos los espectros de este último con el de Ag NP, se puede notar que el doble pico en 1636 y 1714 cm - 1 es inherente al espectro del ácido L-ascórbico y desplazado al azul. Los picos de jengibre más intensos situados entre 1000 y 1200 cm - 1 (Vibraciones COC) no se expresan intensamente en el espectro Ag NPs. Por lo tanto, el ácido L-ascórbico juega el papel predominante en la reducción de iones de plata, transfiriendo dos electrones y transformándose en ácido deshidroascórbico [29]. El desplazamiento hacia el azul de la posición del pico del ácido L-ascórbico da una evidencia del enlace químico de esta molécula en la superficie de las NP de Ag.
El espectro de absorbancia UV-Vis de los Ag NP dispersos en agua (Fig. 1c) reveló el pico asimétrico a aproximadamente 387 nm. El pico dentro de 387-420 nm se conoce como el pico característico de las NP de Ag y generalmente se atribuye al efecto de resonancia del plasmón superficial [30]. La asimetría de este pico (meseta) puede atribuirse a la rápida precipitación de NP de Ag. El pico a aproximadamente 264 nm también se conoce para Ag NP y generalmente está relacionado con la transición de electrones a estados de mayor energía que se ejecutan en Ag NP [38]. Por otro lado, el espectro UV-Vis del ácido L-ascórbico también reveló un pico a 255 nm [4]. Por lo tanto, el pico a 264 nm en el espectro de NP de Ag puede considerarse como un pico desplazado al rojo de ácido L-ascórbico que confirma la presencia de estas moléculas unidas químicamente en la superficie de NP de Ag.
Es interesante que el espectro UV-Vis de Ag / CTAB NPs (Fig. 1c, línea azul) reveló un pico simétrico a 417 nm. Esto confirmó que la estabilidad de las NP de Ag en agua mejoró debido a la modificación de la superficie por las moléculas de CTAB.
Las mediciones de TEM revelaron que las NP de Ag tienen forma redondeada y la mayoría de ellas tienen un tamaño de 10 a 12 nm (Fig. 1d).
Actividades antibacterianas de las soluciones NP de quitosano / Ag preparadas in situ contra cepas de Staphylococcus aureus resistentes a la meticilina
La CIM de las NP de Ag puras y las NP de Ag / CTAB frente al 100% de MRSA fue de 9,6 μg / ml. Las concentraciones más bajas han mostrado menores actividades (Tabla 2). La solución de quitosano demuestra actividad antibacteriana con MIC 6 μg / ml contra cepas clínicas de MRSA al 100%. Entre ellas, el 60% de las cepas tenían MIC 3.3 y 5 μg / ml de solución de quitosano.
El efecto inhibidor de la solución de NP de quitosano-Ag contra MRSA se presenta en la Fig. 2a. Se encontró que la solución de NP de quitosano-Ag mostró una eficacia antimicrobiana superior en comparación con sus formas puras. Al mismo tiempo, la preparación in situ de la solución de quitosano-Ag NP / CTAB (quitosano 6,0 μg / ml, Ag / CTAB NP) no fue posible debido a la precipitación de los componentes:formación de aglutinación de anillo gris-negro y separación del componentes en dos fases. En este caso, no se pudo evaluar la actividad antibacteriana. Teniendo en cuenta el resultado inesperado de la mezcla de quitosano y CTAB y la actividad antibacteriana más baja de Ag NPs-CTAB (ver Fig. 2b), llegamos a la conclusión de que la modificación de la superficie de Ag NP por CTAB no es prometedora. La presencia de moléculas de CTAB en la superficie de las NP de Ag mejoró la estabilidad de las dispersiones de agua, sin embargo, disminuyó significativamente la actividad antimicrobiana y provocó la precipitación de la solución.
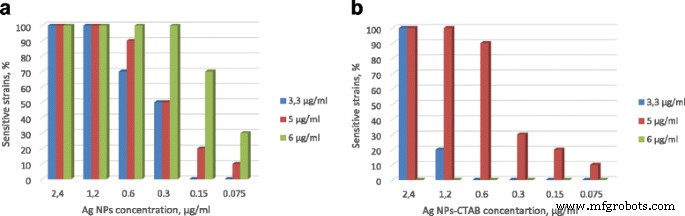
El porcentaje de cepas sensibles de MRSA después del tratamiento. Solución NP de quitosano-Ag ( a ) y solución de quitosano-AgNPs-CTAB ( b ). 3,3, 5 y 6 μg / ml:estas son las concentraciones de quitosano en solución
Discusión
La toxicidad se refiere a cualquier impacto dañino en un organismo durante la exposición a nanopartículas y sus sales. Si el objetivo es esterilizar o desinfectar un organismo específico, la toxicidad puede interpretarse como un resultado positivo (antibacteriano, antivírico) [15]. La necesidad fundamental actual en nanotecnología es el desarrollo de métodos ecológicos y fiables para la síntesis de nanopartículas metálicas. Hemos afirmado el uso de agentes reductores biológicos que son materiales naturales, de bajo costo y ecológicos para la producción de nanopartículas de plata, para evitar la presencia de solventes tóxicos y riesgosos [37]. El uso de NP de Ag como agentes terapéuticos está limitado debido a su citotoxicidad contra células de mamíferos. Varios factores pueden tener un impacto en el efecto de las NP de Ag contra los microorganismos, como el tamaño, la forma, la estabilidad y la concentración de las NP de Ag [4].
En nuestra investigación, obtuvimos NP de Ag con un tamaño de 5-18 nm. Es uno de los parámetros más fundamentales que afectan las propiedades ópticas [39], antimicrobianas [27] y antivirales de las NP de Ag [21]. Las partículas más pequeñas muestran una mayor actividad antibacteriana. Algunos estudios revelaron que los NP mayores de 10 nm se acumulan en la superficie celular y comprometen la permeabilidad celular; sin embargo, los NP de menos de 10 nm penetran en las bacterias, afectando el ADN y las enzimas que conducen a la muerte celular [14]. Es interesante observar que aunque la mayoría de los resultados demostraron que la hipótesis de toxicidad aumenta con la disminución del tamaño de partícula, también hay datos experimentales que muestran que los NP más pequeños eran menos tóxicos o no tenían toxicidad dependiente del tamaño [15]. Hay muchos estudios que mostraron la actividad antimicrobiana de las NP de Ag con un rango de tamaño de 3 a 100 nm [19].
Como se mencionó anteriormente, se evaluaron los efectos del quitosano sobre la estabilidad y las propiedades antimicrobianas de las NP de Ag sintetizadas. Antes de las pruebas de susceptibilidad, las nanopartículas sintetizadas se sometieron a diferentes métodos de caracterización para determinar su pureza. Nuestra investigación mostró que las NP de Ag en una concentración de 9,6 μg / ml son eficaces contra el 100% de las cepas de MRSA y el CTAB no aumentó la eficacia de las NP de Ag.
Se sabe que el quitosano tiene una actividad antibacteriana significativa contra un amplio espectro de bacterias [2]. A pesar de esto, algunos informes indican que el quitosano puro no previene infecciones graves [3]. Ha habido varias publicaciones que han informado de varias combinaciones de quitosano y plata con propiedades antimicrobianas mejoradas [11]. Los nanocompuestos de plata-quitosano se propusieron como recubrimientos para aplicaciones de ingeniería biomédica y envasado de alimentos y apósitos para heridas [2, 3]. Pero hay datos limitados sobre el efecto antibacteriano de la solución de NP de quitosano-Ag contra MRSA [34]. Nuestros datos demuestran que la simple mezcla de NP de Ag en una solución de quitosano puede mejorar la actividad antibacteriana de ambos componentes. Consigo el aumento de todas las actividades investigadas antibacterial de la sustancia. La CIM del quitosano fue de 3,3 μg / ml y las NP de Ag puras MIC y las NP de Ag con MIC de CTAB fueron de 1,2 y 2,4 μg / ml, respectivamente. Kaur y col. (2013) también informaron sobre la actividad antibacteriana de nanocompuestos de plata / quitosano contra S . aureus , en el que mostraron resultados similares [36], pero no determinaron la CMI. Este hallazgo demuestra la eficacia de la solución de NP de quitosano-Ag, pero no vimos ventajas de CTAB como agente antibacteriano. Por el contrario, otro estudio mostró que los NP de Ag estabilizados con CTAB tienen un efecto antibacteriano pronunciado contra S . aureus y Escherichia coli . Probablemente, en nuestro experimento, el quitosano se vincula con CTAB que disminuye el efecto de los NP de Ag para las células bacterianas.
Conclusiones
En este estudio, se probó la actividad de las soluciones NP de quitosano-Ag preparadas in situ con diferentes proporciones de componentes frente a MRSA aislado de pacientes. Nuestros resultados mostraron que la simple mezcla de la solución de quitosano y Ag NP reduce la concentración mínima de inhibición de las sustancias en 2 y 4 veces (3,3 y 1,2 μg / ml), respectivamente. Este resultado es muy prometedor y puede considerarse como una solución eficaz en la lucha contra las bacterias resistentes a los medicamentos. También es un avance en la dirección hacia la medicina personalizada. El estudio de citotoxicidad futuro de la solución de NP de quitosano-Ag daría una respuesta sobre las dosis adecuadas para uso clínico.
Abreviaturas
- Ag NP:
-
Nanopartículas de plata
- ARI:
-
Infecciones respiratorias agudas
- CTAB:
-
Bromuro de cetrimonio
- FTIR:
-
Espectroscopía infrarroja por transformada de Fourier
- MRSA:
-
M cepas resistentes a la eticilina de Staphylococcus aureus
- TEM:
-
Microscopía electrónica de transmisión
- UV – Vis:
-
Espectroscopía ultravioleta visible
- XRD:
-
Difracción de rayos X
Nanomateriales
- Nanopartículas de FePO4 biocompatibles:administración de fármacos, estabilización de ARN y actividad funcional
- Síntesis biogénica, caracterización y evaluación del potencial antibacteriano de nanopartículas de óxido de cobre contra Escherichia coli
- Preparación y actividad de hidrogenación catalítica mejorada de nanopartículas de Sb / Palygorskita (PAL)
- Efectos sinérgicos de nanopartículas de Ag / BiV1-xMoxO4 con actividad fotocatalítica mejorada
- Determinación de la actividad catalítica de nanopartículas de TiO2 dopado con metal de transición mediante análisis espectroscópico de superficie
- Avances recientes en métodos sintéticos y aplicaciones de nanoestructuras de plata
- Nanocomposites a base de óxido de grafeno decorados con nanopartículas de plata como agente antibacteriano
- Propiedades de las nanopartículas de óxido de zinc y su actividad contra los microbios
- Síntesis in situ de nanopartículas bimetálicas de tungsteno-cobre mediante plasma térmico de radiofrecuencia (RF) reactiva
- El poli (ácido γ-glutámico) promueve la decloración mejorada de p-clorofenol mediante nanopartículas de Fe-Pd
- Influencia del dopaje de Mg en nanopartículas de ZnO para una evaluación fotocatalítica mejorada y análisis antibacteriano



