Anticuerpo monoclonal de heparanasa marcada con nanopartículas de oro magnético y su aplicación posterior para la obtención de imágenes por resonancia magnética tumoral
Resumen
La heparanasa (HPA) se expresa de forma ubicua en varios tumores malignos metastásicos; estudios previos han demostrado que HPA era un antígeno potencial asociado a tumores (TAA) para la inmunoterapia tumoral. Buscamos evaluar la viabilidad de HPA como un TAA común para la resonancia magnética (MRI) de metástasis tumorales y su aplicación potencial en la imagenología molecular tumoral. Preparamos una sonda dirigida basada en nanopartículas de oro magnéticas junto con un anticuerpo anti-HPA para la detección específica de HPA por resonancia magnética. La especificidad de la sonda dirigida se validó in vitro mediante la incubación de la sonda con varias células tumorales, y la sonda pudo detectar selectivamente células HPA (+). Encontramos que las sondas mostraban una intensidad de señal significativamente reducida en varias células tumorales, y la intensidad de la señal disminuyó significativamente después de que se inyectó la sonda dirigida en ratones desnudos portadores de tumores. En el estudio, demostramos que la sonda HPA y GoldMag tenía excelentes propiedades físicas y químicas y actividades inmunes y podía apuntar específicamente a muchos tejidos de células tumorales tanto in vitro como in vivo. Esto puede proporcionar una base experimental para la obtención de imágenes moleculares de tumores de alta expresión de heparanasa utilizando mAb HPA.
Antecedentes
La metástasis tumoral es un comportamiento maligno que es la principal causa de muerte en pacientes con tumores. Actualmente no existen estrategias efectivas para la detección temprana de metástasis tumorales. Las ecografías de tipo B, la tomografía computarizada (TC) y la resonancia magnética (RM) son actualmente las herramientas estándar para el diagnóstico de metástasis tumorales, pero solo pueden distinguir tumores metastásicos de ciertos tamaños cuando la mayoría de los pacientes ya sufren metástasis a distancia [1 , 2]. Por lo tanto, es urgente desarrollar estrategias novedosas para detectar la metástasis tumoral temprana.
En los últimos años, la imagenología molecular, como la resonancia magnética molecular, se ha convertido en una nueva opción para el diagnóstico precoz y el tratamiento de tumores debido a su buena resolución espacial y su sensibilidad media a los agentes de contraste [3, 4]. El desarrollo de nuevos agentes de contraste que proporcionan más que una mejora de la imagen es una de las principales motivaciones en el desarrollo de la resonancia magnética. Recientemente, el uso de sondas moleculares superparamagnéticas como un potente sistema de amplificación de señales aumenta en gran medida la sensibilidad de los agentes de contraste dirigidos a la RM. Se han utilizado complejos de iones paramagnéticos o mAb conjugados con partículas magnéticas para cambiar el tiempo de relajación del tumor [5]. Las imágenes moleculares que utilizan una combinación de nanomateriales magnéticos y mAb contra antígenos asociados a tumores (TAA) son un foco de investigación reciente. La mayoría de los TAA descubiertos hasta la fecha, como AFP, PSA y CEA, son específicos de tejido tumoral [6]. Por tanto, la combinación de mAb contra estos TAA con nanomateriales magnéticos es útil para tumores que expresan estos antígenos específicos. Por lo tanto, la identificación de un antígeno tumoral común que sea adecuado para una variedad de tumores y el etiquetado de mAbs contra dicho antígeno con nanomateriales magnéticos es útil en la formación de imágenes moleculares de tumores.
La heparanasa (HPA) es un gen asociado a metástasis tumoral que fue clonado simultáneamente por cuatro laboratorios en 1999 [7,8,9,10]. Solo la endoglicosidasa endógena puede degradar el proteoglicano heparán sulfato (HSPG), el principal componente proteoglicano de la matriz extracelular (MEC). El HPA se expresa de forma ubicua en tumores malignos metastásicos y su nivel de expresión está estrechamente asociado con la metástasis tumoral. HPA puede alterar la integridad de la ECM y la membrana basal (BM) a través de la escisión de HSPG en la ECM y BM, lo que conduce a la liberación y activación de moléculas ancladas en la ECM y luego promueve la angiogénesis y metástasis tumorales [11, 12]. Nuestros estudios anteriores han demostrado que HPA se puede utilizar como TAA para la inmunoterapia tumoral [13, 14, 15, 16]. Aquí, buscamos evaluar si HPA está disponible para ser un TAA común para la formación de imágenes moleculares de metástasis tumorales y su posible aplicación en la formación de imágenes moleculares tumorales.
En este estudio, utilizamos nanopartículas de oro magnéticas (30 nm) como agente de contraste y mAb HPA como vectores de dirección para construir sondas moleculares HPA y GoldMag, y examinamos la viabilidad y la importancia de estas sondas en la resonancia magnética molecular para el diagnóstico temprano de tumores. metástasis. También se evaluaron los efectos biológicos antitumorales in vitro de los anticuerpos HPA para proporcionar una base experimental para la aplicación de mAb HPA en el tratamiento de tumores.
Métodos
Líneas celulares y ratones
En este estudio se utilizaron siete líneas celulares. Las líneas celulares hepáticas positivas, incluida la línea celular de cáncer de hígado HepG2, las líneas celulares de cáncer gástrico humano MKN45 y SGC-7901, la línea celular de cáncer de colon SW480 y la línea celular de osteosarcoma humano U2OS, se compraron de la American Type Culture Collection. El Dr. Liang (Burn Research Institute, Third Military Medical University, Chongqing, China) proporcionó las líneas celulares negativas a la heparanasa, la línea celular de cáncer de mama humano MCF-7 y la línea celular de fibroblastos embrionarios primarios humanos HF. Se cultivaron células HepG2 en DMEM que contenía suero bovino fetal al 10%. Se cultivaron células SGC-7901, SW480, U2OS y HF en RPMI 1640 que contenía suero bovino fetal al 10%. Se cultivaron células MKN45 y MCF-7 en RPMI 1640 que contenía suero bovino fetal al 15%. Todas las células se cultivaron en un 5% de CO 2 incubadora a 37 ° C y se pasaron cada 24 a 48 h. Se adquirieron quince ratones desnudos BALB / c (de 4 a 5 semanas de edad) del Departamento de Animales de la Tercera Universidad Médica Militar. Los estudios en animales se realizaron de acuerdo con el comité de ética local de la Tercera Universidad Médica Militar. Todos los ratones desnudos se mantuvieron en un entorno libre de patógenos específicos.
Western Blot
Se realizó una transferencia de Western para detectar la expresión de la proteína Hpa siguiendo el procedimiento descrito en nuestro estudio anterior [17]. Cada línea celular se lisó con el reactivo de extracción M-PER (Pierce Co.). Las concentraciones de proteínas se determinaron mediante el ensayo BCA (Bio-Rad, CA, EE. UU.). Se fraccionaron treinta microgramos de proteínas mediante SDS-PAGE al 10% y luego se transfirieron a una membrana de polivinilidendifluoruro (PVDF) (Roche, Rotkreuz, Suiza). La membrana se bloqueó con un 5% ( w / v ) leche desnatada en TBST (Tris-HCl 20 mM [pH 8,0], NaCl 150 mM y [ v al 0,1%] / v ] Tween-20) durante 2 ha temperatura ambiente. Luego, se sondeó la membrana con una dilución 1:200 de anticuerpo anti-HPA (Insight, Israel) en tampón de bloqueo a 4 ° C durante la noche. La membrana se lavó cuatro veces con TBST y se incubó con un anticuerpo conjugado con peroxidasa de rábano picante contra IgG de ratón durante 1 ha temperatura ambiente. A continuación, se enjuagó la membrana con TBST y se visualizaron las bandas de proteína con reactivos de detección de transferencia Western ECL (GE Healthcare, NJ, EE. UU.). Las imágenes se analizaron con el software Quantity One 4.1 (Bio-Rad). Los experimentos se repitieron al menos tres veces.
Tinción inmunohistoquímica
La expresión de Hpa en las líneas celulares anteriores se detectó mediante inmunocitoquímica. Brevemente, las células anteriores se cultivaron en cubreobjetos estériles a 37 ° C en un 5% de CO 2 incubadora durante 48 h. Después de que se bloqueó la actividad de la peroxidasa endógena mediante el tratamiento con un 0,3% de H 2 O 2 -metanol durante 20 min, las células se incubaron con el anticuerpo primario Hpa (la dilución del anticuerpo fue 1:100) durante la noche a 4ºC. Después de lavar a fondo con PBS que contenía Triton X-100 al 0,1%, los portaobjetos se incubaron con un anticuerpo secundario durante 20 min a 20 ° C. Finalmente, los portaobjetos se incubaron durante 15 min con un reactivo de enzima avidina-biotina. A continuación, los portaobjetos se sumergieron en una solución de 3,3'-diaminobencidina / H2O2. Se utilizó PBS como control negativo.
Construcción de la sonda molecular HPA y GoldMag y la micrografía de fuerza atómica
La construcción de la sonda molecular se realizó utilizando el kit GoldMagTM-CS (empresa de nanobiotecnología magnética Xi’an Gold, GNK0202, Xi’an, China) de acuerdo con las instrucciones de funcionamiento. La concentración de anticuerpo HPA es de 1 mg / ml. Se utilizó una micrografía de fuerza atómica (AFM) para evaluar la forma, el tamaño y el aspecto de la superficie de las nanopartículas. Las nanopartículas de oro magnéticas no marcadas o las nanopartículas de oro magnéticas marcadas se colocaron en el cubreobjetos y se secaron al aire a temperatura ambiente durante 24 h. Las muestras secas se analizaron utilizando un microscopio de fuerza atómica (AFM, Nanoscope, Digital Instruments, Santa Barbara, CA).
Inmunofluorescencia
Brevemente, las células se cultivaron en cubreobjetos estériles a 37 ° C en un 5% de CO 2 incubadora durante 48 h. Luego, las células se fijaron con 4% ( w / v ) formaldehído en PBS durante 30 min y permeabilizado con 0,2% ( v / v ) Triton X-100 durante 5 min a temperatura ambiente. Las células se bloquearon incubando los cubreobjetos con un 10% ( v / v ) suero de cabra en PBS durante 30 min. Luego, las células se tiñeron con sondas moleculares HPA y GoldMag o sondas de IgG y GoldMag de ratón normales a una dilución de 1:50 seguido de IgG de cabra anti-ratón marcada con Cy3 a una dilución de 1:100. A continuación, las células se tiñeron con 0,4 mg / ml de DAPI (Sigma-Aldrich) durante 10 min a temperatura ambiente. Las imágenes microscópicas se adquirieron utilizando un microscopio confocal láser. Se utilizaron sondas normales de ratón IgG y GoldMag como control negativo.
Citometría de flujo
La actividad de la sonda HPA &GoldMag se determinó mediante citometría de flujo. Las células se bloquearon con suero de cabra durante 1 h. Luego, las células se tiñeron con una sonda HPA y GoldMag de 10 μg o IgG de ratón normal y GoldMag a 4 ° C durante la noche, se lavaron cuatro veces con PBS y luego se incubaron con un anticuerpo marcado con FITC contra IgG de ratón durante 1 ha 37 ° C. Las células se lavaron con PBS y se midió la intensidad de la fluorescencia con un citómetro de flujo (Becton Dickinson).
Estudio in vitro de nanopartículas magnéticas de oro para imágenes por resonancia magnética
La solución de nanopartículas de oro magnético (5 mg / ml) se diluyó en serie dos veces (1:20-1:1280) utilizando una solución de agarosa al 1%. Las soluciones se solidificaron en tubos EP. La exploración por RM se realizó utilizando un gel de agarosa al 1% como control en blanco. Los parámetros de exploración fueron los siguientes:T1WI; TR600 ms / TE12 ms; espesor, 2,0 mm; FOV, 150 mm; y T2WI; TR6000 ms / TE92 ms; espesor, 2,0 mm; FOV, 150 mm. Las sondas moleculares HPA y GoldMag MR se construyeron usando mAb HPA marcados con partículas de oro magnéticas de 30 nm. Las células se cultivaron de forma rutinaria en placas de cultivo de 100 mm, y luego se añadieron sondas HPA y GoldMag o sondas negativas de IgG y GoldMag a los cultivos celulares y se incubaron a 37ºC durante 90 min. Las sondas no unidas se bloquearon añadiendo una cantidad apropiada de suero de cabra. Después de lavar con PBS tres veces, las células se digirieron con tripsina. A continuación, se recogieron las células, se mezclaron con una solución de agarosa al 1% y se transfirieron a tubos EP de 1,5 ml. La exploración por RM se realizó utilizando un escáner de RM de 3,0 T (los parámetros de exploración fueron los mismos que los descritos anteriormente) utilizando la bobina de resonancia magnética específica para animales. Antes de la exploración, los ratones fueron anestesiados con pentobarbital al 1% y colocados en la cama de exploración.
Estudio in vivo de nanopartículas magnéticas de oro para imágenes por resonancia magnética
Se inyectaron subcutáneamente en la cadera ratones desnudos macho de cuatro a seis semanas de edad (26-30 g) con 200 µl de células MKN45. A cada ratón desnudo se le inyectó aproximadamente 2,0 × 10 6 células. Después de 2 semanas, los tumores son visibles y se utilizan para imágenes por resonancia magnética. Antes de la inyección y 2 h después de la inyección, se realizó una exploración por RM utilizando un escáner de RM de 3,0 T. Los parámetros fueron T2WI, TR6000 ms / TE92 ms; espesor, 1,5 mm; y FOV, 120 mm. A partir de entonces, se recogieron los tejidos del tumor, el bazo, el hígado, el riñón, el bazo, el corazón y los pulmones para realizar la tinción con azul de Prusia con Fe.
Análisis estadístico
Todos los datos se presentan como media ± desviación estándar. El análisis ANOVA se realizó utilizando el software SPSS13.0. A P valor <0.05 indicó que la diferencia era significativa.
Resultados
El HPA se expresó de manera diferente en varias células cancerosas
Se utilizaron análisis de tinción inmunohistoquímica y de transferencia Western para probar la expresión de Hpa en células HepG2, SGC-7901, MKN45, MCF-7, SW480 y U2OS. Los resultados mostraron que la expresión de Hpa era mucho mayor en las células HepG2, SGC-7901, MKN45, SW480 y U2OS, mientras que se detectó una expresión mucho menor de Hpa en las células MCF-7 (Fig. 1).
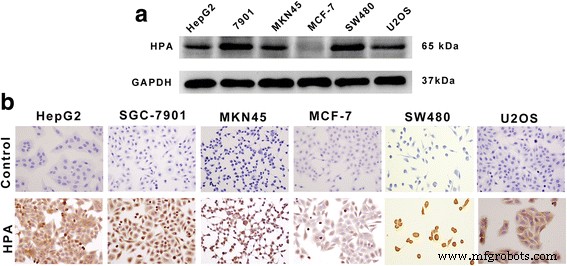
Expresión de proteínas Hpa en varias líneas celulares. un Se usó Western blot para detectar la expresión de la proteína HPA (65 kDa) en varias líneas de células tumorales. Carril 1, HepG2; carril 2, SGC-7901; carril 3, MKN45; carril 4, MCF-7; carril 5, SW480; carril 5, U2OS. b Análisis inmunohistoquímico de la expresión de HPA en líneas celulares HepG2, SGC-7901, MKN45, MCF-7, SW480 y U2OS
Construcción y detección de la sonda molecular HPA y GoldMag
La sonda molecular HPA y GoldMag se preparó acoplando los mAb HPA con nanopartículas magnéticas de oro utilizando la reacción de acoplamiento entre las superficies de las nanopartículas magnéticas de oro. Se utilizó microscopía de fuerza atómica (AFM) para observar directamente la estructura de la superficie de la sonda. Demostramos que el diámetro medio de las nanopartículas de oro magnéticas era de 13,78 nm sin marcaje con mAb HPA (Fig. 2a); los tamaños de partícula fueron homogéneos. Después de marcarse con mAb de HPA, el diámetro medio fue de aproximadamente 24,80 nm (Fig. 2b). Estos resultados sugirieron que las nanopartículas de oro magnéticas eran adecuadas para acoplarse con mAb HPA.
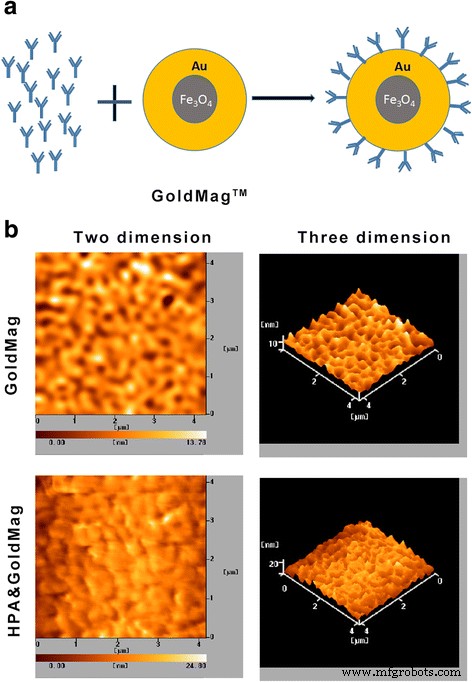
un Modelo de acoplamiento de nanopartículas de oro magnéticas con mAbs HPA. b Escaneo de fuerza atómica de nanopartículas de oro magnéticas
Las sondas moleculares HPA y GoldMag pueden unirse específicamente a HPA
En primer lugar, se evaluó la especificidad de la unión entre la sonda molecular y HPA mediante inmunofluorescencia. Los resultados mostraron que se detectó una gran cantidad de fluorescencia roja en el citoplasma de las células HepG2, MKN45, SW480 y U2OS, mientras que solo se detectó una pequeña cantidad de fluorescencia roja en las células MCF-7 y no se detectó fluorescencia en las células HF. . Sin embargo, IgG y GoldMag de ratón negativos no mostraron ninguna interacción con HPA en ninguna línea celular (Fig. 3). Además, utilizamos citometría de flujo para probar la especificidad de la sonda molecular HPA y GoldMag. Mostramos una respuesta negativa en las células de HF y observamos tasas positivas del 40% en las células MCF-7 y tasas positivas del 95% en las células HepG2, SW480, U2OS y MKN45. Estos resultados indican que las sondas pueden unirse específicamente a HPA expresado en células tumorales.
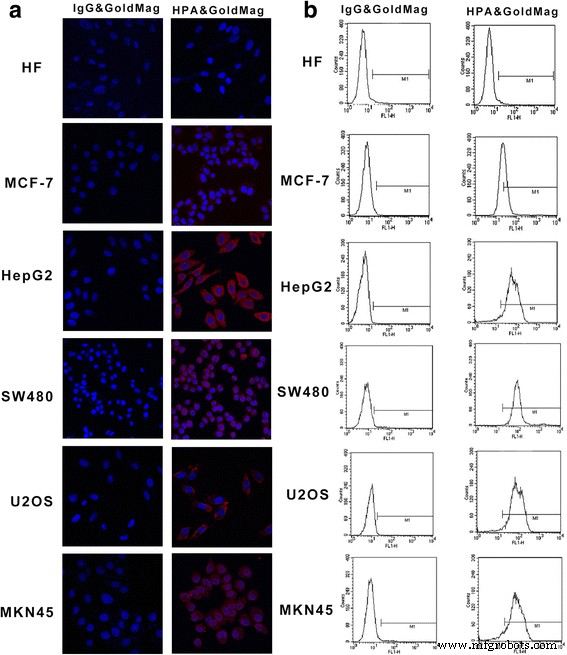
Especificidad y actividad de unión de la sonda detectada por inmunofluorescencia y citometría de flujo. un La inmunofluorescencia se realizó usando sondas como se indica. b Se utilizó citometría de flujo para probar la especificidad de la sonda molecular HPA y GoldMag
Imágenes de RM de sondas HPA y GoldMag in vitro
Después de la dilución en serie con agarosa al 1%, la resonancia magnética de nanopartículas de oro magnéticas usando una secuencia T2WI mostró una reducción de señal diferente. La señal de T2WI de una dilución de 1:640 fue mucho más baja que la del control de gel de agarosa al 1% ( P <0.05) (Fig. 4a, b). Los resultados mostraron que las nanopartículas de oro magnéticas podrían reducir la señal de RM de manera efectiva incluso en una concentración baja, lo que sugiere que las nanopartículas de oro magnéticas podrían ser adecuadas para la obtención de imágenes moleculares. Luego, se usaron sondas moleculares HPA y GoldMag para marcar células HepG2, SGC7901, MKN45, SW480, U2OS, HF y MCF-7 que luego se mezclaron con agarosa al 1% y se colocaron bajo resonancia magnética (MR) 3.0 T (Fig. 4c). Imagen de resonancia magnética usando secuencia T1WI (Fig. 4c, d) o T2WI (Fig. 4c, e) para exploración axial más coronal. Los resultados mostraron que, en comparación con la secuencia T1WI, la señal que usa la secuencia T2WI de la exploración por RM se redujo significativamente ( P <0.05) mientras que la señal en las células de HF después del etiquetado no cambió significativamente ( P > 0.05), y la señal en las células MCF-7 después del etiquetado se redujo mínimamente ( P <0.05).
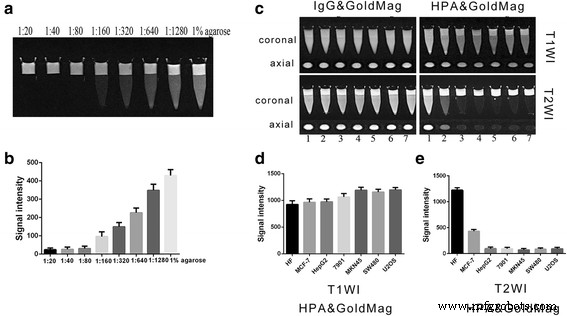
un Imágenes de RM de nanopartículas de oro magnéticas después de dos diluciones en serie. b Diagrama de los resultados estadísticos de la intensidad de la señal de imágenes de resonancia magnética de dos nanopartículas de oro magnéticas diluidas en serie. c Imágenes por RM de todas las células después de marcarlas con las sondas. Carril 1, HF; carril 2, MCF-7; carril 3, HepG2; carril 4, SGC-7901; carril 5, MKN45; carril 5, SW480; carril 6, U2OS. d Resultados estadísticos que comparan la intensidad de la señal de la resonancia magnética utilizando la secuencia T1WI en células marcadas con sondas HPA y GoldMag. e Resultados estadísticos de las intensidades de la señal detectadas con imágenes de resonancia magnética utilizando la secuencia T2WI en células marcadas con sondas HPA y GoldMag
Imágenes de RM de sondas HPA y GoldMag en ratones desnudos
Todos los ratones desnudos fueron anestesiados con pentobarbital sódico a una dosis de 50 mg / kg. La sonda molecular se inyectó en la vena de la cola de los ratones desnudos y la exploración por RM se realizó antes y 2 h después de la administración. Dado que la sonda podría ser absorbida por los macrófagos en el pulmón y el hígado y excretada por el riñón, los resultados del escaneo mostraron que después de la inyección, el tumor, el hígado, los riñones y los tejidos pulmonares en los ratones desnudos tenían señales significativamente reducidas, en comparación con las señales. que se detectaron antes de la inyección ( P < 0.05) (Figura 5).
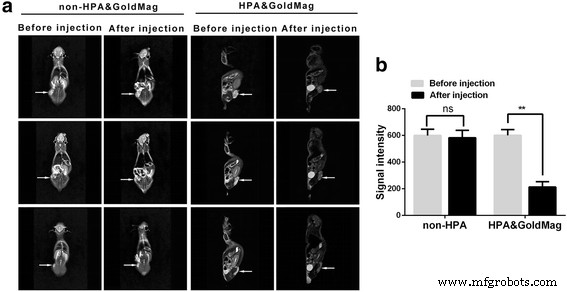
un Imágenes de RM de ratones desnudos antes y 2 h después de la inyección de las sondas de control o HPA y GoldMag. La flecha indica los tumores en ratones. b Comparación de la intensidad de la señal de las imágenes de RM usando T2WI antes y después de la inyección de las sondas de control o HPA y GoldMag en ratones desnudos. * P <0.01
Discusión
La invasión y metástasis tumorales es un proceso biológico complejo que provoca el mal pronóstico de los tumores. Por tanto, el diagnóstico precoz de la metástasis tumoral es una estrategia importante para seleccionar estrategias de tratamiento clínico. La resonancia magnética es un método no invasivo útil para la detección de tumores; permite obtener imágenes de tejidos multidimensionales de alto contraste. Sin embargo, la RM no pudo detectar tumores con un tamaño pequeño y se deberían utilizar agentes de alto contraste como nanopartículas metálicas (hierro, oro, etc.) para mejorar la visualización del tumor [18,19,20]. El desarrollo de nuevos agentes de contraste basados en nuevos nanomateriales es beneficioso para mejorar las técnicas de resonancia magnética para la detección temprana de cánceres. Entre los agentes de formación de imágenes, la partícula de óxido de hierro superparamagnético (SPIO) se utiliza como un agente de contraste común en la resonancia magnética molecular, en la que las nanopartículas de oro magnéticas son materiales nanocompuestos superparamagnéticos con un Fe 3 O 4 (núcleos) / estructura de Au (caparazón) [21,22,23,24]. Las propiedades superparamagnéticas de las nanopartículas inorgánicas son útiles para la formación de imágenes por resonancia magnética (IRM) [25]. Una combinación de estas nanopartículas con agentes específicos de tejido (anticuerpos o sustancias de bajo peso molecular) permite la detección y el diagnóstico precisos de tumores. Numerosos estudios han demostrado que HPA se expresa en muchos tumores, y su nivel de expresión está estrechamente asociado con el potencial metastásico de los tumores [26]. HPA puede destruir la integridad de la ECM y BM a través de la degradación de HSPG, que libera moléculas activas como bFGF, HGF y VEGF ancladas en la ECM, promoviendo así la progresión del tumor [27,28,29,30]. Dado que HPA se expresa principalmente en tumores en estadio medio o tardío, nuestros estudios anteriores han demostrado que HPA podría usarse como un AAT común para la terapia tumoral [13,14,15]. Por lo tanto, la HPA podría ser un objetivo potencialmente útil para la terapia e imágenes moleculares de tumores.
Las nanopartículas de oro magnéticas son nanomateriales compuestos superparamagnéticos con un Fe 3 O 4 Estructura (núcleo) / Au (caparazón) que se producen mediante la reducción de Au 3+ por hidrocloruro de hidroxilamina de Fe 3 superparamagnético O 4 partículas [31, 32]. Dado que el método de marcado es bastante simple, se pueden usar para aplicaciones biológicas como la selección de células, purificación de proteínas, separación de ácidos nucleicos e inmunoensayos. Por lo tanto, siguiendo un procedimiento establecido, pudimos preparar y caracterizar con éxito nanopartículas de óxido de hierro recubiertas de oro unidas a anticuerpos anti-HPA. En esta investigación, se utilizaron partículas de oro magnéticas de 30 nm porque son mucho más estables que las partículas de oro magnéticas de 50 nm. Un miligramo de partículas de oro magnéticas de 30 nm podría unirse a aproximadamente 200 μg de mAb HPA. Nuestros datos mostraron que el uso de nanopartículas de oro magnéticas en una dilución de 1:640 (aproximadamente 10 μg) produjo una señalización reducida en comparación con el grupo de control en blanco en el escaneo de resonancia magnética de 3.0 T ( P < 0,05). Por lo tanto, se podría calcular el valor crítico para la obtención de imágenes in vivo utilizando partículas de oro magnéticas.
La actividad y especificidad de las sondas de mAb HPA acopladas a nanopartículas de oro magnéticas se detectó posteriormente mediante microscopía confocal láser, citometría de flujo y microscopía de fuerza atómica. Brevemente, la sonda se probó in vitro mediante la incubación de la sonda diana y la sonda de control negativo con células HPA (+) y (-). Aquí, las células humanas de cáncer de mama MCF-7 mostraron una expresión de HPA débil, mientras que las células MKN45, SW480, U2OS, HepG2 y SGC-7901 tenían una expresión de HPA más alta. Además, se usó IgG de ratón normal como control de los mAb HPA para demostrar aún más la especificidad de la nanopartícula.
Después de probar la especificidad de la sonda in vitro , las sondas dirigidas y de control se inyectaron en ratones desnudos inyectados por vía subcutánea con células de cáncer gástrico MKN45 humano. Una vez que el diámetro de los tejidos tumorales alcanzó 1 cm, se realizó una exploración por RM utilizando una cámara de RM de 3,0 T para detectar cambios de señal en los tumores antes y después de la inyección con sondas. Los resultados de la exploración mostraron que las señales tumorales se redujeron significativamente 2 h después de la inyección de la sonda en comparación con las señales antes de la inyección de la sonda. Estos resultados demostraron que las sondas HPA y GoldMag tenían excelentes actividades inmunes y mejores efectos en ratones desnudos que portaban células MKN45.
Conclusiones
En resumen, demostramos que las sondas moleculares HPA y GoldMag acopladas con mAbs HPA tenían excelentes propiedades físicas y químicas. La sonda podría apuntar específicamente a muchas células tumorales que expresan un alto HPA tanto in vitro como in vivo. Utilizando una exploración de RM de 3,0 T, se demostró que las sondas reducen significativamente la señal de T2WI en los tejidos tumorales; esto puede proporcionar una base experimental para la obtención de imágenes moleculares de metástasis tumorales.
Abreviaturas
- AFM:
-
Micrografía de fuerza atómica
- BM:
-
Membrana de sótano
- CT:
-
Tomografía computarizada
- ECM:
-
Matriz extracelular
- HPA:
-
Heparanasa
- HSPG:
-
Proteoglicano de sulfato de heprano
- IRM:
-
Imágenes por resonancia magnética
- PVDF:
-
Polivinilidendifluoruro
- TAA:
-
Antígeno asociado a tumor
Nanomateriales
- Imágenes por resonancia magnética (IRM)
- Nanopartículas de oro multifuncionales para aplicaciones terapéuticas y diagnósticas mejoradas:una revisión
- Absorbedor perfecto de banda ultra estrecha y su aplicación como sensor plasmónico en la región visible
- Nuevas nanopartículas de Au Nanostars @ PEG biocompatibles para la obtención de imágenes de TC in vivo y las propiedades de depuración renal
- Síntesis de calentamiento de estado sólido de compuesto de poli (3,4-etilendioxitiofeno) / oro / grafeno y su aplicación para la determinación amperométrica de nitrito y yodato
- Nanoconjuntos de ácido 5-aminolevulínico-escualeno para fotodetección y terapia de tumores:estudios in vitro
- Una sonda fluorescente reanudable BHN-Fe3O4 @ SiO2 Nanoestructura híbrida para Fe3 + y su aplicación en bioimagen
- Caracterización por resonancia magnética y de microondas dependiente del grosor de películas de FeCoBSi con patrón de rayas combinadas
- Absorbedor de infrarrojo cercano mejorado:silicio negro estructurado fabricado en dos pasos y su aplicación en el dispositivo
- Síntesis mediada por semillas de nanobarras de oro con relación de aspecto sintonizable para imágenes fotoacústicas en el infrarrojo cercano
- Aplicaciones biomédicas para nanoclusters de oro:desarrollos recientes y perspectivas futuras



