Prueba de las propiedades estructurales, electrónicas y magnéticas de Ag n V (n =1–12) Clusters
Resumen
Las propiedades estructurales, electrónicas y magnéticas de Ag n V ( n =1–12) se han estudiado los conglomerados utilizando la teoría funcional de la densidad y el método de búsqueda de estructuras CALYPSO. Las optimizaciones de geometría manifiestan que un átomo de vanadio en Ag n de baja energía Los grupos V favorecen la ubicación más coordinada. La sustitución de un átomo de V por un átomo de Ag en Ag n + 1 ( n ≥ 5) cluster modifica la estructura de energía más baja del cluster anfitrión. Los espectros infrarrojos, los espectros Raman y los espectros de fotoelectrones de Ag n V ( n =1–12) los conglomerados se simulan y se pueden utilizar para determinar la estructura más estable en el futuro. La estabilidad relativa, el canal de disociación y la actividad química de los estados fundamentales se analizan mediante la energía de enlace promediada atómica, la energía de disociación y la brecha de energía. Se encuentra que el átomo de V puede mejorar la estabilidad del clúster de host, Ag 2 exceptuado. Los canales de disociación más posibles son Ag n V =Ag + Ag n - 1 V de n =1 y 4–12 y Ag n V =Ag 2 + Ag n - 2 V de n =2 y 3. La brecha de energía de Ag n Clúster V con n impares es mucho más pequeño que el de Ag n + 1 grupo. Los análisis de la propiedad magnética indican que el momento magnético total de Ag n El grupo V proviene principalmente del átomo V y varía de 1 a 5 μ B . La transferencia de carga entre los átomos de V y Ag debería ser responsable del cambio de momento magnético.
Antecedentes
En las últimas décadas, los racimos de plata han atraído especial atención debido a sus inusuales propiedades ópticas y catalíticas [1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16,17,18,19,20]. Simultáneamente, investigaciones teóricas y experimentales han revelado que un átomo dopado en un pequeño grupo de otro elemento puede cambiar fundamentalmente la naturaleza del grupo anfitrión [21,22,23,24,25,26,27,28,29,30,31 , 32,33,34,35,36,37,38,39,40,41,42,43,44]. Se esperaba que los racimos de plata dopados con diferentes átomos adaptaran las propiedades ópticas, electrónicas y magnéticas deseadas para aplicaciones potenciales en imágenes, detección, biología, medicina y nanotecnología [45,46,47,48,49,50,51,52 , 53,54,55]. Por ejemplo, el dopaje de Si en un grupo de plata conduce a una ampliación y amortiguación de los picos de los espectros de absorción UV-visible de los grupos de Ag [45]. El carácter óptico de Ag n Au m se puede ajustar cambiando la proporción de átomos de plata a átomos de oro y Au 4 Ag 4 podría ser un dispositivo fotoeléctrico molecular potencialmente prometedor [46]. En contraste con los racimos plateados, el TiO 2 modificado por racimo binario Ag-Au El electrodo mejora la densidad de corriente de cortocircuito y la máxima eficiencia de conversión de energía de la célula solar [47]. Las energías de adsorción de un conjunto de ligandos típicos (−COOH, −CN, −OH, −SH, −CH 3 , −NO 2 , −NH 3 , −NO) son más pequeñas en Ag 12 Au cluster que en Ag 13 racimo [48]. La nanoaleación de Ag-Cu es un candidato potencial para sustituir el catalizador noble basado en Pt en las pilas de combustible alcalinas [49]. Los electrones en los átomos externos de Ag 12 El racimo de Cu tiene una característica más activa que la de Ag 13 racimo [50]. La actividad catalítica del grupo de aleaciones de Ag-Pd para la disociación del hidrógeno está estrechamente asociada con la estequiometría. El Ag 6 Pd 2 es el grupo más eficiente para la adsorción de moléculas de hidrógeno y puede servir como un candidato prometedor para H 2 almacenamiento [51]. La introducción de un solo átomo de metal de transición 3d resolvió eficazmente el problema de inestabilidad del Ag 12 icosaedro [52]. Recientemente, se han llevado a cabo varias investigaciones para los racimos de plata dopados con V debido a sus propiedades físicas y químicas únicas [56,57,58,59]. Zhang y col. informó que el Ag 12 neutral El grupo V muestra energías de unión relativas más grandes en comparación con Ag 13 icosaédrico puro racimo [56]. Chen y col. encontró que Pyridine en V @ Ag 12 - Los grupos exhiben la mejora química más fuerte con un factor de alrededor de mil [57]. Medel y col. exploró la naturaleza de la transición de valencia y el momento de giro en Ag n V + clústeres que tienen una estabilidad mejorada para n =14 [58]. Sin embargo, hay relativamente pocos trabajos relacionados con los racimos de plata dopados en V neutrales. En particular, los diversos espectros de Ag n No se han obtenido grupos V, pero serían de gran ayuda para la identificación de la estructura del grupo. También es necesario explorar más a fondo el motivo estructural de los racimos de plata dopados en V. El cambio del momento magnético de la impureza magnética incrustado en un anfitrión no magnético todavía no se comprende completamente. En consecuencia, en el presente artículo, las propiedades geométricas, electrónicas y magnéticas de Ag n V ( n =1–12) los grupos se investigarán sistemáticamente a través de la teoría funcional de la densidad (DFT). Se espera que este trabajo pueda proporcionar una referencia para comprender la relación entre la función y la estructura de los materiales y para experimentos relacionados.
Métodos
La precisión de las distintas funciones de correlación de intercambio, como se implementó en el paquete de programa GAUSSIAN09 (Frisch, M. J. et al., Wallingford, KY, EE. UU.) [60], se verificó primero mediante cálculos en Ag 2 dímero. Los resultados calculados basados en el nivel de PW91PW91 / LanL2DZ (Perdew, JP et al., Nueva Orleans, Luisiana, EE. UU.) Concuerdan bien con los hallazgos experimentales [61, 62], como se resume en la Tabla 1. Por otro lado, los cálculos de prueba utilizando los diferentes funcionales de DFT se realizaron para el dímero de AgV. Cinco funciones enumeradas en la Tabla 1 favorecen las mismas configuraciones de giro. Por lo tanto, este nivel de teoría se utiliza para optimizaciones geométricas y análisis de frecuencia de Ag n V racimos. Muchas configuraciones iniciales de Ag n Los clústeres V se construyeron utilizando CALYPSO, que es un método eficaz de predicción de estructuras [63]. En este método, la evolución estructural se logra mediante la optimización del enjambre de partículas (PSO) que es una técnica de optimización estocástica basada en la población. La técnica de la matriz de caracterización de enlaces se utiliza para mejorar la eficiencia de la búsqueda y eliminar estructuras similares. La característica significativa de CALYPSO requiere solo composiciones químicas para un grupo dado para predecir su estructura. Debido al efecto de polarización de espín, cada estructura inicial se optimizó en posibles estados de espín. Si se encuentra una frecuencia vibratoria imaginaria, se realizará una relajación de la estructura inestable hasta obtener realmente el mínimo local. En todos los cálculos, los umbrales de convergencia se establecieron en 6.0 × 10 −5 Å para el desplazamiento, 1,5 × 10 −5 Hartree / Bohr para las fuerzas y 10 −6 Hartree para una energía total.
Resultados y discusiones
Estructuras geométricas y espectros vibratorios
Para Ag n V ( n =1-12) grupos, se ha realizado una búsqueda estructural extensa y se han obtenido muchos isómeros. La estructura más estable y dos isómeros bajos para cada Ag n Los grupos V se muestran en la Fig. 1. De acuerdo con las energías de menor a mayor, estos isómeros se indican con na, nb y nc, donde n representa el número de átomos de Ag en Ag n Cúmulo V. Su simetría, multiplicidad de espines y diferencia de energía en comparación con cada una de las estructuras más estables también se indican en la figura. Algunos parámetros físicos del estado fundamental Ag n Los grupos de V se recopilan en la Tabla 2. Mientras tanto, para examinar los efectos del dopante V en los grupos de plata, optimizaciones geométricas de Ag n ( n =2–13) se han logrado conglomerados utilizando el mismo método y conjunto de bases. Las estructuras de energía más bajas de Ag n los conglomerados trazados en la Fig. 1 concuerdan bien con el informe anterior [39].
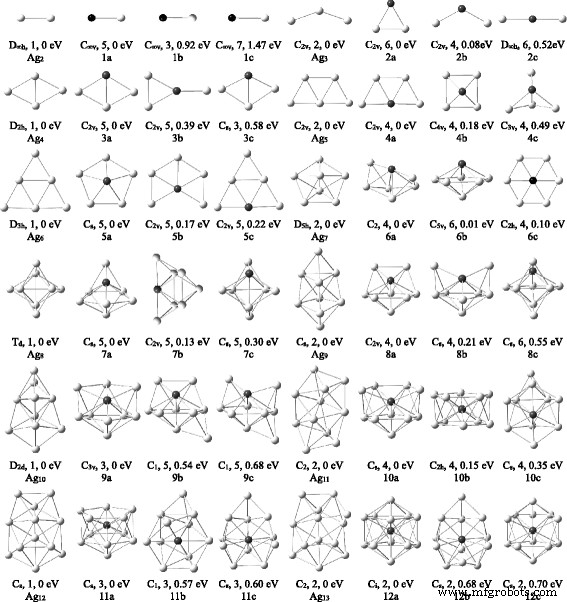
Las estructuras del estado fundamental de Ag n + 1 y Ag n V ( n =2–12) grupos. Dos isómeros bajos para Ag n V racimos. La simetría, la multiplicidad de espines y la diferencia de energía se dan a continuación. Las bolas grises y negras denotan átomos de Ag y V, respectivamente
Los resultados optimizados para el dímero AgV muestran que el estado de giro del quinteto es energéticamente más bajo que los estados de giro del triplete y del septeto en 0.92 y 1.47 eV, respectivamente. Por tanto, el quinteto AgV es la estructura del estado fundamental. La estructura más estable de Ag 2 El grupo V es el triangular 2a con C 2v simetría. La configuración 2a en el estado de espín cuarteto se convierte en el isómero 2b. Los isómeros 3a y 4a, que se asemejan a las estructuras de energía más baja de Ag 4 y Ag 5 clústeres, son el estado fundamental de Ag 3 V y Ag 4 V racimos. La estructura del estado fundamental de Ag 4 El grupo V también está de acuerdo con el resultado de Medel et al. [58]. El isómero 4b con un átomo de V en la parte superior es una pirámide cuadrada y la primera estructura tridimensional (3D). El isómero 4c posee una estructura de bipirámide triangular y su energía total está por encima del isómero 4a en 0,49 eV. Otros isómeros planos y 3D son menos estables que el isómero 4c.
A partir de n =5, las estructuras de energía más bajas de Ag n Los clústeres V prefieren configuraciones 3D. Para evitar omitir el estado fundamental, también utilizamos las estrategias optimizadas de sustituir un Ag por un átomo de V del grupo de plata estable o agregar átomos de Ag a los pequeños Ag n V racimos. Los isómeros 5a y 6a son las estructuras más estables de Ag 5 V y Ag 6 V racimos. Los dos isómeros se obtienen distorsionando la geometría de C 5v y C 2v a C s y C 2 grupos de puntos, respectivamente. El isómero 6a es 0,62 eV menor en el estado de giro del cuarteto que en el estado de giro del sexteto. Los isómeros 5c y 6b son similares a las estructuras del estado fundamental de Ag 6 puro y Ag 7 racimos. El isómero 6b está casi degenerado con el isómero 6a. Debido al efecto Jahn-Teller, el isómero planar 6c con C 2h la simetría tiene una ligera desviación de D 2h simetría.
Con respecto a Ag n V ( n =7-12) grupos, el número de isómeros aumenta rápidamente con el aumento del tamaño del grupo. Las estructuras optimizadas indican que las energías de Ag n Los grupos de V con la misma configuración aumentan con la disminución del número de coordinación del átomo de V. Como resultado, varios Ag n Los isómeros V donde el átomo de V ocupa la posición con el número de coordinación más alto se consideraron más a fondo para asegurarse de que las estructuras más estables sean el mínimo global. Las estructuras de energía más bajas de Ag 7 V, Ag 8 V, Ag 9 V, Ag 10 V, Ag 11 V y Ag 12 Los grupos V son 7a, 8a, 9a, 10a, 11a y 12a en la Fig. 1, respectivamente. Sus geometrías están cualitativamente de acuerdo con los resultados de Medel et al. [58]. Estas estructuras son completamente diferentes de la estructura del estado fundamental del correspondiente Ag n + 1 agrupaciones y contienen una bipirámide pentagonal. El Ag n Isómeros V que corresponden a las estructuras de energía más bajas de Ag n + 1 los grupos se encuentran por encima de cada una de las estructuras del estado fundamental (na). Además, 10b y 12a tienen una ligera desviación de D 5d y D 3d simetría. La configuración de la jaula de Ag 12 El grupo V, donde el átomo V ocupa la posición central, se descubre solo en los estados de espín más bajos.
De los resultados optimizados, se encuentra que el Ag n Los clústeres V tienen una ley de crecimiento obvia. El trapezoide y el icosaedro son dos marcos básicos para el proceso de crecimiento de Ag n Cúmulo V, como se muestra en la Fig. 2. La transición estructural de dos a tres dimensiones para Ag n El clúster V ocurre en n =5. El tamaño de transición de Ag n El grupo V es más pequeño que el de los grupos Ag puros ( n =6). Para n =5–12, los estados fundamentales de Ag n Los grupos V son obviamente distintos de los de Ag n + 1 racimos. El átomo de V en Ag n El grupo V tiende a ocupar la posición más altamente coordinada y es encapsulado gradualmente en el centro por los átomos de Ag. Esto puede atribuirse al principio de superposición máxima en la teoría de complejos de enlaces químicos. Debido a que los átomos de Ag y V tienen más superposición orbital en las circunstancias anteriores, la energía de Ag n El grupo V, que también está relacionado con la disposición de los átomos de Ag, será más bajo y luego el grupo correspondiente será más estable.
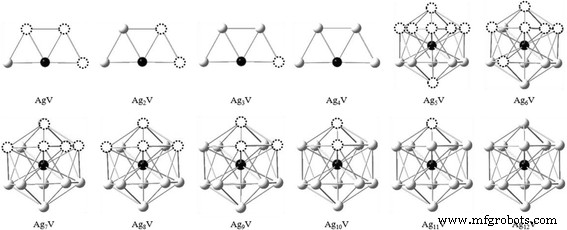
El diagrama de crecimiento de Ag n V ( n =1–12) clústeres
La espectroscopía infrarroja y Raman son herramientas poderosas para la identificación de la estructura del clúster y el componente del material. Generalmente, la identificación estructural se logra comparando los hallazgos experimentales con las predicciones teóricas, lo cual es una parte indispensable. En consecuencia, los espectros infrarrojos y los espectros Raman del Ag n más estable V ( n =1–12) los grupos se muestran en la Fig. 3. El espectro infrarrojo muestra vibraciones asimétricas del grupo polar. El espectro Raman revela las vibraciones simétricas del grupo no polar y el esqueleto. El dímero AgV tiene los mismos espectros infrarrojos y Raman. Para otros Ag n V, la ubicación de fuerte absorción del espectro infrarrojo tiene un pico débil en el espectro de dispersión Raman. Por el contrario, el pico de dispersión Raman es fuerte y la absorción de infrarrojos es débil. La posición del pico en los dos tipos de espectros para todos los isómeros está en el rango de 15 ~ 270 cm −1 . El pico más intenso en el espectro infrarrojo de cada Ag n Los racimos de V están relacionados con la vibración de estiramiento Ag-V.
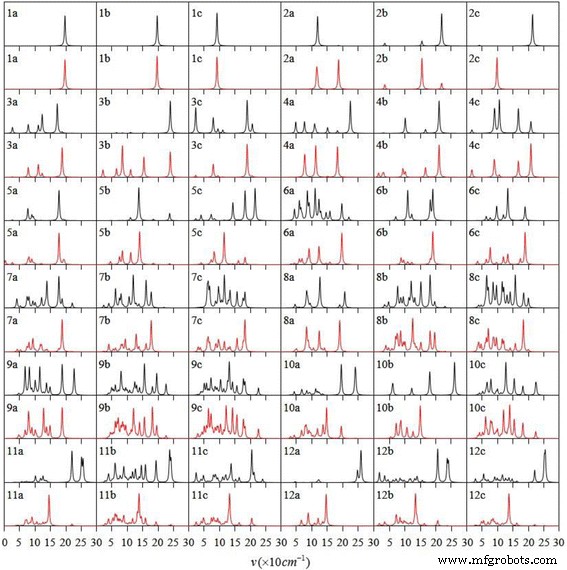
Los espectros infrarrojos (negro) y los espectros Raman (rojo) del estado fundamental y dos isómeros bajos de Ag n V ( n =1–12) clústeres
Propiedades electrónicas
El potencial de ionización vertical (VIP) y la afinidad electrónica (EA) son dos cantidades principales para probar las propiedades electrónicas y se pueden calcular de la siguiente manera:
$$ \ mathrm {VIP} =E \ left (\ mathrm {catiónico} \ \ mathrm {cluster} \ right) -E \ left (\ mathrm {cluster} \ right) $$ (1) $$ \ mathrm {EA } =E \ left (\ mathrm {cluster} \ right) -E \ left (\ mathrm {aniónico} \ \ mathrm {cluster} \ right) $$ (2)donde E (grupo catiónico) y E (cúmulo aniónico) son las energías de un solo punto de los cúmulos catiónicos y aniónicos en la geometría del cúmulo neutro. Para la energía más baja Ag n + 1 y Ag n V grupos, la Tabla 3 enumera el VIP, EA y los valores experimentales disponibles calculados. Los VIP y EA calculados de Ag n + 1 los conglomerados están en consonancia con sus datos medidos. Esta coherencia confirma de nuevo la fiabilidad del enfoque teórico actual. Además, observamos que el dímero AgV tiene el VIP más grande y el EA más pequeño. Esto implica que AgV es difícil de perder o requiere un electrón. El icosaédrico Ag 12 El grupo V tiene el EA más grande y es fácil obtener un electrón más. Ofrecer material de referencia para el experimento de espectroscopia de fotoelectrones en el futuro, los espectros de fotoelectrones teóricos (PES) del estado fundamental y dos estructuras bajas de Ag n V ( n =1-12) se simularon grupos agregando el primer VIP a cada energía orbital ocupada en relación con el HOMO y ajustándolos con un esquema de expansión de Lorentz y un factor de ampliación de 0.1 eV, como se muestra en la Fig. 4. La distribución del nivel de energía de estos grupos está en el rango de 5,5 a 12 eV. Los experimentadores pueden hacer uso de los espectros de PES para distinguir estos grupos.
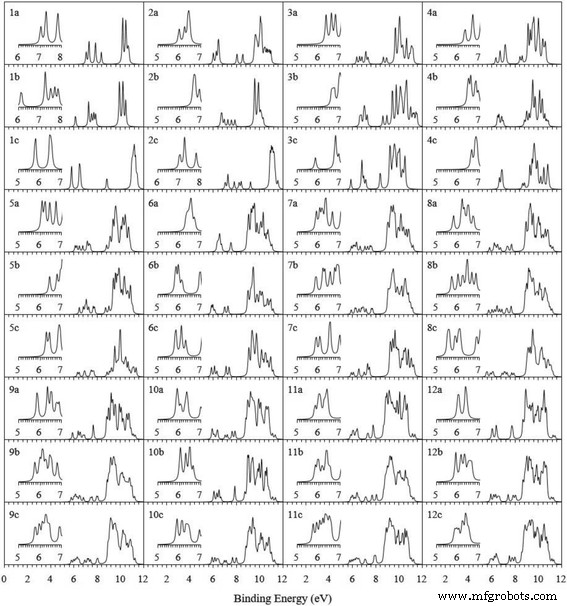
PES simulado del estado fundamental y dos isómeros bajos de Ag n V ( n =1–12) clústeres
Para examinar la influencia del átomo de V en la estabilidad de los racimos de plata, las energías de enlace promediadas atómicas ( E b ) del Ag n más estable + 1 y Ag n Los clústeres de V se pueden estimar de la siguiente manera:
$$ {E} _b \ left ({\ mathrm {Ag}} _ {n + 1} \ right) =\ left [\ left (n + 1 \ right) E \ left (\ mathrm {Ag} \ right) -E \ izquierda ({\ mathrm {Ag}} _ {n + 1} \ derecha) \ derecha] / \ izquierda (n + 1 \ derecha), $$ (3) $$ {E} _ {\ mathrm { b}} \ left ({\ mathrm {Ag}} _ n \ mathrm {V} \ right) =\ left [nE \ left (\ mathrm {Ag} \ right) + E \ left (\ mathrm {V} \ right ) -E \ izquierda ({\ mathrm {Ag}} _ n \ mathrm {V} \ derecha) \ derecha] / \ izquierda (n + 1 \ derecha), $$ (4)donde E (Ag), E (Ag n + 1 ), E (V) , y E (Ag n V) son las energías del átomo de Ag, el grupo de plata, el átomo de V y el Ag n Clúster V, respectivamente. Las energías de enlace calculadas por átomo para el Ag n más estable + 1 y Ag n Los grupos V se representan en la Fig. 5. De esta figura se desprende claramente que el E b de Ag n El clúster V es una función que aumenta monótonamente del tamaño del clúster y es más grande que la de Ag n + 1 clúster para n ≥ 2. Especialmente, el E b de clúster dopado aumentan rápidamente para las estructuras planas y gradualmente para las estructuras 3D. Esto significa que la fuerza de unión entre los átomos se vuelve cada vez más fuerte en el proceso de crecimiento. La sustitución de un átomo de V por un átomo de Ag en Ag n + 1 ( n ≥ 2) los conglomerados evidentemente pueden mejorar la estabilidad de los conglomerados de hospedadores. Por otro lado, la energía de enlace del grupo diatómico debería estar estrechamente relacionada con la longitud del enlace. El E b del dímero de AgV es más pequeño que el de Ag 2 . El cambio anormal puede atribuirse al hecho de que la distancia de enlace de AgV (2,61 Å) es más larga que la de Ag 2 (2,58 Å).
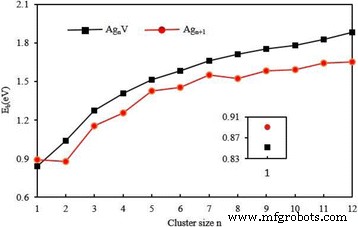
Las energías de enlace promediadas de la energía más baja Ag n + 1 y Ag n V ( n =1–12) clústeres
La estabilidad térmica de los grupos se puede examinar mediante la energía de disociación (DE), que es diferente para los distintos canales de disociación. El canal de disociación más básico es la división de un grupo más grande en dos grupos más pequeños. El DE correspondiente es pequeño en relación con otro canal de disociación. Por lo tanto, los canales de disociación posteriores se investigan para el Ag n más estable V ( n =1–12) clústeres.
$$ {\ mathrm {Ag}} _ n \ mathrm {V} \ to {\ mathrm {Ag}} _ m + {\ mathrm {Ag}} _ {n-m} \ mathrm {V} $$ (5)donde m no es más de n . Las DE de los canales de disociación anteriores se definen de la siguiente manera:
$$ {\ mathrm {DE}} _ m \ left ({\ mathrm {Ag}} _ n \ mathrm {V} \ right) =E \ left ({\ mathrm {Ag}} _ m \ right) + E \ left ( {\ mathrm {Ag}} _ {nm} \ mathrm {V} \ right) -E \ left ({\ mathrm {Ag}} _ n \ mathrm {V} \ right) $$ (6)donde E representa la energía del correspondiente grupo o átomo. Los ED de Ag n Los grupos V para los diferentes canales de disociación se enumeran en la Tabla 4. El DE pequeño indica que el canal de disociación correspondiente es fácil de llevar a cabo. Es decir, es más probable que se produzca el canal de disociación correspondiente a la DE mínima. Puede verse en la Tabla 4 que los canales de disociación más preferidos de Ag n Los clústeres V son Ag n V =Ag + Ag n - 1 V de n =1 y 4–12 y Ag n V =Ag 2 + Ag n - 2 V de n =2 y 3. La DE mínima (2,54 eV) de Ag 12 El cúmulo V es el más grande de todos los cúmulos dopados, lo que implica que el cúmulo icosaédrico es más estable que otros cúmulos. Además, encontramos que la tendencia de cambio de la DE mínima del 3D neutro Ag n V ( n =5–12) el racimo es el mismo que el de las abundancias del Ag catiónico n V + grupo [64, 65]. Sin embargo, no existe tal relación entre planar Ag n V y Ag n V + para n =2–4.
La brecha energética ( E g ) entre el orbital molecular ocupado más alto (HOMO) y el orbital molecular desocupado más bajo (LUMO) siempre se considera una cantidad importante que caracteriza la actividad química de los pequeños grupos de metales. Una gran brecha de energía está relacionada con una alta estabilidad química. Para el estado fundamental Ag n + 1 y Ag n V conglomerados, la figura 6 muestra los huecos de energía en función del tamaño del conglomerado. Se observa una alternancia par-impar en los huecos de energía de los racimos de plata pura. Esta alternancia se puede explicar por el efecto de emparejamiento de electrones, es decir, el efecto de blindaje de electrones de dos electrones que ocupan el mismo HOMO es mucho menor que el de dos electrones que ocupan órbitas diferentes. Un átomo de Ag ([Kr] 4f 14 4 d 10 5 s 1 ) en Ag n + 1 el clúster se sustituye por una V ([Ar] 3 d 3 4 s 2 ) átomo. Para n impares , el caparazón cerrado de Ag n + 1 el clúster es reemplazado por el caparazón abierto de Ag n Cúmulo V. Por supuesto, el E g de Ag n Clúster V con n impares es menor que el de Ag n + 1 grupo. Esta disminución es muy obvia. Incluso para n , tanto Ag n + 1 y Ag n Los racimos V tienen un caparazón sin restricciones. El E g debería depender de sus estructuras. En este caso, notamos que el E g de Ag n V ( n =2 y 4) el clúster con estructura plana es más pequeño que el de Ag n + 1 clúster y el E g de Ag n V ( n =6, 8, 10 y 12) el clúster con estructura 3D es un poco más grande que el de Ag n + 1 grupo. En general, la sustitución de un átomo de V por un átomo de Ag en Ag n + 1 clústeres con incluso n tiene poco efecto en la brecha de energía del clúster anfitrión.
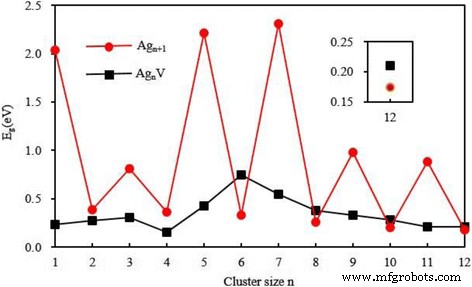
Los huecos de energía HOMO-LUMO del estado fundamental Ag n + 1 y Ag n V ( n =1–12) clústeres
Propiedades magnéticas
La propiedad magnética del clúster se utiliza con frecuencia en la preparación de dispositivos nanoelectrónicos y materiales de almacenamiento magnético de alta densidad. El momento magnético total del cúmulo consiste en el momento magnético de espín y el momento magnético orbital de los electrones. El momento magnético de espín de un electrón es mucho mayor que el momento magnético orbital y, por lo tanto, el momento magnético del cúmulo está dominado por el momento magnético de espín. El momento magnético total de la energía más baja Ag n Grupos de V ( n =1-12) se han calculado los grupos y se presentan en la Fig. 7, donde también hemos representado el momento magnético total de los grupos de huéspedes. Los momentos magnéticos del Ag n más estable + 1 los clústeres se apagan por completo para n impares y son 1 μ B incluso por n . El pequeño Ag n Los racimos V tienen un gran momento magnético. Con el aumento del tamaño del cúmulo, el momento magnético de Ag n Los racimos de V disminuyen en ondas. Cuando n =12, el Ag 12 V tiene el mismo momento magnético que Ag 13 grupo. Esto significa que el dopaje del átomo de V solo puede mejorar el magnetismo de pequeños racimos de plata. Como un esfuerzo por explicar el magnetismo, la figura 8 muestra la densidad de estados de espín (SDOS) para el estado fundamental Ag n V racimos. Es obvio a partir de esta figura que el Ag n Los grupos V tienen algunos dominios magnéticos que disminuyen con el aumento del tamaño de los grupos. Todas las estructuras de energía más baja tienen una banda fuerte entre - 5 eV y - 2,5 eV, que se compone principalmente de la valencia s y d orbitales de los átomos de Ag y V. Los niveles de energía cerca del HOMO, E - E HOMO =- 1 ~ 0 eV, actúa como un papel clave en la determinación del comportamiento magnético de Ag n Grupos de V.
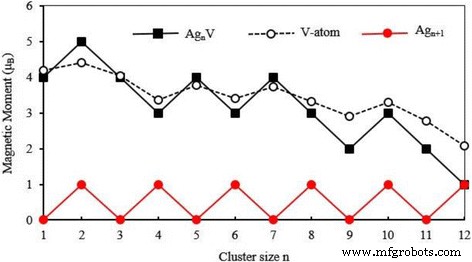
Momento magnético total del estado fundamental Ag n + 1 y Ag n V ( n =1–12) grupos y momento magnético local en el átomo de V
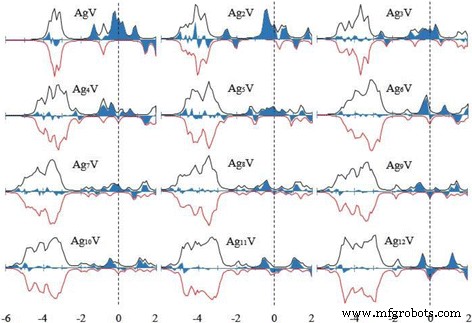
El SDOS del estado fundamental Ag n V ( n =1–12) grupos. El giro hacia arriba es positivo y el giro hacia abajo es negativo. Se utiliza un factor de ensanchamiento δ =0,1 eV. Girar hacia arriba menos girar hacia abajo es la parte azul. La línea discontinua indica la ubicación del nivel HOMO
Para explorar más las propiedades magnéticas, hemos llevado a cabo el análisis orbital de enlace natural para el Ag n más estable Grupos V [66]. Los momentos magnéticos locales en el átomo de V son 4.18 μ B para AgV, 4,41 μ B para Ag 2 V, 4,03 μ B para Ag 3 V, 3,36 μ B para Ag 4 V, 3,78 μ B para Ag 5 V, 3,40 μ B para Ag 6 V, 3,73 μ B para Ag 7 V, 3,33 μ B para Ag 8 V, 2,91 μ B para Ag 9 V, 3,29 μ B para Ag 10 V, 2,77 μ B para Ag 11 V y 2,08 μ B para Ag 12 V, como se muestra en la Fig. 7. En general, el momento magnético del átomo de V disminuye gradualmente a medida que aumenta el tamaño de los grupos. El momento magnético proporcionado por los átomos de Ag es muy pequeño. Además, a excepción de Ag 2 V, Ag 5 V y Ag 7 V grupos, el momento magnético total de los átomos de Ag en otros grupos dopados exhiben la alineación antiferromagnética con respecto al momento magnético del átomo V. En otras palabras, los momentos magnéticos totales de todos los Ag n Los grupos V se derivan principalmente del átomo paramagnético V, como se muestra en la Fig. 7.
El momento magnético local y la carga en 4 s , 3 d , 4 p y 4 d capas de átomo de V en la energía más baja Ag n Los grupos V se enumeran en la Tabla 5. Se puede ver en esta tabla que los 3 d parcialmente ocupados Shell juega un papel crucial en la determinación del magnetismo del átomo de V y su momento magnético es 2.01 ~ 3.82 μ B . Los 4 s y 4 p las capas, que no son magnéticas para un átomo de V libre, producen un poco del momento magnético. Los 4 d la cáscara es casi no magnética. La carga del 3 d y 4 p conchas aumenta en 0,77–1,97 y 0,03–2,41 e respectivamente. Especialmente, la carga en el 4 p orbital aumenta con el aumento del tamaño de los conglomerados. Se encuentra muy poca carga en el 4 d órbita del átomo de V en Ag n V ( n =4–12) grupo. Sin embargo, el cargo en 4 s shell se reduce en 1.02–1.54 e . La transferencia de carga sugiere que el átomo de V en Ag n V clusters tiene una hibridación entre s , p y d conchas. Como sabemos, el átomo de V aislado tiene cinco electrones de valencia. Al mismo tiempo, la carga del átomo de V en Ag n El grupo V se puede obtener de la Tabla 5. A partir del principio de conservación de carga, 0.10-0.21 e transferencia del átomo de V a los átomos de Ag para el planar Ag n V ( n =1–4) clústeres, mientras que 0,35–2,92 e de átomos de Ag a átomos de V para el 3D Ag n V ( n =5–12) grupos, como se muestra en la Fig. 9. Si M y C denotar el momento magnético y el electrón de valencia del átomo de V en Ag n Grupos de V, tanto la variación del momento magnético ( ΔM = M - 3) y transferencia de carga ( ΔC =5 - C ) tienen la misma tendencia cambiante, como se muestra en la Fig. 10. De la Fig. 10 se puede concluir que la transferencia de carga debería ser la razón de la modificación del momento magnético del átomo de V en Ag n Grupos de V.
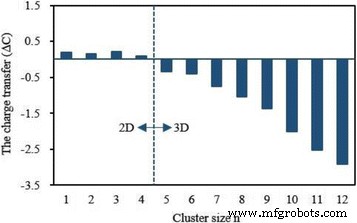
La transferencia de carga del átomo de V en el Ag n más estable V ( n =1–12) grupos. Átomo de V libre como punto de referencia
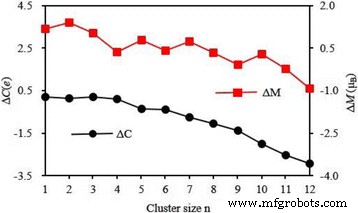
La transferencia de carga (ΔC) y el cambio de momento magnético (ΔM) del átomo de V en el Ag n más estable V ( n =1–12) clústeres
Conclusiones
Las propiedades estructurales, electrónicas y magnéticas de Ag n V ( n =1–12) los conglomerados se han investigado sobre la base del método de búsqueda de estructuras DFT y CALYPSO. Los resultados indican un átomo de V en la energía más baja Ag n El grupo V tiende a ocupar la posición con el número de coordinación más alto. La sustitución de un átomo de Ag en Ag n + 1 ( n ≥ 5) agrupación por un átomo de V cambia la geometría de las agrupaciones anfitrionas. The infrared spectra, Raman spectra, and PES of Ag n V (n = 1–12) clusters are expected to identify the ground states in times to come. Aside from AgV, the stability of other Ag n V cluster is higher than that of Ag n + 1 cluster. The relatively easy dissociation channels are Ag n V = Ag + Agn − 1 V for n = 1 and 4–12 and Ag n V = Ag2 + Ag n − 2 V for n = 2 and 3. The chemical activity of Ag n V cluster with odd n is higher than that of Ag n + 1 racimos. The magnetic moments of Ag n V clusters originate mainly from the doped V atom and decrease gradually from 5 to 1 μ B with the increase of cluster size. The change of magnetic moment may be attributed to the charge transfer between V and Ag atoms.
Abreviaturas
- 3D:
-
Tridimensional
- DE:
-
Dissociation energy
- DFT:
-
Teoría funcional de la densidad
- EA:
-
Electron affinity
- HOMO:
-
Highest occupied molecular orbital
- LUMO:
-
Lowest unoccupied molecular orbital
- PSO:
-
Particle swarm optimization
- VIP:
-
Vertical ionization potential
Nanomateriales
- ¿Qué es la aleación de cobalto y cuáles son las propiedades de la aleación de cobalto?
- ¿Cuáles son las aplicaciones y propiedades del acero al manganeso?
- Preparación y propiedades magnéticas de nanopartículas de espinela de FeMn2O4 dopadas con cobalto
- El reordenamiento atómico de múltiples pozos cuánticos basados en GaN en gas mixto H2 / NH3 para mejorar las propiedades estructurales y ópticas
- Presentación de la estructura atómica y electrónica de las nanofibras de carbono de copa apilada
- Estructura y propiedades electrónicas de la nanoarcilla de caolinita dopada con metal de transición
- Modulación de las propiedades de anisotropía óptica y electrónica de ML-GaS por campo eléctrico vertical
- El efecto del plasma de no equilibrio por contacto sobre las propiedades estructurales y magnéticas de Mn Х Fe3 - X О4 Espinelas
- Película de condensador:propiedades, construcción y aplicación
- Propiedades de PCB automotriz y consideraciones de diseño
- ¿Cuál es la diferencia entre electrónico y eléctrico?



