La liberación sucesiva de inhibidores tisulares de metaloproteinasa-1 a través del sistema de administración a base de óxido de grafeno puede promover la regeneración de la piel
Resumen
El propósito de este estudio fue atestiguar la hipótesis de que el óxido de grafeno (GO) podría actuar como un vehículo apropiado para la liberación de inhibidores tisulares de la proteína metaloproteinasa-1 (TIMP-1) en el contexto de la reparación de la piel. Las características de GO se observaron mediante microscopía electrónica de barrido, microscopía de fuerza atómica y análisis gravimétrico térmico. Después de que TIMP-1 absorbiera GO, se compararon los perfiles de liberación de varias concentraciones de TIMP-1 de GO. La biocompatibilidad de GO con la viabilidad de los fibroblastos se evaluó midiendo el ciclo celular y la apoptosis. Se utilizaron ensayos de cicatrización de heridas in vivo para determinar el efecto de TIMP-1-GO sobre la regeneración de la piel. La mayor intensidad de GO fue de 1140 nm y el volumen de mayor intensidad fue de 10 674,1 nm (nanómetros). Se demostró que TIMP-1 se libera continuamente durante al menos 40 días desde GO. La proliferación y viabilidad de los fibroblastos de rata cultivados con TIMP-1-GO no fueron significativamente diferentes en comparación con las células cultivadas en GO o TIMP-1 solo ( p > 0,05). El defecto cutáneo de ratas tratadas con TIMP-1 y TIMP-1-GO mostró diferencias significativas en las puntuaciones histológicas e inmunohistoquímicas ( p <0,05). GO se puede controlar para liberar materiales portadores. La combinación de TIMP-1 y GO promovió la progresión de la regeneración del tejido cutáneo en los defectos cutáneos.
Antecedentes
Las lesiones cutáneas pueden deberse a muchos factores, como accidentes, complicaciones diabéticas, quemaduras o cirugía superficial [1]. El trasplante de piel autógeno, o los biopolímeros utilizados para la fabricación de la piel artificial, representa el método más común utilizado para el cierre de heridas [2]. Estos sustitutos pueden incluir una limitación del tejido blando del donante disponible, especialmente en pacientes con quemaduras graves [3], infección [4], dolor y necrosis del colgajo de piel [5], retraso en la cicatrización y biocompatibilidad del material.
El inhibidor tisular de la metaloproteinasa-1 (TIMP-1) evita que la matriz extracelular (MEC) se descomponga formando un complejo inhibidor con las metaloproteinasas de la matriz (MMP) [6, 7]. Las proteínas TIMP también controlan el recambio impulsado por MMP y el procesamiento de los factores de crecimiento, así como las citocinas vinculadas a la reparación y regeneración de heridas [8]. Los TIMP y MMP se regulan durante la cicatrización normal de heridas y su desequilibrio se ha relacionado con defectos de reparación de la piel, queloides y fibrosis [9]. El TIMP-1 derivado del epitelio puede regular la epitelización en diferentes etapas, ya sea directa o indirectamente. Una fase importante de la reparación de la herida por escisión y la regeneración de la piel es la reepitelización, que es el nuevo crecimiento del epitelio sobre una superficie traumática [10]. La reepitelización ocurre cuando las células en el margen de la herida aflojan sus contactos célula-célula y célula-ECM y comienzan a migrar a través de la herida. Estos procesos se han relacionado con la biología TIMP-1 [11].
Un sistema de administración regional óptimo de TIMP-1 para la restauración de la piel depende del vehículo de administración utilizado. Se han desarrollado algunos vehículos de distribución diseñados para liberar citocinas [12]. Los portadores incluyen PLGA (poli (ácido láctico-co-glicólico)) [13], quitosano [14], nanoesferas de PLGA [15] e hidrogeles. El uso de un vehículo de administración ayudaría a reducir la dosis de TIMP-1 para la regeneración de la piel y permitiría una administración regional del agente. El grafeno está compuesto por átomos de carbono con una monocapa plana y una estructura bidimensional en forma de panal [16]. El óxido de grafeno (GO) se ha utilizado como vehículo de administración de fármacos de molécula pequeña en la literatura, ya que tiene una carga (absorción) eficiente, es biocompatible y tiene una baja toxicidad [17,18,19]. Las características esenciales de GO incluyen π hidrofóbico dominios en el núcleo de la estructura con regiones ionizadas a lo largo de los bordes. El distintivo π - π La interacción de apilamiento hace que GO sea eficiente con solubilidad en agua, con una gran área de superficie específica para una alta capacidad de carga [20, 21].
En el presente estudio, hemos investigado si la proteína TIMP-1 humana recombinante se puede emparejar con GO como vehículo de administración para mejorar la regeneración de la piel. Para investigar el efecto sobre la regeneración de la piel, se cargó TIMP-1 en escamas de GO, y su liberación y toxicidad se midieron in vitro a través de fibroblastos de rata. Los resultados finalmente se prueban en ratas donde se usa un modelo de herida en la piel.
Materiales y métodos
Cultivo celular
Los fibroblastos de rata se compraron en el Instituto de Bioquímica y Biología Celular, CAS (Shanghai, China) y se cultivaron en medio Eagle modificado por Dulbecco (DMEM, GibcoBRL, Gaithersburg, MD, EE. UU.) Que contenía un 10% ( v / v ) suero fetal bovino (FBS, Gibco). El medio se cambió cada 2 días. Todas las células se mantuvieron a 37 ° C.
Caracterización de GO
Las escamas de GO se adquirieron de la Academia China de Ciencias de Chengdu Organic Chemicals Co., Ltd. (Chengdu, China) y se caracterizaron usando microscopía electrónica de barrido (SEM, JSM-6701F, JEOL, Tokio, Japón) después del recubrimiento con platino. Las muestras se escanearon con un microscopio electrónico de barrido (Hitachi S3000N) a un voltaje de aceleración de 15 kV. La distribución de tamaño de las escamas de GO se determinó con un espectrofotómetro basado en potencial eléctrico zeta (Zetasizer 3000 HSA, Malvern, Reino Unido). La morfología de las escamas de GO se determinó mediante microscopía de fuerza atómica (AFM, MultiMode, VEECO, EE. UU.) Junto con un microscopio invertido (microscopio invertido IX71, Olympus, Tokio, Japón). El análisis termogravimétrico y la calorimetría diferencial de barrido se realizaron utilizando un analizador termogravimétrico TGA / DSC (Pyris 1 TGA, Perkin-Elmer, EE. UU.) Colocando las muestras en bandejas de alúmina y aplicando una rampa de calentamiento de 25 a 1100 ° C a 10 ° C / min.
Adsorción TIMP-1 en GO
Los copos de GO se marcaron con perclorato de 1,1-dioctadecil-3,3,3,3-tetram-etilindocarbocianina (DiI, rojo, Sigma) antes de la adsorción de TIMP-1 recombinante humano (Huaan Co., Hangzhou, China). Para la adsorción de TIMP-1, se agregaron TIMP-1 (Huaan Co., Hangzhou, China) conjugado con isotiocianato de fluoresceína (FITC, verde, Thermo Scientific, Rockford, IL, EE. UU.) Y GO marcado con DiI a solución salina tamponada con fosfato (PBS ) y se incubó durante 4 ha 4 ° C. La relación de GO a TIMP-1 recombinante fue de 1:1 en peso. Para determinar la carga de TIMP-1 en GO, se añadió TIMP-1 (1 μg) a 20 μl de PBS que contenía GO y se incubó durante 4 ha 4 ° C. Se visualizó TIMP-1 adsorbido en GO utilizando un microscopio confocal de barrido láser (microscopio invertido IX81-FV1000, Olympus). Para confirmar la adsorción de TIMP-1 en GO, se realizó espectroscopia infrarroja transformada de Fourier (FTIR) usando una espectroscopia Nicolet 5700 (ThermoFisher Co., SGE, Australia) en gránulos (10 mm de diámetro) preparados mezclando 2 mg de GO con 100 mg KBr y prensado para producir el pellet a analizar. Los espectros se analizaron después de la corrección de la línea de base mediante el software EZ OMNIC (Nicolet).
Cinética de liberación de la proteína TIMP-1
Los perfiles de liberación de TIMP-1 a partir de varias concentraciones de GO (10, 20 y 30 μg / ml) se determinaron utilizando un ensayo inmunoabsorbente ligado a enzimas específico de TIMP-1 humano comercial (ELISA, R&D Systems Inc., Minneapolis, MN, EE. EE.UU). Después de la incubación durante 4 ha 4 ° C, un ELISA del sobrenadante mostró que prácticamente todo el TIMP-1 se adsorbió en el GO. El GO cargado con TIMP-1 se suspendió en placas de cultivo de 60 mm que contenían 1,5 ml de PBS. A continuación, las placas se incubaron a 37 ° C. En varios puntos de tiempo, se recogió el sobrenadante después de una agitación continua y se añadió tampón nuevo a las placas de cultivo. La concentración de TIMP-1 humano en el sobrenadante se determinó mediante ELISA.
Ensayo de biocompatibilidad GO
Se añadieron veinte microgramos por mililitro de copos de GO cargados con una concentración de 20 µg / ml de TIMP-1 a cultivos de fibroblastos de rata, y las células se cultivaron durante 6, 24, 48 y 72 h. La viabilidad celular se evaluó utilizando el ensayo de conteo de células 8 (CCK8) como se describe en las instrucciones del fabricante. La absorbancia de la muestra se expresó como valor de absorbancia a 450 nm ( n =5 para cada grupo).
Caracterización citométrica de flujo
Los fibroblastos se recolectaron mediante tripsinización y se marcaron con Hoechst 33258 y Anexina-V-FITC / PI. La actividad del ciclo celular y la apoptosis celular se determinaron posteriormente mediante un kit de análisis de citometría de flujo (Lianke, Hangzhou, China). El marcaje se realizó durante 30 min a 4 ° C en presencia de reactivo de bloqueo (Lianke, Hangzhou, China), seguido de dos pasos de lavado usando PBS. Después de lavar y fijar, al menos 10 4 se adquirieron y analizaron las células. El análisis de citometría de flujo se realizó con un Becton Dickinson FACSCanto II.
Experimento in vivo
Todos los procedimientos experimentales se llevaron a cabo de acuerdo con las directrices de los NIH de EE. UU. Los animales para los procedimientos experimentales fueron aprobados por el Comité de Ética de la Universidad de Zhejiang. A ratas macho Sprague-Dawley de cuatro semanas de edad se les administró cirugía de defectos cutáneos (SDS) como se describió anteriormente (Fig. 4a) [22]. El tamaño de la defección cutánea fue de 10 x 10 mm. Después de la cirugía, los animales fueron devueltos a sus jaulas individuales. Catorce días después de la SDS, los animales se dividieron aleatoriamente en cuatro grupos y se inició la terapia. Inyecciones locales de agente de control (solo 4 ml de PBS), agente GO (4 ml GO con PBS, 1:20), agente TIMP-1 (4 ml TIMP-1 con PBS 1:20) o agente TIMP-1-GO (4 ml GO con TIMP-1, 1:1 v / w ) se administraron por vía subcutánea. Las inyecciones se realizaron cada semana alrededor del defecto de la piel (un total de 4 puntos, 1 ml cada uno) para un total de dos tratamientos en un lapso de 2 semanas. Las ratas se sacrificaron 4 semanas después de la cirugía (Fig. 4a). La piel regenerada se diseccionó, se incrustó en parafina y se investigó mediante tinción con hematoxilina-eosina y tinción de Masson.
Análisis histológico e inmunohistoquímico
Las pieles regeneradas se fijaron en formalina al 4% durante 72 h. Luego, las muestras se descalcificaron en ácido fórmico al 9% durante 2 semanas a temperatura ambiente. Las muestras de piel se deshidrataron con etanol graduado. Las secciones consecutivas se tiñeron con hematoxilina-eosina (HE) y Masson. La expresión de CD34 en el defecto de la piel se analizó mediante tinción inmunohistoquímica. Las secciones se desparafinaron en xileno y se hidrataron a través de alcoholes graduados. Después de bloquear con suero de cabra al 1% (dilución 1:100, Sigma), las secciones se incubaron con anticuerpos primarios contra CD34 (Abcam, Cambridge, Reino Unido) durante la noche a 4ºC. Después de lavar con PBS tres veces, las secciones se incubaron con anticuerpo secundario durante 1 ha 37 ° C. La tinción se desarrolló con solución de 3,3′-diaminobencidina (DAB) (Dako, Hamburgo, Alemania). La piel regenerada fue observada por tres observadores entrenados. Las secciones inmunohistoquímicas se clasificaron utilizando el porcentaje de DBA.
Análisis estadístico
Todos los experimentos se repitieron tres veces y los datos se presentaron como media ± desviación estándar. El ANOVA de una vía y la prueba post hoc de Student-Newman-Keuls determinaron el nivel de significancia. p los valores inferiores a 0,05 y 0,01 se consideraron respectivamente significativos y altamente significativos. El análisis estadístico se realizó con SPSS 17.0 (SPSS Inc., Chicago, EE. UU.).
Resultados
Caracterización de GO
La representación 2D de las imágenes GO se muestra en AFM (Fig. 1a). Un SEM mostró que las escamas GO eran láminas de forma irregular (Fig. 1b). La distribución de tamaño de las escamas de GO se midió mediante un espectrofotómetro basado en potencial eléctrico. La mayor intensidad de distribución de tamaño fue de 1140 nm y el volumen de mayor intensidad del GO fue de 10 674,1 nm (Fig. 2a).
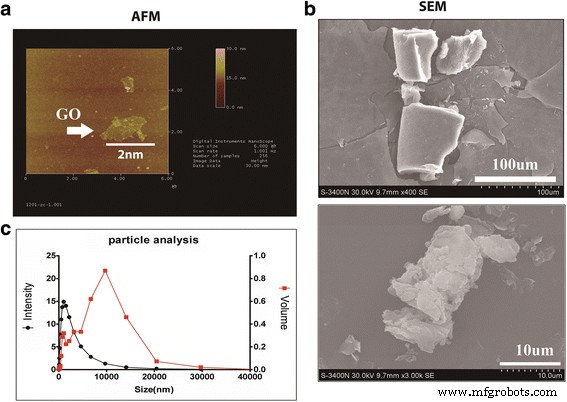
Vaya absorción. un Representación 2D de imágenes GO mostradas en AFM. b SEM muestra que las escamas GO son láminas de forma irregular. Los copos de GO eran láminas de forma irregular. c La distribución de tamaño de las escamas GO. La mayor intensidad fue de 1140 nm y el volumen de mayor intensidad fue de 10 674,1 nm
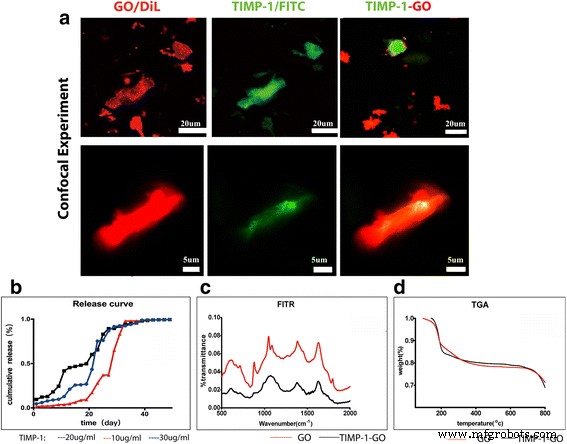
Caracterización GO y TIMP-1-GO. un TIMP-1 se absorbió en GO. El análisis reveló que el 75 ± 1,2% de GO se absorbió en TIMP-1. b Se registraron los perfiles de liberación acumulativa de TIMP-1. TIMP-1 incrustado en GO representa un sistema adecuado para la liberación prolongada de TIMP-1 alrededor de 40 días. c La composición química entre GO y TIMP-1-GO se investigó mediante espectroscopía FTIR. La forma de onda y el pico de onda de GO fueron significativamente diferentes de los de TIMP-1-GO. d La curva de análisis gravimétrico térmico no muestra diferencias importantes entre GO y TIMP-1-GO de 50 a 800 ° C. La curva de análisis gravimétrico térmico no mostró diferencias apreciables entre el control GO y TIMP-1-GO
Adsorción TIMP-1 en GO
Lo que sigue es la incubación de TIMP-1 conjugado con FITC (verde) y GO marcado con DiI (rojo) en PBS durante 4 h; TIMP-1 se adsorbió sobre el GO. El análisis reveló que el 75 ± 1,2% de GO se absorbió en TIMP-1 después de 4 h, lo que sugirió que GO se une eficazmente a la proteína TIMP-1 (Fig. 1c). Investigamos la composición química de TIMP-1-GO usando espectroscopia FTIR (Fig. 2b). La forma de onda y el pico de onda de GO fueron significativamente diferentes de los de TIMP-1-GO. Además, investigamos el análisis gravimétrico térmico entre el control GO y TIMP-1-GO (Fig. 2d). La curva de análisis gravimétrico térmico no mostró diferencias apreciables entre el control GO y TIMP-1-GO.
Versión TIMP-1
Se cargaron en GO varias concentraciones de TIMP-1 (grupo 1 3 μg / ml, grupo 2 2 μg / ml y grupo 3 10 μg / ml). Los perfiles de liberación acumulativa de TIMP-1 se muestran en la Fig. 2c. La liberación de TIMP-1-GO de 2 μg / ml alcanzó una liberación acumulada del 50% más rápidamente en comparación con la dosis de TIMP-1 de 10 y 30 μg / ml. TIMP-1 se liberó de forma continua durante unos 40 días. Esto sugiere que la aplicación de TIMP-1 incrustado en GO puede representar un sistema adecuado para la liberación prolongada de TIMP-1 (Fig. 2c).
Viabilidad y proliferación celular en TIMP-1-GO
La proliferación y viabilidad de los fibroblastos de rata cultivados en el control, GO y TIMP-1, no fueron apreciablemente diferentes a las de las células cultivadas en las diferentes muestras de TIMP-1-GO ( p > 0,05). El ciclo celular y la apoptosis de los fibroblastos cultivados en el control, GO y TIMP-1, no fueron apreciablemente diferentes al de las células cultivadas en las muestras de TIMP-1-GO ( p > 0.05) (Fig. 3a – c).
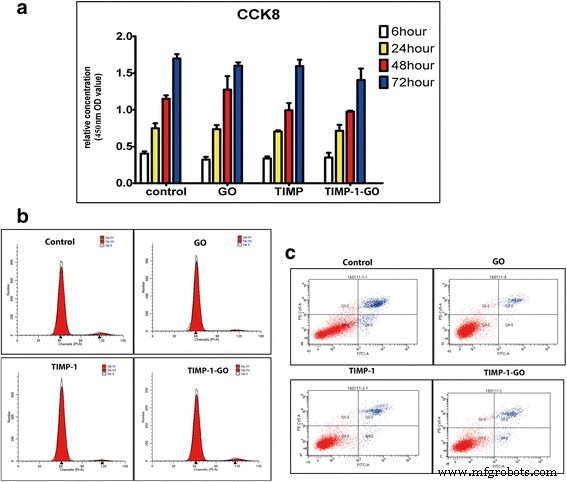
El efecto de TIMP-1-GO sobre la proliferación y viabilidad de células de fibroblastos de rata. un La viabilidad de los fibroblastos cultivados en diferentes grupos no muestra diferencias significativas en diferentes puntos de tiempo ( p > 0,05). b El ciclo celular de los fibroblastos no fue significativamente diferente al de las células cultivadas en diferentes grupos ( p > 0,05). c La apoptosis celular de los fibroblastos no fue significativamente diferente a la de las células cultivadas en diferentes grupos ( p > 0,05)
Eficacia de TIMP-1-GO en el modelo de herida cutánea por escisión
Se administró TIMP-1-GO por vía subcutánea a ratas para determinar si podía promover la curación de la herida experimental. Cuatro semanas después de la cirugía, en comparación con el grupo de control, los defectos cutáneos tratados con TIMP-1-GO mostraron diferencias significativas en el punto terminal ( p <0.05), mientras que los defectos cutáneos tratados con TIMP-1 mostraron diferencias significativas con el grupo control y el grupo GO en el punto terminal ( p <0,05). Además, el grupo TIMP-1-GO mostró un efecto terapéutico mejorado en la regeneración de los folículos pilosos ( p <0,05). Los defectos cutáneos tratados con TIMP-1 mostraron diferencias significativas con el grupo de control y el grupo GO en el punto terminal ( p <0.05) (Figura 4b).
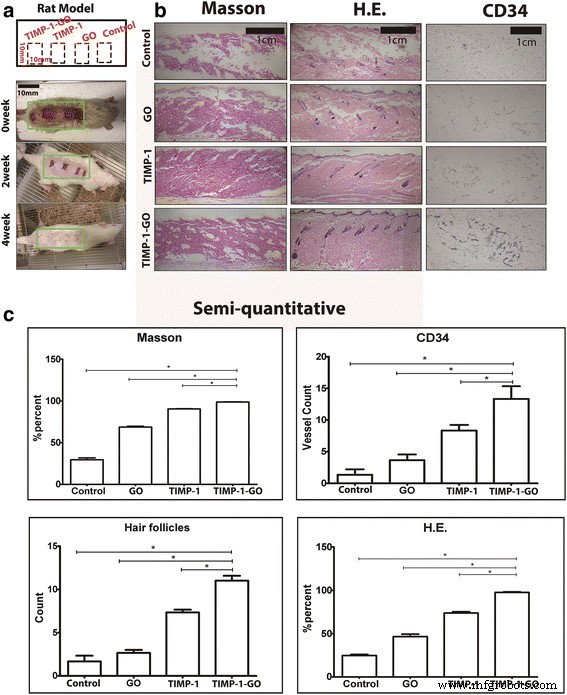
Experimento in vivo. un Esquema y SDS y modelo. b Análisis histológico e inmunohistoquímico in vivo (1 cm). La fibra de colágeno continua es visible en el grupo TIMP-1-GO. c La evaluación cuantitativa reveló diferencias significativas entre el control y GO en comparación con TIMP-1 y TIMP-1-GO ( p <0,05). Los folículos pilosos de diferentes grupos fueron significativamente diferentes ( p <0,05). Los defectos de la piel tratados con TIMP-1 mostraron diferencias significativas con el grupo de control y el grupo GO por semicuantitativo ( p <0.05)
Análisis histológico e inmunohistoquímico
Las características histológicas de la regeneración de la piel después del tratamiento con PBS se muestran en la Fig. 4b. Las características en los grupos de control después del defecto de la piel muestran fibra de colágeno rota visible en las muestras 4 semanas después del tratamiento. Por el contrario, la fibra de colágeno continua es visible en los grupos TIMP-1-GO en el mismo momento y muestra una diferencia estadística en comparación con el grupo de control. Las características inmunohistoquímicas de la vascularización después del tratamiento con TIMP-1-GO se muestran en la figura 3c. Las células subcutáneas CD34 + son visibles en las muestras después de 4 semanas en los grupos tratados con TIMP-1-GO. La evaluación cuantitativa reveló diferencias significativas entre los grupos de control y el grupo de tratamiento TIMP-1-GO ( p <0.05) (Figura 4c).
Discusión
En el presente estudio, hemos analizado un nuevo enfoque potencial para mejorar la reparación de heridas por escisión mediante la combinación de la proteína TIMP-1 recombinante con la liberación controlada de GO. GO ha demostrado una buena biocompatibilidad in vitro. Y se muestra que TIMP-1 se libera continuamente del vehículo GO durante hasta 40 días. Se ha demostrado que la combinación de TIMP-1 con GO promueve la vascularización y la regeneración del colágeno en un modelo experimental de defectos cutáneos.
Se ha evaluado una variedad de materiales biomédicos como vehículos de terapia para la administración de agentes en la regeneración de tejidos. Los vehículos como el colágeno, la seda, el titanio, el cemento de fosfato cálcico y el ácido poliláctico-ácido poliglicólico tienden a producir una liberación rápida de agentes biológicos que pueden no ser deseados en algunos contextos terapéuticos [23]. Por tanto, la capacidad de un vector biomédico para proporcionar una liberación lenta y continua de moléculas biológicas puede considerarse una característica importante. Un requisito para esta calidad es un flexible utilizado para cargar el fármaco con la ayuda de una carga eléctrica [24]. El óxido de grafeno (GO) proporciona un efecto "inicial" que ha demostrado su utilidad para la liberación lenta de varios agentes biológicos tanto in vitro como in vivo [25,26,27]. Aquí, mostramos que GO se puede utilizar para ejercer una liberación sostenida de la proteína TIMP-1 humana recombinante. La interacción entre π hidrofóbico Los dominios de GO y la interacción electrostática pueden activar los dominios cargados negativamente de GO y permitir la absorción eficiente de la proteína TIMP-1 para GO a través de las regiones hidrofóbicas internas. La liberación prolongada de TIMP-1 de GO es ideal para la revascularización necesaria en la reparación de heridas dérmicas.
Se sugiere que las partículas de carbono con una concentración de más de 50 mg / ml podrían depositarse en los tejidos [28]. Wang y col. sugirió que esto puede causar reacciones inflamatorias debido a su diámetro extremadamente pequeño pero una gran superficie funcional de GO [29]. A diferencia de estudios anteriores, en nuestro estudio no se detectó depósito de GO. Dada la falta de un efecto secundario obvio visto aquí, no se puede respaldar el potencial negativo de las nanopartículas de GO. Otros estudios han sugerido sobre el grafeno, incluida la respuesta biológica y la prueba de seguridad [30].
La investigación sobre el efecto de la interacción del óxido de grafeno en las células es un tema importante. El grafeno es un material biomédico de reciente desarrollo cuyas propiedades sugieren su uso en muchas aplicaciones biológicas. Sin embargo, la biología potencial de la estructura de carbono bidimensional / toxicología del grafeno y las interacciones biológicas generales no se comprenden completamente, lo que requerirá estudios adicionales extensos.
Conclusión
El óxido de grafeno (GO) muestra una biocompatibilidad sostenida cuando se utiliza como vehículo para la liberación lenta de TIMP-1 recombinante. Se ha demostrado que TIMP-1 se libera continuamente de GO durante hasta 40 días, y se ha demostrado que la combinación de TIMP-1 con GO promueve la revascularización y la regeneración del colágeno en un modelo de regeneración de la piel.
Nanomateriales
- Sistema de inyección sin aguja
- Piel artificial
- Nanopartículas de fósforo negro promueven la diferenciación osteogénica de EMSC a través de la expresión TG2 regulada hacia arriba
- Marcos metal-orgánicos sensibles al medio ambiente como sistema de administración de fármacos para la terapia tumoral
- Pez cebra:un sistema modelo en tiempo real prometedor para la administración de fármacos neuroespecíficos mediada por nanotecnología
- Transparencia inducida por plasma sintonizable dinámicamente en un sistema de guía de ondas acoplado por nanocavidad asimétrico basado en grafeno en chip
- Nanotecnología:del sistema de imágenes in vivo a la administración controlada de fármacos
- Evaluación de estructuras de grafeno / WO3 y grafeno / ceO x como electrodos para aplicaciones de supercondensadores
- Sistema de seguimiento de movimiento 3D para tecnología autónoma
- Un dispositivo portátil diagnostica el cáncer de piel
- Tres mitos sobre CAN



