Nanoadsorbente funcionalizado para la separación por afinidad de proteínas
Resumen
Nanoesferas de sílice funcionalizadas con tiol (SiO 2 -SH NSs) con un diámetro promedio de 460 nm se sintetizaron a través de una ruta hidrotermal. Posteriormente, el SiO 2 preparado -SH NS fueron modificados por SnO 2 puntos cuánticos para proporcionar SnO 2 / SiO 2 NS compuestas que poseen una fluorescencia obvia, que podría usarse para rastrear la proteína diana. El SnO 2 / SiO 2 Los NS se modificaron aún más mediante glutatión reducido (GSH) para obtener SnO 2 / SiO 2 -GSH NS, que pueden separar específicamente el glutatión S proteína etiquetada con transferasa (etiquetada con GST). Además, la actividad peroxidasa de la glutatión peroxidasa 3 (GPX3) se separó del SnO 2 / SiO 2 -Se evaluaron NS de GSH in vitro. Los resultados muestran que el SnO 2 preparado / SiO 2 -GSH NS exhiben adsorción inespecífica insignificante, alta concentración de unión a proteínas (7,4 mg / g) y buenas propiedades reutilizadas. Mientras tanto, el GPX3 marcado con GST separado por estos NS puede retener su estado redox y actividad peroxidasa. Por lo tanto, el SnO 2 preparado / SiO 2 -GSH NS puede encontrar una aplicación prometedora en la rápida separación y purificación de proteínas etiquetadas con GST.
Antecedentes
La fácil separación y purificación de proteínas son muy importantes en la biotransformación xenobiótica, el metabolismo de fármacos, la biosíntesis de prostaglandinas y hormonas esteroides y la degradación de aminoácidos aromáticos [1, 2, 3, 4, 5, 6]. Las proteínas separadas pueden usarse para la producción de antígenos y vacunas, inmunología molecular y estudios estructurales y bioquímicos y biológicos celulares. Glutatión S -transferasa (GST) representa un grupo importante de isoenzimas de desintoxicación que se pueden utilizar en el sistema de fusión de genes GST y en el campo de dirección del efecto de la medicina o como marcadores tumorales [7, 8]. Actualmente se encuentran disponibles varios métodos como precipitación, cromatografía, ultrafiltración y diálisis para purificar diversas proteínas y, en particular, la separación por afinidad basada en la afinidad biológica natural entre macromoléculas biológicas y ligandos complementarios tiene una importancia extraordinaria [9,10,11,12 , 13,14]. Sin embargo, la producción y purificación con éxito de proteínas de fusión naturales, solubles y de longitud completa todavía se ven retardadas por diversos obstáculos, como la necesidad de un tratamiento previo para eliminar los restos celulares y los contaminantes coloides, un tiempo de operación relativamente largo y la solubilidad de las proteínas. Afortunadamente, estos inconvenientes podrían superarse mediante la aplicación de nanomateriales para ayudar a la separación y purificación de las proteínas diana [15,16,17,18,19]. Por ejemplo, SiO 2 magnético -NiO nanocomposite es capaz de separar proteínas marcadas con His [20]. Sin embargo, los nanomateriales todavía tienen patas cortas en la separación de varias proteínas porque a menudo son inactivos para las técnicas de visualización y fluorescencia que pueden usarse como herramientas de diagnóstico biomolecular y médico sensibles para combatir la guerra biológica [21,22,23]. En este sentido, es imperativo encontrar nanomateriales con respuestas fluorescentes para promover su aplicación en la separación y purificación de proteínas recombinantes como la glutatión peroxidasa 3 (GPX3).
Prestamos especial atención al SnO 2 a nanoescala puntos cuánticos (QD), porque, como semiconductor de banda ancha de banda ancha de tipo n (3,6 eV) con buena estabilidad química y biocompatibilidad, SnO 2 exhibe absorbancia óptica en la región espectral visible. Aquí, establecemos una vía inteligente para introducir SnO 2 fluorescente QD sobre la superficie de nanoesferas de sílice (NS), con la esperanza de desarrollar un SnO 2 deseado / SiO 2 nanoestructura con potencial aplicación en la separación y purificación de proteínas marcadas con GST. En primer lugar, nanoesferas de sílice funcionalizadas con tiol (SiO 2 -SH NSs) se prepararon mediante una ruta hidrotermal. SiO 2 resultante -SH NS se combinaron con SnO 2 puntos cuánticos para proporcionar SiO 2 / SnO 2 NS compuestas que poseen una absorción de fluorescencia obvia. El SiO 2 / SnO 2 Los NS se modificaron aún más mediante glutatión reducido (GSH) para obtener SiO 2 / SnO 2 -GSH NS con potencial para la separación por afinidad de proteínas marcadas con GST. La capacidad y la actividad peroxidasa del SnO 2 preparado / SiO 2 -GSH NS en la separación de proteínas etiquetadas con GST se evaluaron mediante análisis SDS-PAGE.
Experimental
Material y métodos
Bromuro de hexadeciltrimetilamonio (CTAB), cloruro de estaño (IV) (SnCl 4 ), trietilamina (TEA) e isopropanol fueron proporcionados por Tianjin Kermel Chemicals Reagent Company (Tianjin, China). AgNO 3 se compró a Tianjin Fuchen Technology Development Co., Ltd. (Tianjin, China). Alfa-Aesar (Shanghai, China) ofreció 3-mercaptopropil-trimetoxisilano (MPS). El ortosilicato de tetraetilo (TEOS) fue suministrado por Tianjin Fuchen Chemicals (Tianjin, China). El fosfato de dinuclectido de dihidronicotinamida y adenina (NADPH), tiorredoxina y tiorredoxina reductasa se obtuvieron de Sigma (Beijing, China). Glutatión Sepharose 4B (Estocolmo, EE. UU.) Fue de GE Healthcare. El ditiotreitol (DTT) estaba disponible en Aladdin Industrial Corporation (Inalco SPA, Italia). Todos los reactivos químicos eran reactivos analíticos y se usaron sin ninguna purificación adicional.
Preparación de SnO 2 Puntos cuánticos
En una síntesis típica [24], 3,5 g de SnCl 4 · 5H 2 Se añadió O en 50 ml de H2 2 O, luego se añadieron 5 ml de amoniaco a la solución con agitación. Posteriormente, la precipitación obtenida por centrifugación se lavó con agua desionizada varias veces para eliminar el exceso de Cl - iones. Se añadieron treinta mililitros de agua desionizada al precipitado obtenido, y luego, el pH de la solución se ajustó a 12 por 2 mol / L de amoniaco. La solución mezclada se transfirió a un autoclave de acero inoxidable revestido con teflón, se selló y se calentó a 150 ° C durante 24 h. Una vez completado el calentamiento, la solución mezclada se enfrió, se centrifugó y se lavó completamente con etanol-isopropanol (relación de volumen 1:1) para obtener SnO 2 QDs.
Preparación de SnO 2 / SiO 2 -SH NS
En una síntesis típica, 0,2 g de SnO 2 Se disolvieron QD y 0,09 g de CTAB en el disolvente mixto de H 2 O (42,5 mL) y alcohol absoluto (7 mL) bajo agitación magnética (200 G, r =180 mm). A la solución resultante se le añadieron 2,7 ml de TEA con 20 min adicionales de agitación. La solución mezclada se calentó a 60 ° C durante 5 h mientras se vertían lentamente 3,5 ml de TEOS y 0,35 ml de MPS, seguido de centrifugación (12,800 G, r =180 mm) y lavando completamente con HCl-etanol (30 mL) y agua (30 mL) para obtener SnO 2 / SiO 2 -SH NS por tres veces, que se dispersó en agua (0,12 g / mL).
Modificación de superficie de SnO 2 / SiO 2 -SH NS
Cuatro mililitros de 0.12 g / mL SnO 2 / SiO 2 -SH NS se lavó con PBS (0,01 mol / L, pH =7,4) tres veces. Estos SnO 2 / SiO 2 -SH NS se agregaron a 30 ml de solución de 16.7 mg / ml de GSH y se oscilaron a 37 ° C durante 24 h (120 rev / min) con un oscilador de temperatura constante. Al final de la oscilación, la solución mezclada se centrifugó para proporcionar SnO 2 / SiO 2 -GSH NS; luego, el precipitado se lavó completamente con 30 ml de PBS (0,01 mol / L, pH =7,4) tres veces para eliminar el exceso de GSH mediante adsorción física, obteniendo así el SnO 2 deseado / SiO 2 -GSH NSs. El SnO 2 resultante / SiO 2 -Se agregaron GSH NS al alcohol (25%, v / v ) y se almacena a 4 ° C.
Separación de proteínas etiquetadas con GST
Las proteínas mezcladas se recogieron del lisado celular de Escherichia coli , que es por lisis de agua (concentración 0.01 mol / L, pH 7.4). Para la expresión de proteínas in vitro, la región proteica que contiene la secuencia codificante de glutatión peroxidasa 3 (GPX3, aminoácidos 37-206), estomas abiertos 1 (OST1) y ABA insensible 2 (ABI2, aminoácidos 100-423) en Arabidopsis thaliana se clonó y se insertó en marco en el plásmido pGEX-6p1 (se usó GPX3 como control). Las construcciones pGEX-GPX3, pGEX-OST1 y pGEX-ABI2 se introdujeron en E. coli Células BL21 (DE3). Las proteínas recombinantes etiquetadas con GST se purificaron usando glutatión sefarosa 4B y SnO 2 / SiO 2 -GSH NSs. Los cebadores usados para clonar los genes fueron los siguientes:para GPX3, cebador directo, 5'-GATGGATCCTCGCCATCGACGGTGGAACAA-3 '; cebador inverso, 5'-CACCTCGAGTCAAGCAGATGCCAATAGCTT-3 '; para OST1, cebador directo, 5'-GCCGAATTCATGGATCGACCAGCAGTGA-3 '; cebador inverso, 5'- CCCGTCGACTCACATTGCGTACACAATC-3 '; para ABI2, cebador directo, 5'-GCGGAATTCGAGAGTAGAAGTCTGTTTG-3 '; cebador inverso, 5′- GCGCTCGAGTCAATTCAAGGATTTGCTC-3 ′.
Después de lavarse con solución de PBS (0.01 mol / L, pH =7.4), el SnO 2 preparado / SiO 2 -GSH NS se introdujeron directamente en 1000 μL de E. coli lisar y agitar a 4 ° C durante 2 h (velocidad de rotación:90 rev / min) para permitir que el SnO 2 / SiO 2 -GSH NS para capturar proteínas marcadas con GST. Una vez completada la agitación, estas NS se aislaron de la solución mediante centrifugación y se lavaron completamente con solución de PBS para eliminar cualquier proteína residual no capturada. El SnO 2 unido a proteínas marcado con GST / SiO 2 -GSH NS se lavaron con 300 μL y 0,5 mol / L de solución de GSH tres veces para disociar las proteínas etiquetadas con GST de su superficie. Las soluciones de proteína recogidas por separado se detectaron mediante electroforesis en gel de poliacrilamida con dodecilsulfato de sodio (SDS-PAGE). La concentración de las proteínas separadas se determinó mediante el kit de ensayo de proteínas BCA. El SnO 2 / SiO 2 -Las NS de GSH se pueden reutilizar para separar las proteínas diana varias veces mediante el mismo método.
Medición de la actividad de glutatión peroxidasa
La actividad de GPX3 separada se midió mediante la determinación espectrométrica del consumo de NADPH a 340 nm como describen Delaunay et al. [25]. La etiqueta GST se cortó mediante la proteasa PreScission de la GPX3 marcada con GST y, a continuación, se usó la GPX3 para el análisis de la actividad. En primer lugar, 98 μL de solución tampón de reacción (incluidos 100 mmol / L de Tris-Cl, 0,3 mmol / L de NADPH, 1,34 μmol / L de tiorredoxina y 0,18 μmol / L de tiorredoxina reductasa de E. coli lisado) se añadió a un tubo; después de mezclar completamente, se añadieron 1,35 µmol de GPX3 purificado a la solución tampón de reacción resultante. Luego, la solución mezclada se agregó a 2 μL de H 2 O 2 (5 mmol / L) para iniciar la reacción y el consumo de NADPH a 340 nm se recogió mediante la determinación espectrométrica.
Análisis de estados redox de GPX3 purificado
La etiqueta GST se cortó de GPX3 etiquetada con GST mediante la proteasa PreScission. El GPX3 separado se trató con 5 mmol / L H 2 O 2 y DTT 1 mmol / L durante 10 min para cambiar los estados redox del GPX3 purificado. El GPX3 resultante se usó para análisis in vitro de estados redox. Los extractos se evaluaron mediante gel SDS-PAGE al 15% no reductor.
Caracterización
La morfología y composición del SnO 2 preparado / SiO 2 -GSH NS se analizaron mediante microscopía electrónica de transmisión (TEM, JEM-2010, Japón), microscopía electrónica de barrido (SEM, JSM 5600LV, Japón), difracción de rayos X (XRD, X 'Pert Philips, Holanda) y espectrómetro de fluorescencia ( FL, FluoroSENS, Gran Bretaña, a la longitud de onda de excitación de 260 nm). Las proteínas etiquetadas con GST separadas se detectaron con electroforesis en gel de poliacrilamida con dodecilsulfato de sodio (SDS-PAGE, Power PAC 300, China), con un voltaje de preconcentración de 70 V y un voltaje de separación de 120 V. El oscilador de temperatura constante fue de Shanghai ChemStar Instruments , Co., Ltd. (ATS-03M2R, China). La concentración de las proteínas separadas se determinó mediante el kit de ensayo de proteínas BCA (Beijing CoWin Biotech, China).
Resultados y discusión
TEM, SEM, XRD y análisis fluorescentes de SnO 2 QD y SnO 2 / SiO 2 -GSH NSs
La Figura 1 muestra las imágenes TEM (HRTEM) de alta resolución y el patrón XRD del SnO 2 sintetizado QDs. Puede verse que el SnO 2 sintetizado Los QD son de forma esférica y tienen un diámetro promedio de 5 nm, que exhibe una distribución de tamaño de partícula estrecha (Fig. 1a), y su espaciado reticular del plano (110) es de 0,29 nm (Fig. 1b). La imagen de celosía bien resuelta demuestra que el SnO 2 preparado Los QD tienen una estructura cristalina muy ordenada. Patrón de difracción de electrones del área seleccionada correspondiente de SnO 2 Los QD (Fig. 1c) se pueden indexar a una sola fase de casiterita, lo que es consistente con el patrón XRD relevante (Fig. 1d). Es decir, los picos característicos en 2 theta =26.6 ° (110), 33.9 ° (101), 38.0 ° (200), 51.8 ° (211), 65.9 ° (301) y 78.7 ° (321) son consistentes con el estándar Datos XRD de Cassiterite SnO 2 (Tarjeta JCPDS no. 41-1445). Además, los intensos picos de XRD indican que el SnO 2 preparado Los QD están bien cristalizados y la ausencia de otros picos característicos sugiere que no contienen hematites o impurezas de hidróxido.
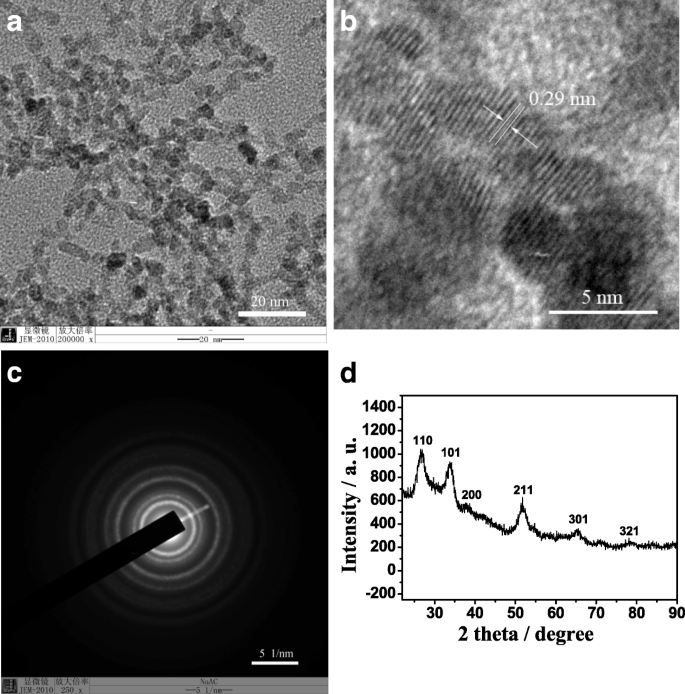
TEM ( a ), HRTEM ( b ) imágenes, patrón de difracción de electrones de área seleccionada ( c ) y patrón XRD ( d ) de SnO 2 preparado QD
La Figura 2 muestra las imágenes SEM y TEM de SnO 2 / SiO 2 -GSH NSs. Se puede ver que el SnO 2 preparado / SiO 2 -GSH NS son de forma esférica y tienen un diámetro promedio de alrededor de 430 nm, y su superficie parece ser algo rugosa (Fig. 2a, b). Mientras tanto, se puede ver que el SnO 2 Los QD (alrededor de 5 a 15 nm) se modifican en la superficie de SiO 2 microesferas (Fig. 2c, d), lo cual es consistente con las imágenes SEM correspondientes. Se indica que el SnO 2 y sílice NS se han agregado.

SEM ( a , b ) y TEM ( c , d ) imágenes del SnO 2 preparado / SiO 2 -GSH NS
La Figura 3a muestra el patrón XRD del SnO 2 sintetizado / SiO 2 -GSH NSs. Los picos principales en 2 theta =110 °, 101 °, 200 °, 211 °, 301 ° y 321 ° son consistentes con los de SnO 2 (Figura 1d). Además, SnO 2 / SiO 2 -GSH NS muestran un pico característico intenso de sílice amorfa alrededor de 23 ° (tarjeta JCPDS n. ° 76-0933), lo que indica que SnO 2 que posee una respuesta a la luz visible se ha introducido con éxito en la superficie de SiO 2 NSs. La Figura 3b muestra el espectro fluorescente de SnO 2 / SiO 2 -GSH NS a 368 nm. Se puede ver que SnO 2 / SiO 2 -GSH muestra una intensa emisión fluorescente, que se atribuye a las vacantes de oxígeno de SnO 2 . La Figura 3c muestra la imagen de fluorescencia de SnO 2 / SiO 2 -GSH NS cuando estos NS se utilizan para separar GPX3 con etiqueta GST en E. bobina lisado. Puede verse que hay una fluorescencia verde obvia donde el SnO 2 preparado / SiO 2 -Se utilizan NS de GSH. Indica que SnO 2 fue modificado en la superficie de SiO 2 y el SnO 2 / SiO 2 -GSH NS tienen buenas propiedades de fluorescencia.
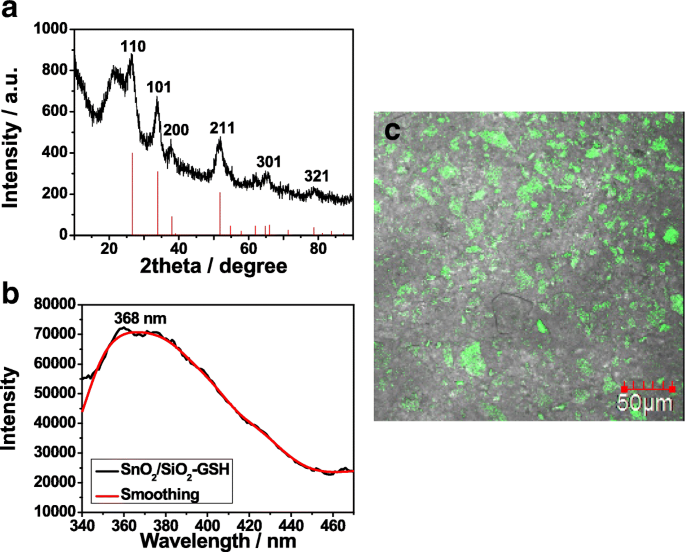
Patrón XRD ( a ), espectro de fluorescencia (b ) e imágenes de fluorescencia ( c ) de SnO 2 preparado / SiO 2 -GSH NS
Análisis SDS-PAGE
Estimar la capacidad del SnO 2 preparado / SiO 2 -GSH NS en la separación de proteínas etiquetadas con GST, realizamos un análisis SDS-PAGE. La Figura 4 muestra el resultado del análisis SDS-PAGE del GPX3 etiquetado con GST separado por SnO 2 / SiO 2 -GSH NSs. Se puede ver que el SnO 2 / SiO 2 -GSH NS pueden enriquecer eficazmente las proteínas diana de E. coli lisado y, en particular, la cantidad de proteínas disociadas tiende a aumentar con la concentración incremental de GSH en el rango de 10-100 mmol / L (carriles 3-6 en la figura 4a). Está claro que las proteínas diana pueden separarse específicamente mediante el SnO 2 preparado / SiO 2 -GSH NS de E. coli lisado y casi no hubo ningún inespecífico.
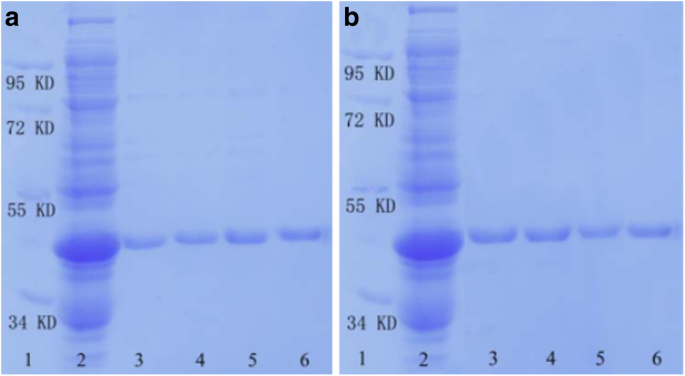
Análisis SDS-PAGE de proteínas etiquetadas con GST purificadas separadas por SnO 2 / SiO 2 -GSH NSs. un Carril 1, marcador; carril 2, E. coli lisado los carriles 3 a 6 se refieren a las fracciones eliminadas del SnO 2 / SiO 2 -GSH NS con diferentes concentraciones de solución de GSH (carril 1, 10 mmol / L; carril 2, 20 mmol / L; carril 3, 50 mmol / L; carril 4, 100 mmol / L). b Carril 1, marcador; carril 2, E. coli lisado carril 3, 1ª separación; carril 4, segunda separación; carril 5, tercera separación; y carril 6, las fracciones se eliminaron de la glutatión sefarosa 4B
Para investigar las propiedades reutilizadas del SnO 2 preparado / SiO 2 -GSH NS, los usamos repetidamente para separar GPX3 con etiqueta GST. Como se muestra en la Fig. 4b (el carril 1 se refiere al marcador, el carril 2 se refiere a E. coli contenida en GST-GPX3 lisado, el carril 3 se refiere a la 1ª separación, el carril 4 se refiere a la 2ª separación, el carril 5 se refiere a la 3ª separación y el carril 6 se refiere a las fracciones eliminadas de la glutatión Sepharose 4B), el SnO 2 sintetizado / SiO 2 -GSH NS exhiben una selectividad especial hacia GPX3 marcado con GST extraído de E. coli lisado, y su especificidad y afinidad no se ven afectadas después de tres ciclos de separación repetida.
Para probar la universalidad del SnO 2 sintetizado / SiO 2 -GSH NS para purificar proteínas etiquetadas con GST, seleccionamos tres tipos de proteínas etiquetadas con GST (GPX3 etiquetadas con GST, OST1 etiquetadas con GST y ABI2 etiquetadas con GST) para realizar experimentos. Como se muestra en la Fig.5, las proteínas GPX3, OST1 y ABI2 etiquetadas con GST pueden separarse específicamente mediante SnO 2 / SiO 2 -GSH NS de E. coli lisado (carriles 3, 6, 9); luego, podemos obtener GPX3 (cortar la etiqueta GST de SnO 2 / SiO 2 -GSH NS que se unen a GPX3 etiquetado con GST) y la etiqueta GST se eluyó de SnO 2 / SiO 2 -GSH NSs (carril 13, GPX3; carril 14, la etiqueta GST), que tiene un efecto similar con Glutatión Sepharose 4B (carriles 2, 5, 8, 11, 12). Las concentraciones de proteínas purificadas por SnO 2 / SiO 2 -GSH NS fueron 7,4 mg / g (GPX3 marcado con GST), 7,1 mg / g (OST1 marcado con GST) y 6,8 mg / g (ABI2 marcado con GST), lo que indica que SnO 2 / SiO 2 -GSH NS son buenos para purificar proteínas etiquetadas con GST de E. coli lisado. Para comparar la capacidad de unión entre el SnO 2 preparado / SiO 2 -GSH NSs y el otro material, Glutatión Sepharose 4B (adquirido en Estocolmo, EE.UU.) se utilizó como material de experimento de comparación. Las proteínas totales purificadas por Glutatión Sepharose 4B fueron 7,1 mg / ml (GPX3 marcado con GST), 6,9 mg / ml (OST1 marcado con GST) y 5,6 mg / ml (ABI2 marcado con GST), respectivamente. Puede verse que la capacidad de unión del SnO 2 preparado / SiO 2 -GSH NS es más alto que el del producto básico 4B.
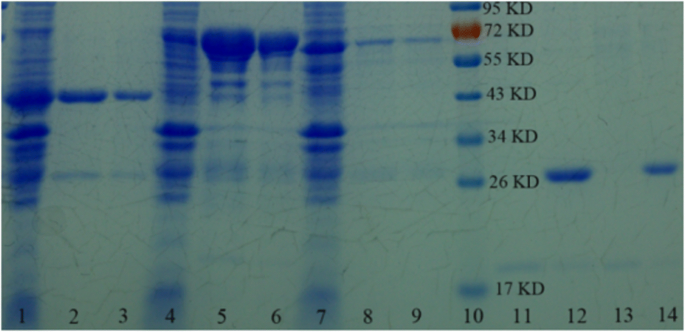
Análisis SDS-PAGE de las proteínas GPX3, OST1 y ABI2 recombinantes purificadas. Carriles 1, 4 y 7, E. coli lisado carriles 2, 5 y 8, las proteínas eluidas de glutatión sefarosa 4B comercial (GE Healthcare, EE. UU.); carriles 3, 6 y 9, las proteínas eluyeron de SnO 2 / SiO 2 -GSH NS; carril 10, el marcador; carriles 11 y 13, GPX3 obtenido después de que la etiqueta GST se corta de la glutatión Sepharose 4B unida a GST-GPX3 y SnO 2 / SiO 2 -GSH NSs unidas a GPX3 marcadas con GST; carriles 12 y 14, etiqueta GST eluida de glutatión sefarosa 4B y SnO 2 / SiO 2 -GSH NS
Análisis del estado redox y la actividad de peroxidasa de GPX3 etiquetado con GST
Para analizar el estado redox y la actividad de GPX3 marcado con GST separados por el SnO 2 preparado / SiO 2 -GSH NSs, cortamos la etiqueta GST para obtener el GPX3 separado. La Figura 6a muestra ensayos in vitro dados del estado redox de GPX3 (correspondiente a un gel representativo de tres experimentos independientes). Los carriles 1 y 2 se refieren a GPX3 obtenido después de que la etiqueta GST se corta de la GPX3 marcada con GST unida a glutatión sefarosa 4B (el carril 1 es el GPX3 oxidado y el carril 2 es el GPX3 reducido); los carriles 3 y 4 se refieren a GPX3 obtenido después de que la etiqueta GST se corta de SnO 2 / SiO 2 -GSH unida a GPX3 marcada con GST (el carril 3 es el GPX3 oxidado y el carril 4 es el GPX3 reducido); el carril 5 se refiere al marcador. Como se muestra en la Fig. 6a, la GPX3 purificada separada de Glutatión Sepharose 4B (carriles 1 y 2) y SnO 2 / SiO 2 -GSH NS (carriles 3 y 4) tienen los estados oxidado y reducido, y la GPX3 reducida migra más lentamente que la contraparte oxidada. Esto es muy consistente con nuestros hallazgos previos de que GPX3 está presente en estados oxidado y reducido in vitro, y sus formas reducidas y oxidadas pueden separarse como resultado de la modificación de los residuos Cys reducidos [26,27,28].
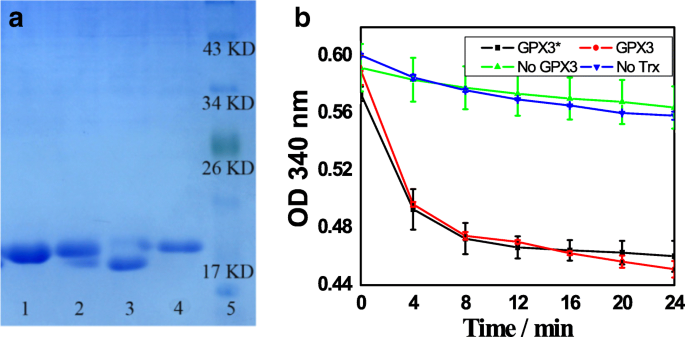
un Ensayos in vitro del estado redox de GPX3:los carriles 1 y 3 (el GPX3 oxidado) y 2 y 4 (el GPX3 reducido) se refieren a GPX3 obtenido después de que la etiqueta GST se corta de Glutatión Sepharose 4B y SnO 2 / SiO 2 -GSH unida a GPX3 marcada con GST, respectivamente; carril 5, marcador. b Ensayos de actividad peroxidasa de GPX3
La Figura 6b muestra los ensayos de actividad peroxidasa de GPX3:línea GPX3 *, ensayo completo de GPX3 purificado en presencia de glutatión sefarosa 4B, tiorredoxina, tiorredoxina reductasa, NADPH y H 2 O 2 ; línea GPX3, reacción completa entre SnO 2 / SiO 2 -GSH NS separó GPX3, tiorredoxina, tiorredoxina reductasa, NADPH y H 2 O 2 ; línea No GPX3, reacción completa en ausencia de GPX3; y línea No Trx, reacción completa en ausencia de tiorredoxina. La Figura 6b muestra la actividad glutatión peroxidasa del GPX3 purificado separado de Glutatión Sepharose 4B y SnO 2 / SiO 2 -GSH NS in vitro. Se puede ver que, con tiorredoxina como sustrato, la GPX3 purificada exhibe una actividad peroxidasa significativa, lo que indica que la GPX3 se separó de SnO 2 / SiO 2 -GSH NSs existe en estado natural.
Conclusiones
Se establece un método fácil para fabricar SnO 2 protegido con sílice Nanoesferas QD (SnO 2 / SiO 2 NS). El SnO 2 / SiO 2 Los NS se modifican aún más con glutatión para producir SnO 2 / SiO 2 -GSH NS para la separación por afinidad del glutatión S proteína recombinante etiquetada con transferasa (etiquetada con GST). Los hallazgos indican que, en términos de la capacidad de separar GPX3 etiquetado con GST, LOV etiquetado con GST y ABI2 etiquetado con GST, el SiO 2 preparado / SiO 2 -GSH NS exhiben separación específica, alta concentración de unión a proteínas y buenas propiedades reutilizadas. Además, el GPX3 separado del GPX3 etiquetado con GST retiene sus estados redox in vitro y también su actividad GPX, lo que significa que el SnO 2 preparado / SiO 2 -GSH NS podría tener un potencial prometedor para la rápida separación y purificación de proteínas etiquetadas con GST.
Abreviaturas
- ABI2:
-
ABA insensible 2
- CTAB:
-
Bromuro de hexadeciltrimetilamonio
- TDT:
-
Ditiotreitol
- GPX3:
-
Actividad peroxidasa de la glutatión peroxidasa 3
- GSH:
-
Glutatión reducido
- Con etiqueta GST:
-
Glutatión S -etiquetado con transferasa
- MPS:
-
3-mercaptopropil-trimetoxisilano
- NADPH:
-
Fosfato de dinuclectido de dihidronicotinamida y adenina
- OST1:
-
Estomas abiertos 1
- QD:
-
Puntos cuánticos
- SDS-PAGE:
-
Electroforesis en gel de poliacrilamida con dodecilsulfato de sodio
- SEM:
-
Microscopía electrónica de barrido
- SiO 2 -SH NS:
-
Nanoesferas de sílice funcionalizadas con tiol
- SnCl 4 :
-
Cloruro de estaño (IV)
- TEA:
-
Trietilamina
- TEM:
-
Microscopía electrónica de transmisión
- TEOS:
-
Ortosilicato de tetraetilo
- XRD:
-
Difracción de rayos X
Nanomateriales
- Separadores de aire para chips de 10 nm
- Nanocristales de estaño para futuras baterías
- Recubrimiento nano para varios colores
- Nanopartículas de oro para sensores de quimioterapia
- Nanofibras y filamentos para una mejor administración de fármacos
- Nanodiamantes para sensores magnéticos
- Nanoárboles para células solares sensibilizadas con colorante
- Nanoheterouniones para células solares
- Síntesis verde en un recipiente de microesferas de SnO2 decoradas con Ag:un catalizador eficiente y reutilizable para la reducción de 4-nitrofenol
- Nanoportadores basados en lípidos y nucleósidos para la administración de sorafenib
- Nanoestructuras de superficie formadas por separación de fases de película de nanocompuesto de polímero y sal metálica para aplicaciones antirreflectantes y superhidrofóbicas



