Agentes teranósticos de próxima generación basados en microcápsulas de polielectrolito codificadas con nanocristales semiconductores:desarrollo y caracterización funcional
Resumen
La fabricación de microcápsulas de polielectrolitos y su uso como portadores de fármacos, marcadores fluorescentes y nanopartículas metálicas es un enfoque prometedor para el diseño de agentes teranósticos. Los puntos cuánticos semiconductores (QD) se caracterizan por un brillo y una fotoestabilidad extremadamente altos que los hacen atractivos marcadores fluorescentes para la visualización de la penetración intracelular y la liberación de tales microcápsulas. Aquí, describimos un enfoque para diseñar, fabricar y caracterizar las propiedades físico-químicas y funcionales de microcápsulas de polielectrolito codificadas con QD de núcleo / cubierta de derivados de polietilenglicol trifuncionales y estabilizadas en agua. Las microcápsulas desarrolladas se caracterizaron por dispersión de luz dinámica, movilidad electroforética, microscopía electrónica de barrido y enfoques de microscopía de fluorescencia y confocal, proporcionando datos exactos sobre su distribución de tamaño, carga superficial, características morfológicas y ópticas. También se midieron las duraciones de fluorescencia de las microcápsulas codificadas por QD y se evaluó su dependencia del tiempo después de la preparación de las microcápsulas. Se determinó el contenido óptimo de QD utilizados para el procedimiento de codificación que proporciona las propiedades óptimas de fluorescencia de las microcápsulas codificadas. Finalmente, se demostró la captación de microcápsulas intracelulares por macrófagos murinos, lo que confirma la posibilidad de un uso eficiente del sistema desarrollado para la obtención de imágenes de células vivas y la visualización del transporte y la entrega de microcápsulas dentro de las células vivas.
Antecedentes
[ 1,2,3,4].
El desarrollo de agentes teranósticos que combinen las funciones de los fármacos y las herramientas para la obtención de imágenes de biomarcadores que permitan el diagnóstico precoz de diversas enfermedades es una tarea importante en el campo del diseño de sistemas de administración de fármacos [5, 6]. Los sistemas basados en microcápsulas de polielectrolitos son candidatos prometedores para combinar ambas funciones. Las condiciones de su fabricación permiten la incorporación de sustancias biológicamente activas, nanopartículas metálicas, marcadores fluorescentes, etc. a las microcápsulas [7,8,9]. Archivo adicional 1:La Figura S1 muestra esquemáticamente un agente teranóstico típico basado en microcápsulas de polielectrolito.
Uno de los métodos eficaces para la obtención de microcápsulas de polielectrolito consiste en la aplicación sucesiva de capas de polímero con carga opuesta sobre un sustrato de forma esférica o de otro tipo, que se retira posteriormente [10, 11]. La interacción del policatión y el polianión de carga opuesta a un pH, fuerza iónica y temperatura especificados de la solución y la polaridad del disolvente da como resultado un complejo de interpolímero en forma de una membrana o capa que recubre el sustrato [12,13,14].
Los factores enumerados anteriormente también afectan la morfología de las microcápsulas resultantes, incluida su porosidad y forma y la integridad de la pared. Por ejemplo, un aumento en la fuerza iónica o el pH del entorno de las microcápsulas de polielectrolito facilita los cambios conformacionales o la protonación / desprotonación de los polielectrolitos que forman la pared de la cápsula. Esto, a su vez, conduce a su deformación y aumento de la porosidad incluso hasta el grado de pérdida de integridad estructural y transición al estado "abierto" seguido de la liberación del contenido interno de las cápsulas y los componentes incrustados en sus paredes en el microambiente [15, 16]. Estas propiedades hacen que las microcápsulas de polielectrolito sean buenas candidatas para el papel de sistemas de administración sensibles a estímulos y una base prometedora para diseñar agentes teranósticos [2, 17, 18].
Los puntos cuánticos (QD) son nanocristales semiconductores fluorescentes de 2 a 10 nm de diámetro caracterizados por un amplio espectro de absorción y un espectro de fluorescencia simétrico y estrecho. Esto permite que los QD con diferentes máximos de fluorescencia se exciten desde una sola fuente de radiación, ofreciendo la posibilidad de su amplio uso como fluoróforos, especialmente para imágenes multiplexadas [19, 20]. Una alta fotoestabilidad y una fluorescencia brillante de los QD determinan su ventaja sobre los fluoróforos orgánicos estándar en las aplicaciones de detección [21,22,23,24].
Estudios publicados anteriormente dedicados al desarrollo de microcápsulas de polielectrolitos poliméricos fluorescentes demuestran un enfoque típico para los tintes fluorescentes orgánicos clásicos o la formación in situ de puntos de carbono bajo carbonización hidrotermal y conversión de dextrano en nanopartículas de carbono luminiscentes en el atrapamiento de la cubierta de polielectrolito dentro de la estructura polimérica de las microcápsulas de polielectrolito preparadas primarias . El enfoque del atrapamiento de colorante orgánico se basa en la difusión del isotiocianato de fluoresceína o rodamina B, colorantes de tetrametilrodamina conjugados con dextrano de bajo peso molecular o albúmina de suero bovino (BSA) en la estructura porosa de la membrana formada por polielectrolitos que da como resultado la carga del colorante fluorescente. de toda la estructura de la microcápsula de polielectrolito como en el hueco interior y como en la membrana polimérica. La necesidad de un tratamiento térmico elevado en el caso de microcápsulas codificadas por puntos de carbono cambia la flexibilidad de la estructura de la microcápsula y la hace más rígida, lo que no es indeseable en caso de desarrollo de sistemas teranósticos sensibles a estímulos de pH y fuerza iónica [25,26,27, 28,29,30].
En este estudio, describimos todos los aspectos tecnológicos de la fabricación de microcápsulas poliméricas codificadas con QD altamente fluorescentes solubles en agua, que poseen una estabilidad coloidal significativa, describimos sus propiedades físico-químicas y funcionales y demostramos su aplicación a la obtención de imágenes de células vivas y visualización de microcápsulas. transporte y entrega dentro de las células vivas. Los datos pueden allanar el camino hacia el siguiente paso hacia el desarrollo de la próxima generación de agentes teranósticos basados en microcápsulas multifuncionales funcionalizadas.
Experimental
Solubilización y caracterización de puntos cuánticos
QD de núcleo / carcasa de CdSe / ZnS con un máximo de fluorescencia λ max igual a 590 nm fueron amablemente proporcionados por el Dr. Pavel Samokhvalov (Laboratorio de Nano-Bioingeniería, Universidad Nacional de Investigación Nuclear MEPhI (Instituto de Física de Ingeniería de Moscú), Moscú, Rusia).
Los QD recién sintetizados se recubrieron con óxido de trioctilfosfina (TOPO) y eran insolubles en agua. Su transferencia a la fase acuosa se realizó sustituyendo d, l-cisteína por TOPO y posteriormente reemplazando d, l-cisteína con 12 - unidad de derivado de PEG que contiene grupos terminales tiol y carboxilo HS− (PEG) 12 −COOH (Thermo Fisher Scientific, EE.UU.) como se describió anteriormente [22, 31, 32]. Para ello, se disolvió una muestra de QDs en 800 μl de cloroformo, luego de lo cual se agregaron 1200 μl de metanol y la mezcla se centrifugó durante 5 min. El procedimiento se repitió tres veces. Luego, el sedimento QD se resuspendió en 800 µl de cloroformo. Se añadió una solución de d, l-cisteína en metanol a la suspensión con una relación en peso de QD a d, l-cisteína de 1:0,13, y la mezcla se centrifugó a 16.873 g durante 10 minutos (Centrifuge 5418, Eppendorf, EE. UU.). El sedimento QD se lavó del exceso de d, l-cisteína con metanol mediante centrifugación durante 3 min a la misma velocidad. El sedimento QD se secó en un concentrador centrífugo Concentrator Plus (Eppendorf, EE. UU.) Durante 2 min. Las QD secas se suspendieron en 650 µl de hidróxido de sodio 0,1 M y se sonicaron durante 10 min en un baño de ultrasonidos Elma Sonic P30H (Elma Schmidbauer, Alemania). Luego, la solución se centrifugó a 5509 g durante 10 min, y el sobrenadante se filtró a través de un filtro Millipore con un tamaño de poro de 0,22 µm (Merck, Alemania). El contenido QD de las muestras se determinó espectrofotométricamente a la longitud de onda del primer pico de absorción de excitones.
Las muestras de QD solubles en agua obtenidas se estabilizaron agregando HS− (PEG) 12 −COOH en una relación molar QD a derivado de PEG de 1:4,6 e incubando la mezcla a 2–8 ° C durante 24–48 h.
Síntesis de micropartículas de carbonato de calcio
Se obtuvieron micropartículas de carbonato de calcio como se describe en otra parte [33, 34]. Quince ml de 0,33 M Na 2 CO 3 (Sigma-Aldrich, Alemania) se añadió una solución a 15 ml de 0,33 M de СаСl 2 (Sigma-Aldrich, Alemania) mientras se agita. La mezcla de reacción se agitó a velocidades de 250, 500 y 750 rpm en un agitador magnético RCT Basic (IKA, Alemania) a temperatura ambiente durante 15 a 60 s. El СаСl 2 y Na 2 CO 3 las soluciones se filtraron preliminarmente a través de filtros con un tamaño de poro de 0,22 μm.
Después de eso, se detuvo la agitación y la mezcla de reacción se incubó durante 10 min. La mezcla se lavó con agua MilliQ resuspendiendo y centrifugando alternativamente a 452 g durante 5 min con una Centrifuge 5810 (Eppendorf, EE. UU.). Las micropartículas obtenidas se lavaron cuatro veces. Después del lavado final, el sedimento se secó en un horno a 60 ° C durante 90 min.
Preparación de microcápsulas de polielectrolito codificadas con puntos cuánticos
Las micropartículas se codificaron con QD utilizando una técnica modificada de deposición capa por capa de polímeros con carga opuesta [31, 35] y QD solubles en agua carboxilados en micropartículas de carbonato de calcio preparadas, que sirvieron como matrices. Las capas de polielectrolito estaban formadas por pares de polímeros:el policatión poli (clorhidrato de alilamina) (PAH) con Mw ≈ 15.000 Da (Sigma-Aldrich, EE. UU.) Y el polianión poli (4-estirenosulfonato de sodio) (PSS) con Mw ≈ 70.000 Da ( Sigma-Aldrich, Estados Unidos).
Las capas se aplicaron en el siguiente orden:СаСО 3 / PAH / PSS / PAH / PSS / PAH / QD-S- (PEG) 12 -COOH / PAH / PSS / PAH / PSS / PAH / PSS.
Se resuspendió una muestra de micropartículas secas en 0,5 ml de agua MilliQ y se sonicó en un baño ultrasónico durante 10 min. Se añadió una alícuota de 0,5 ml de solución de HAP de 2 mg / ml en NaCl 0,5 M a la suspensión que contenía 3,7 x 10 8 micropartículas de carbonato de calcio en agua MilliQ. La suspensión se sonicó en un baño ultrasónico durante 60 sy luego se incubó durante 20 min mientras se agitaba. Después de eso, la suspensión de micropartículas se lavó del exceso de polímero mediante centrifugación a 1054 g durante 5 min seguido de resuspensión en agua MilliQ. El lavado de micropartículas de carbonato cálcico después de la estratificación del policatión se repitió tres veces. Para la aplicación de la siguiente capa (polianión), las micropartículas se resuspendieron preliminarmente en 0,5 ml de agua MilliQ; la suspensión se mezcló con 0,5 ml de una solución de PSS de 2 mg / ml en NaCl 0,5 M, se sonicó en un baño ultrasónico durante 60 s, se incubó durante 20 min mientras se agitaba y luego se lavó del exceso de polímero como se describe anteriormente.
Se aplicaron cinco capas de polielectrolito, la capa exterior que consta de PAH, sobre las partículas de carbonato de calcio antes de la codificación. Se añadieron de 0,10 a 2,24 mg de QD a la suspensión de las micropartículas. La mezcla se incubó durante 80 min mientras se agitaba y luego se lavó tres veces mediante centrifugación como se describe anteriormente. Después de eso, se aplicaron capas sucesivas de polímeros cargados de manera opuesta. Las micropartículas codificadas se almacenaron a + 4 ° C en la oscuridad.
Para obtener microcápsulas de polielectrolito codificadas por QD, se eliminó el núcleo de carbonato de calcio de las micropartículas. Para ello, después de la centrifugación, el sedimento de micropartículas codificadas por QD se resuspendió en 2 ml de etilendiaminotetraacetato (EDTA) disódico 0,2 M (pH 6,5) y la suspensión se incubó durante 15 min. Para garantizar la disolución del núcleo de carbonato de calcio, repetimos este procedimiento dos veces más, reemplazando cada vez la solución con una alícuota nueva de EDTA 0,2 M (pH 6,5) después de 5 min de centrifugación de la muestra a 2152 g . Luego, la suspensión de microcápsulas codificadas por QD se lavó cuatro veces del exceso de EDTA resuspendiendo en agua MilliQ y centrifugando en las condiciones especificadas anteriormente. Las microcápsulas de polielectrolito resultantes se almacenaron a + 4 ° C en la oscuridad.
Al estudiar la interacción de las microcápsulas de polielectrolito codificadas por QD con las células, modificamos la superficie de la microcápsula con BSA (fracción de choque térmico, libre de proteasas, endotoxina baja, apta para cultivo celular, pH 7, ≥ 98%; Sigma-Aldrich, EE. UU.) . Brevemente, las micropartículas codificadas con una capa superior de policatión se revistieron adicionalmente con un ácido poliacrílico polianiónico (PAA) con Mw 15.000 Da (Sigma-Aldrich, EE. UU.), Y el núcleo se eliminó como se describió anteriormente. Después del lavado final, las microcápsulas se dispersaron en una solución tampón de fosfato 50 mM (pH 7,4) que contenía 1% de BSA y se incubaron a + 4ºC en la oscuridad. Antes de su uso, las microcápsulas se lavaron del exceso de BSA con una solución tampón de fosfato 50 mM (pH 7,4).
Caracterización de puntos cuánticos, micropartículas y microcápsulas de polielectrolito codificadas con puntos cuánticos
Estudio de tamaño y carga
El diámetro hidrodinámico de las QD solubilizadas, las micropartículas codificadas por QD recubiertas con capas de polímero y las microcápsulas de polielectrolito codificadas por QD se determinaron mediante el método de dispersión dinámica de luz; la carga superficial se estimó a partir de su movilidad electroforética utilizando el efecto Doppler mediante un Zetasizer NanoZS (Malvern, Reino Unido).
Análisis de fluorescencia
Los tiempos de vida de la fluorescencia (cinética de desintegración de la fluorescencia) de las QD solubilizadas, las micropartículas codificadas por QD recubiertas con capas de polímero y las microcápsulas de polielectrolito codificadas por QD se midieron a la longitud de onda del máximo de fluorescencia. El segundo armónico de un YAG:Nd 3+ Se utilizó como fuente de excitación un láser con una longitud de pulso de 350 ps y una frecuencia de pulso de 50 Hz. La señal fue detectada por un detector fotomultiplicador conectado a un oscilógrafo DPO 3054 (Tektronix, EE. UU.) Con una resolución de tiempo de 2 ns. Las suspensiones de micropartículas y microcápsulas codificadas por QD se agitaron permanentemente durante las mediciones mediante un agitador magnético ecológico MIXcontrol (2mag, Alemania) para evitar la sedimentación de la muestra.
Estimación de la eficiencia de codificación
La eficiencia de codificación se estimó a partir del contenido de QD del sobrenadante después de la aplicación (adsorción) de QD en la superficie de la micropartícula. La cantidad de QD adsorbidos en la superficie de la micropartícula (\ ({Q} _ {{\ mathrm {QD}} _ {\ mathrm {abs}}} \)) se calculó como
$$ {Q} _ {{\ mathrm {QD}} _ {\ mathrm {abs}}} ={Q} _ {{\ mathrm {QD}} _ 0} - {Q} _ {{\ mathrm {QD} } _i}, $$donde \ ({Q} _ {{\ mathrm {QD}} _ 0} \) es la cantidad inicial de QD en la alícuota utilizada para la codificación, y \ ({Q} _ {{\ mathrm {QD}} _ i} \ ) es la cantidad de QD en el sobrenadante de i a muestra.
El contenido QD de las muestras se determinó espectrofotométricamente utilizando un lector de placas multimodo Infinite 200 PRO (Tecan, Suiza).
Microscopía electrónica de barrido
Se obtuvieron microfotografías electrónicas de las micropartículas de carbonato de calcio usando un microscopio electrónico de barrido JSM-7001F (JEOL, Japón) equipado con un cátodo Schottky. El polvo de micropartículas secas se aplicó sobre una cinta adhesiva de carbono conductora y se escaneó a un promedio de 50, una corriente de haz de 20 pA y un voltaje de aceleración de 15 a 30 kV.
Para obtener microfotografías de las micropartículas recubiertas con capas de polielectrolitos, una gota de una suspensión de micropartículas diluida que contiene ~ 10 6 Se colocaron micropartículas por 0,5 ml sobre un sustrato de silicio previamente purificado y se secaron a temperatura ambiente. Las muestras resultantes se escanearon a un promedio de 50, una corriente de haz de 20 pA y un voltaje de aceleración de 3 a 30 kV.
Microscopía de fluorescencia y confocal
La morfología y distribución de tamaño de las micropartículas codificadas por QD se analizaron mediante microscopía de fluorescencia utilizando un microscopio Carl Zeiss Axio Scope A1 (Carl Zeiss, Alemania) equipado con filtro de emisión de fluorescencia Texas Red; Se utilizó una solución acuosa al 20% de glicerol como medio de montaje de portaobjetos .
Las muestras de microcápsulas codificadas por QD también se estudiaron utilizando un microscopio de barrido láser confocal Leica TCS SP5 (Leica Microsystems, Alemania) equipado con láseres para excitación 405, 458, 476, 488, 496, 514, 561 y 633 nm y Leica LAS Versión de software AF 2.7.3.9723. El análisis se realizó a una longitud de onda de excitación de 488 nm y un conjunto de filtros colectores que cubren el rango de emisión a 555–620 nm utilizando el objetivo Leica HCX PL APO CS 63 × / 1.20 CORR WATER. Se utilizó una solución al veinte por ciento de glicerol en tampón PBS pH 7,4 como medio de montaje de portaobjetos. Se utilizó el software Image J 1.51 s (EE. UU.) Para el análisis y procesamiento de imágenes.
Captación de microcápsulas de polielectrolito codificadas con puntos cuánticos por células vivas in vitro
La línea celular de macrófagos alveolares de ratón inmortalizada MH-S (ATCC, EE. UU.) Se mantuvo en medio RPMI suplementado con FCS al 10%, 2-mercaptoetanol 0,05 mM y glutamina 2,06 mM en una atmósfera humidificada al 5% de CO2 2 y 37 ° C. Las células MH-S cultivadas hasta 3 × 10 6 células en placas μ de 35 mm y 1,2 × 10 6 de las microcápsulas de polielectrolito codificadas por QD recubiertas con BSA se añadieron a cada μ-dishe. Las células se incubaron adicionalmente a 37 ° C y 5% de CO 2 durante 4 y 24 h respectivamente. Luego, los núcleos celulares se contratiñeron usando sonda fluorescente DRAQ5 (ex / em longitudes de onda 646/697 nm, ThermoFisher, EE. UU.) Durante 30 min y luego las muestras celulares se lavaron y analizaron con microscopio de barrido láser confocal Leica TCS SP5 (Leica Microsystems, Alemania ). Las imágenes de la captación celular de las microcápsulas de polielectrolito codificadas por QD se adquirieron usando HCX PL APO CS 63.0 × 1.30 GLYC / OIL, HCX PL APO lambda blue 40.0 × 1.25 OIL. La fluorescencia de los QD se excitó a 488 nm y la emisión se recogió a 555-620 nm, mientras que la fluorescencia de los núcleos celulares teñidos con DRAQ5 se excitó a 633 nm y la emisión se recogió a 650-750 nm.
Análisis estadístico
El análisis estadístico se realizó con el software MS Office Excel 2007 y Origin Pro 2015. Todos los datos se muestran como medias y desviaciones estándar utilizando los resultados de un mínimo de tres experimentos independientes.
Resultados y discusión
Síntesis y caracterización de micropartículas de carbonato de calcio
El uso de cristales inorgánicos esféricos, en particular, microesferolitas de carbonato cálcico, como sustrato está determinado por su biocompatibilidad, así como por la posibilidad de su eliminación en el curso de la formación de microcápsulas de polielectrolitos sin usar disolventes agresivos para los sistemas vivos. Las micropartículas de carbonato de calcio per se también pueden usarse como un sistema de administración de fármacos con liberación modificada o prolongada, sirviendo como matriz para cargar fármacos y controlar su liberación en el microambiente, es decir, tienen múltiples usos potenciales en sistemas de administración [36,37 , 38,39,40,41,42,43,44,45,46].
Los factores clave que determinan el tamaño y la forma de los microcristales son la velocidad y la duración de la agitación y el tiempo de incubación de la mezcla de reacción [33, 41]. Hemos determinado experimentalmente las condiciones para la obtención de microesferolitas de carbonato cálcico con una distribución de tamaño óptima. CaCO único 3 Se ha descubierto que las micropartículas tienen una forma redondeada casi regular. Archivo adicional 1:La Figura S2 muestra las distribuciones de tamaño de las micropartículas de carbonato de calcio obtenidas a diferentes velocidades de agitación. Como se ve a partir de estos datos, la heterogeneidad de tamaño de las partículas aumentó al aumentar la velocidad de agitación. Si la velocidad de agitación fue de 250 rpm, el tamaño de las partículas obtenidas osciló entre 4,0 y 6,0 µm. En este caso, todas las micropartículas de la muestra estaban separadas y su distribución de tamaño era cercana a la normal (archivo adicional 1:Figura S2a). Sin embargo, si la mezcla se agitó a 500 rpm, observamos partículas de forma irregular que eran agregaciones de partículas más pequeñas, el tamaño medio de las partículas individuales varía de 2,7 a 5,6 μm (archivo adicional 1:Figura S2b). A una velocidad de agitación de 750 rpm, se incrementó la dispersión del tamaño de partícula. Esta muestra también contenía agregaciones de forma irregular, con el tamaño medio de las micropartículas individuales en el rango de 3.8 a 5.7 μm (Archivo adicional 1:Figura S2c).
Así, la agitación de la mezcla de reacción a una velocidad de 250 rpm permitió obtener partículas con una distribución de tamaño óptima y una forma casi regular y evitó la agregación de partículas. Por lo tanto, estimamos el efecto de la duración de la agitación en la distribución del tamaño de las micropartículas a esta velocidad de agitación (archivo adicional 1:Figura S3). La agitación de la mezcla de reacción durante 15 s produjo un mayor número de partículas más grandes en comparación con la agitación de 30 s. Un aumento en la duración de la agitación a 60 s tuvo un efecto similar. Es decir, la duración de la agitación fue insuficiente en el primer caso (Archivo adicional 1:Figura S3a) y excesiva en el último caso (Archivo adicional 1:Figura S3c). Por lo tanto, consideramos que la velocidad de 250 rpm y la duración de 30 s son las condiciones óptimas de agitación.
Según los datos de microscopía electrónica de barrido (SEM), la superficie de las micropartículas de carbonato de calcio era heterogénea, caracterizada por la porosidad (Fig. 1a). Con un aumento de × 40.000, se pudo ver que las micropartículas estaban, a su vez, formadas por partículas submicrométricas más pequeñas (Fig. 1b). Así, las micropartículas obtenidas tenían una estructura porosa y representaban matrices que no solo son adecuadas como sustratos, sino que también pueden usarse per se como sistemas de liberación y debido a su estructura de superficie particular pueden usarse fácilmente como una matriz para capa por capa. deposición de polímero.

Microfotografías electrónicas de barrido de micropartículas de carbonato de calcio ( a ) y su superficie con un aumento mayor ( b )
Preparación y caracterización de microcápsulas de polielectrolito codificadas con puntos cuánticos
Los QD solubles en agua preparados se caracterizaron por un amplio espectro de absorción y un estrecho espectro de fluorescencia con una emisión máxima de 590 nm (Fig. 2). El diámetro hidrodinámico de estas muestras QD osciló entre 23,96 y 28,2 nm. Archivo adicional 1:La Figura S4 muestra la distribución de tamaño de los QD estabilizados con HS− (PEG) 12 −COOH. La modificación de la superficie QD con HS− (PEG) 12 −COOH aseguró la estabilidad QD en la fase acuosa, así como la carga negativa superficial suficiente para la adsorción efectiva de QDs entre capas de polielectrolito cargadas positivamente durante el procedimiento de codificación [22, 47].
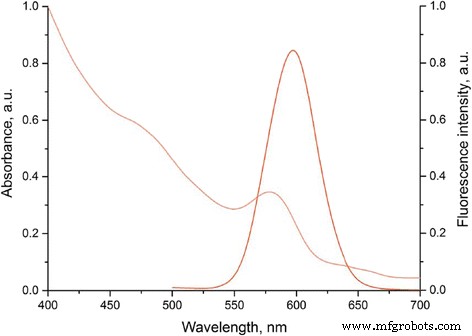
Características ópticas de los puntos cuánticos de núcleo / capa de CdSe / ZnS solubilizados con HS− (PEG) 12 −Ligandos de COOH
Los valores de carga superficial medidos de las muestras de micropartículas de carbonato de calcio durante cada paso de deposición de las capas de polielectrolito y QD (Tabla 1) confirmaron que la carga superficial de la matriz original, los QD solubilizados, así como la recarga superficial después de cada deposición de polímeros son suficientes para la absorción efectiva de cada capa subsiguiente.
La carga superficial intrínseca y la estructura de la superficie porosa de las micropartículas de carbonato cálcico sintético permitieron que se usaran como una matriz para el polielectrolito de carga opuesta y la deposición de QD (Fig. 3). La aplicación de polímeros de PAH y PSS en microcápsulas poliméricas de polielectrolito codificadas por QD está determinada por su biocompatibilidad y no toxicidad y también por no biodegradabilidad que, además, ayuda a retener los QD dentro de la cáscara. La biodegradabilidad de la poli-l-arginina, poli-l-lisina, quitosano, sal sódica del ácido algínico y sulfato de dextrano, que también se utilizan ampliamente en la formación de microcápsulas de polielectrolito, inducirá la difusión QD fuera de la membrana polimérica que debería resultar en una disminución. de las propiedades fluorescentes de las micropartículas [3, 11, 39, 48,49,50,51,52]. El policatión PAH y el polianión PSS utilizados en este estudio contienen, respectivamente, grupos amina y sulfato que garantizan la interacción electrostática entre las capas de polímero, lo que da como resultado la formación de complejos interpoliméricos [16, 25, 36, 37]. La elección de la primera capa de polímero se determinó por el valor de carga superficial de las micropartículas de carbonato de calcio sintetizadas.
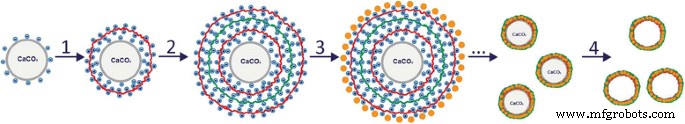
Procedimiento de preparación de microcápsulas codificadas con puntos cuánticos:formación de las capas del policatión (1) y polianión (2), los polielectrolitos PAH y PSS, respectivamente, sobre la superficie de la matriz; codificación de las micropartículas resultantes con puntos cuánticos y deposición adicional de polímeros capa por capa (3); eliminación del núcleo de carbonato de calcio (4)
La Figura 4 muestra imágenes SEM de las etapas de formación de la capa de polímero en la superficie del sustrato. Como se ve en las microfotografías, las micropartículas contenían un núcleo de granos de carbonato de calcio y una cáscara, que se hizo más distintiva con el aumento del número de capas de polímero adsorbidas. La superficie de las micropartículas recubiertas con las capas de polielectrolito seguía la forma del sustrato con su homogeneidad característica, lo que sugería que también era poroso (Fig. 4a, b) [44]. A medida que la capa de polímero se volvió más gruesa, la superficie de las micropartículas se volvió más uniforme y lisa (Fig. 4c, d).
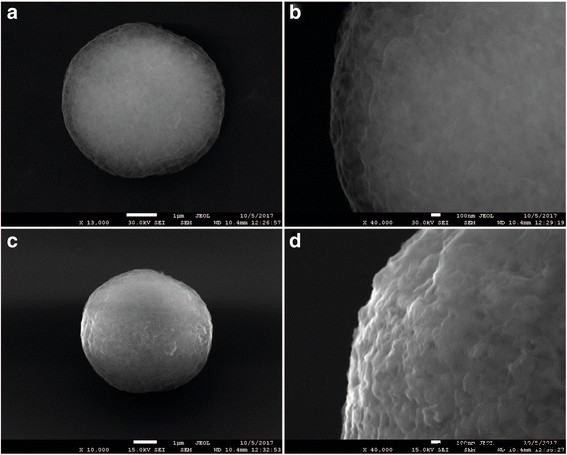
Imágenes de microscopía electrónica de barrido de micropartículas de carbonato de calcio después de la aplicación de cuatro ( a , b ) y diez ( c , d ) capas de polielectrolito
El paso final de la preparación de microcápsulas de polielectrolito codificadas por QD incluyó la eliminación del núcleo de carbonato de calcio y la formación de la estructura final de las microcápsulas. Para disolver la matriz constituida por granos de carbonato cálcico, las micropartículas se lavaron con EDTA. El EDTA se utilizó principalmente porque forma complejos solubles en agua al interactuar con sales de metales divalentes, incluido el calcio, y su bajo peso molecular asegura la permeabilidad de la capa de polielectrolito para el EDTA y su complejación con Ca 2+ . Esto conduce a la disolución del núcleo de las partículas de polielectrolito y a la formación de una estructura hueca [45, 46].
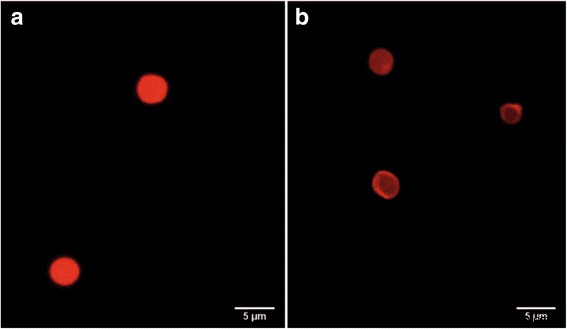
Las micropartículas codificadas por QD y las microcápsulas de polielectrolito obtenidas en nuestro estudio tenían una forma esférica o casi esférica y un tamaño de 3,8 a 6,5 μm (fig. 5). El análisis de la morfología y estructura de las micropartículas y microcápsulas en el modo fluorescente mostró cavidades dentro de las microcápsulas de polielectrolito, como se evidencia por su mayor transparencia en comparación con las micropartículas (Fig. 5b). Esto demostró que el procedimiento de disolución del núcleo con EDTA era eficaz. Los datos de microscopía confocal también mostraron la estructura hueca de las microcápsulas de polielectrolito fluorescente obtenidas (Fig. 6). Estas microcápsulas podrían distinguirse como partículas individuales (Fig. 6a, b) que se pueden caracterizar como partículas esféricas con superficie rugosa debido a su modificación superficial por recubrimiento de BSA.
Imágenes de microscopía de fluorescencia de micropartículas de carbonato de calcio recubiertas con polielectrolito y codificadas con punto cuántico ( a ) y microcápsulas de polielectrolito obtenidas a partir de ellas ( b )
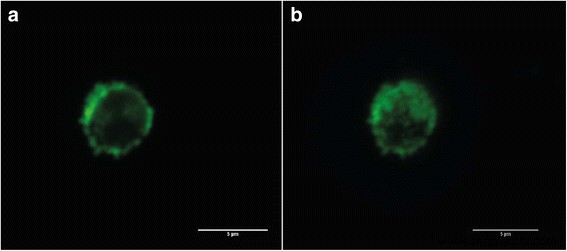
Imágenes de microscopía confocal de las microcápsulas de polielectrolito codificadas con puntos cuánticos y recubiertas por BSA:cortes transversales de las microcápsulas ( a ); Proyección 3D de una única microcápsula de polielectrolito ( b )
Estimación de la eficiencia de codificación
La eficacia de la codificación se estimó mediante la cantidad de QD adsorbidos en la superficie polimérica cargada positivamente de la micropartícula. La estimación de las cantidades de QD en la solución original utilizada para la codificación de micropartículas y en el sobrenadante antes y después de la incubación de micropartículas con la solución QD mostró que el número de QD unidas a la superficie de la micropartícula aumentaba linealmente al aumentar el contenido de QD en la mezcla de reacción de 0,36 a 2,241 mg (figura 7a). Further increase in the amount of QDs in the solution led to a decrease in the number of adsorbed QDs. This may have resulted from an insufficient density of the positive charge determined by amine groups of PAH on the microparticle surface because of an excessive amount of QDs and the resultant saturation of the surface with them. Apparently, the QDs were adsorbed more efficiently if their amount was smaller than 2.241 mg owing to sterically favorable conditions and less interference with one another’s attachment. The pattern of the dependence of the encoding efficiency on the QD content of the solution used for the encoding agrees with our earlier data [22].
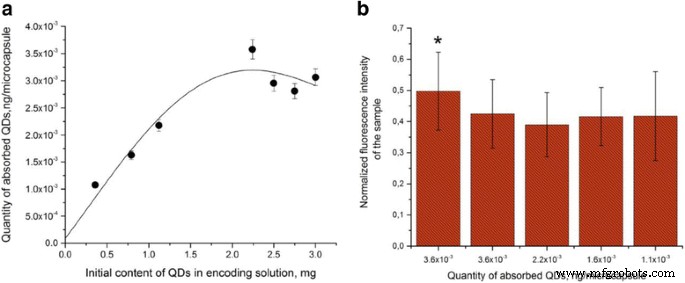
Estimation of the efficiency of encoding of microparticles with different amounts of quantum dots (a ) and their fluorescence characteristics (b ). Asterisk indicates significant difference of QD-encoded microbeads from the QD-encoded microcapsules (p < 0.05)
Estimation of the optical characteristics of the obtained polyelectrolyte microcapsules is an essential stage of the assessment of encoding efficiency. Its results show how suitable the given technique is for fabrication of imaging agents based on QD-encoded polyelectrolyte microcapsules.
Figure 7b shows the fluorescence intensities of the microparticles and microcapsules measured as the mean normalized intensity of gray color as dependent on the amount of QDs used for encoding them. As seen from the figure, the fluorescence intensity of the encoded microparticles was higher than that of the microcapsules obtained from them. At the same time, the microcapsules encoded with different amounts of QDs did not differ significantly from one another in fluorescence intensity (p > 0.05). Despite some decrease in the fluorescence intensity of the microcapsules, their encoding with the amount of QDs indicated above ensures a contrast sufficient for effective imaging.
Quantum Dot Fluorescence Lifetime within Encoded Polyelectrolyte Microcapsules
As noted above, the fluorescence intensity of the polyelectrolyte microcapsules was decreased compared to the microparticles used for their fabrication and encoded with the same QDs. Therefore, we have estimated the fluorescence lifetimes of both the original QDs and the same QDs embedded in the microparticles or the polymeric walls of the microcapsules.
The QD fluorescence kinetic curves (Fig. 8) are characterized by monoexponential dependence of fluorescent intensity on time according to the following equation:
$$ I(t)={A}_1\bullet {e}^{-x/{t}_1}, $$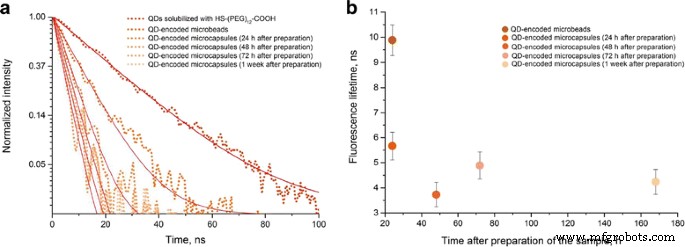
Fluorescence lifetimes of the solubilized CdSe/ZnS quantum dots with a fluorescence peak at 590 nm incorporated in the fabricated microparticles and microcapsules
donde yo ( t ) is the intensity of QD fluorescence in response to excitation pulses and A 1 , х , and t 1 are parameters describing the change in the intensity with time.
We determined the fluorescence lifetime for each sample (Table 2). The original solubilized QDs had the longest fluorescence lifetime; it was decreased after the QDs were adsorbed onto the microparticles and incorporated into the structure of the polymer shell. This may have resulted from interaction between the QDs and PAH, as we found earlier [22]. In the case of microcapsules, the QD fluorescence lifetime tended to further decrease compared to the QDs within the microparticles from which the microcapsules were fabricated. A possible cause of this decrease was a technological factor entailed in the fabrication of microcapsules, namely, the dissolution of the core and the related increase in the necessary number of washings.
It should be noted, that the fluorescence lifetime also tended to decrease with time after the microcapsule fabrication. However, since 48 h after the microcapsule fabrication, further changes in the mean fluorescence lifetime were insignificant. The fluorescence decay was apparently caused by a decrease in the fluorescence quantum yield of QD embedded in the shells of the capsules. This effect is likely to have resulted from the change in the distribution of the electron potential and the geometric rearrangement of QDs in the inner layers of the polymer shell after the core removal that increased the probability of nonradiative recombination due to the charge transfer to between neighboring QDs or between QDs and polymer molecules [22].
Interaction of Quantum Dot- Encoded Polyelectrolyte Microcapsules with Phagocytic Cells In Vitro
We used confocal microscopy to analyze the interaction of QD-encoded polyelectrolyte microcapsules with live phagocytic cells, their uptake by cells, and the possibility of cell labeling. The murine alveolar macrophage (MH-S) cells were used as a model, because of the capability of these cells to phagocytize xenogenic objects.
The MH-S cells were treated with approximately 1.2×10 6 of QD-encoded microcapsules by short-term (4 h) or long-term (24 h) incubations. We observed signs of primary uptake of the microcapsules in both cases:after the short- and (Fig. 9a–d) long-term incubation (Fig. 9e–h). Polyelectrolyte microcapsules or their conglomerates could be seen in green color. The microcapsules could be clearly distinguished both in the external environment of cells and inside the MH-S cells that could be evidenced by the distance between the microcapsules and nuclei of the MH-S cells which were stained by far-red DNA stain DRAQ5 and can be seen as red spherical shaped objects at all the microphotographs. As individual microcapsules and as their conglomerates were detected to undergo the uptake process. The fact that microcapsules were located in internal cell environment or at least attached to the surface of the macrophages is confirmed by clearly distinguished short distances between the nuclei and the polyelectrolyte microcapsules (Fig. 9b, d, g, h). In Fig. 9g, residually stained boundaries of the macrophage cytoplasmic membranes are distinctly seen, which indicates effective uptake, and well-discernible microcapsules are easy to detect to be attached on their surface either within the cells.
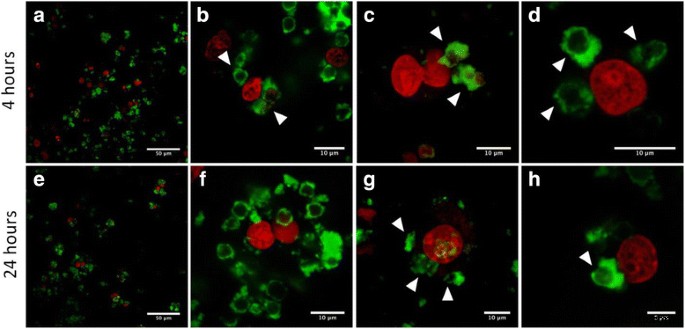
Confocal images of the MH-S cells treated with the QD-encoded polyelectrolyte microcapsules coated with BSA. The upper row shows the images of the samples after 4 h of short-term incubation; the microcapsules are shown by white arrows (a - d ). The lower row demonstrates the images of the samples after 24 h of long-term incubation; the microcapsules are shown by white arrows (e - h ). The nuclei of the macrophages were counterstained with far-red DNA stain DRAQ5
During the short-term incubation, single microcapsules were found to be phagocytized by MH-S cells prior to conglomerates of the microparticles. While after long-term incubation (24 h), the amount of the conglomerates of the polyelectrolyte microcapsules undergoing the uptake process and located inside cells or at least attached to the cell surface was more significant than after short-term incubation. Thus, the polyelectrolyte microcapsules obtained in this study used as promising tools for imaging and tracking of live cells.
Conclusions
Our study has demonstrated the feasibility of fabrication of stable QD-encoded polyelectrolyte microcapsules with optimized fluorescence characteristics and a narrow size distribution. The technique for incorporation of water-soluble and stabilized with three-functional polyethylene glycol derivatives core/shell QDs into the polymer wall of the microcapsules and detailed characterization at each stage of experimental procedure ensured efficient fluorescent encoding of microcapsules. The efficient intracellular uptake of developed QD-encoded microcapsules by murine macrophages was demonstrated, thus confirming the possibility of efficient use of developed system for live cell imaging and visualization of microcapsules transportation and delivery within the living cells.
Abreviaturas
- EDTA:
-
Disodium ethylenediaminetetraacetat
- PAA:
-
Polyacrylic acid
- PAH:
-
Polycation poly(allylamine hydrochloride)
- PEG:
-
Polietilenglicol
- PSS:
-
Polyanion poly(sodium 4-styrenesulfonate)
- QD:
-
Punto cuántico
- RPMI medium:
-
Roswell Park Memorial Institute medium
- SEM:
-
Microscopía electrónica de barrido
- TOPO:
-
Trioctylphosphine oxide
Nanomateriales
- Electrones y "huecos"
- Memfault se asocia con Alif Semiconductor para llevar herramientas de diagnóstico de dispositivos de próxima generación a IoT celular y procesadores Fusion habilitados para IA
- Monitor de temperatura y humedad en el hogar (habitación) con gráfico basado en web - Raspberry Pi
- Los nanocristales semiconductores ayudan a producir combustible de hidrógeno
- Nanomaterial inteligente y nanocompuesto con actividades agroquímicas avanzadas
- Síntesis de nanocristales de ZnO y aplicación en células solares de polímero invertido
- Fabricación, caracterización y actividad biológica de sistemas de nanoportación de avermectina con diferentes tamaños de partículas
- Fabricación y caracterización de nanoclips de ZnO mediante el proceso mediado por poliol
- Morfología, estructura y propiedades ópticas de películas semiconductoras con nanoislinas GeSiSn y capas tensas
- Ambarella, Lumentum y ON Semiconductor colaboran en la detección 3D basada en procesamiento de IA para dispositivos AIoT de próxima generación
- Las herramientas de próxima generación impulsan el desarrollo de 5G y Edge



