Los efectos de la relación Li / Nb en la preparación y el rendimiento fotocatalítico de los compuestos Li-Nb-O
Resumen
Se estudiaron en profundidad los efectos de la relación Li / Nb en la preparación de compuestos Li-Nb-O mediante un método hidrotermal. La relación Li / Nb tiene un gran impacto en la formación de LiNbO 3 ; la proporción menor de 3:1 es beneficiosa para la formación de LiNbO 3 , aunque es mayor que 3:1, no forma LiNbO 3 en absoluto y la morfología y enlace químico de Nb 2 O 5 La materia prima está totalmente modificada por iones de Li. La razón se puede atribuir al gran contenido de LiOH, que es beneficioso para formar Li 3 NbO 4 no LiNbO 3 , y también, incluso si LiNbO 3 La partícula se forma localmente, se disuelve fácilmente en una solución de LiOH con fuerte alcalinidad. Pure LiNb 3 O 8 se obtienen polvos con dos relaciones Li / Nb absolutamente opuestas:8:1 y 1:3; el primero muestra una estructura porosa y hueca única, bastante diferente de la agregación de partículas (el último muestra). En comparación con Li / Nb =1:3, el rendimiento fotocatalítico 4,2 veces mayor de LiNb 3 O 8 (Li / Nb =8:1) y se puede atribuir a la estructura única porosa y hueca, que proporciona una alta densidad de sitios activos para la degradación de MB. Comparado con LiNbO 3 , el rendimiento fotocatalítico mejorado de LiNb 3 O 8 se puede atribuir a su tipo de estructura en capas con la simetría reducida que mejora la separación de electrones y huecos.
Antecedentes
Los compuestos de niobio, un grupo de materiales muy versátil, incluidos los óxidos de niobio, los niobatos alcalinos y los niobatos de columbita, exhiben muchas propiedades físicas interesantes y se han estudiado ampliamente en muchos campos, como la catálisis [1, 2, 3], los memristores [4]. , células solares sensibilizadas con colorante [5], dispositivos ópticos y otros [6, 7]. LiNbO 3 , como uno de los niobatos alcalinos más famosos, presenta propiedades destacadas como comportamientos ópticos electroópticos y no lineales, piroelectricidad y piezoelectricidad, y se utiliza principalmente como moduladores ópticos, guías de ondas, transductores de ondas acústicas, et al. en dispositivos ópticos.
Para la remediación ambiental y aplicaciones de energía limpia, niobatos, como (Na, K) NbO 3 [8], BiNbO 4 [9], LiNbO 3 [10] y LiNb 3 O 8 [11], han sido profundamente investigados, debido a su especial distorsión [NbO 6 ] estructuras octaédricas que favorecen una posible deslocalización de los portadores de carga [12]. En segundo lugar, las bandas de conducción que consisten en orbitales Nb4d ubicados en un estado más negativo de potencial redox de H + / H 2 promueven la separación y transferencia de portadores de carga fotoinducidos y dan como resultado una alta actividad fotocatalítica [13]. Entre estos materiales, LiNb 3 O 8 muestra actuaciones únicas. Como nuevo material de ánodo de batería de iones de litio (LIB), la capacidad teórica de LiNb 3 O 8 es 389 mAh / g asumiendo transferencias de dos electrones (Nb 5+ → Nb 3+ ), más grande que muchos otros materiales de ánodo, como Li 4 Ti 5 O 12 [14, 15]. Se utiliza para dispositivos con supercondensador, LiNb 3 O 8 Los nanoflakes muestran una excelente estabilidad de ciclo con una disminución de la capacitancia específica insignificante incluso después de 15.000 ciclos [16]. Además, se utiliza como fotocatalizador eficaz en las aplicaciones de generación de hidrógeno y degradación de contaminantes orgánicos. Pure LiNb 3 O 8 es un fotocatalizador UV altamente activo para la reducción de agua que produce 83,87 μmol de hidrógeno en 1 h, y no produce hidrógeno bajo irradiación de luz visible debido a su gran banda prohibida (es decir, 3,9 eV) y su incapacidad para absorber la luz visible [17 , 18]. LiNb 3 O 8 Los nanoflakes muestran una rápida decoloración del tinte azul de toluidina O (TBO) bajo luz ultravioleta en comparación con el TiO 2 comercial polvos [13].
En la mayoría de los casos, la aparición de LiNb 3 O 8 se reconoce como una fase de impureza durante la preparación de LiNbO 3 , especialmente en muestras de película, debido a la alta temperatura de recocido o la distribución no homogénea del elemento Li en los precursores [19, 20]. Debido a la dificultad de preparar una fase pura, LiNb 3 O 8 rara vez se ha estudiado, mientras que para LiNbO 3 polvos, las tecnologías de preparación son diversas, como sol-gel [19], hidrotermal [21] y métodos de irradiación con láser [22]. El método hidrotermal se usa ampliamente para sintetizar nanomateriales con ventajas como baja temperatura, respeto al medio ambiente y distribución homogénea del tamaño de partícula, que puede evitar eficientemente la variación de la relación molar Li / Nb sin pasar por altas temperaturas. En cuanto al método hidrotermal, los parámetros de la temperatura de reacción, la relación de la materia prima y el tiempo de retención juegan un papel importante en la determinación de los materiales obtenidos, mientras que la investigación de la relación Li / Nb es mucho mayor que 1:1 en la preparación de Li-Nb. -O compuestos no se ha informado antes.
En este trabajo, se estudiaron en profundidad los efectos de la relación Li / Nb en la preparación de compuestos Li-Nb-O mediante un método hidrotermal. Se utilizó una serie de técnicas analíticas para caracterizar la cristalinidad, morfología y composición química de las muestras de Li-Nb-O, especialmente los cambios antes y después de la reacción hidrotermal. Pure LiNb 3 O 8 y LiNbO 3 Se prepararon fotocatalizadores y se estudió el rendimiento fotocatalítico con el efecto de la relación Li / Nb en las materias primas.
Métodos
La preparación de los compuestos Li-Nb-O se llevó a cabo por el método hidrotermal utilizando hidróxido de litio monohidrato (LiOH · H 2 O; Aladdin, ACS, ≥ 98,0%) y pentóxido de niobio (Nb 2 O 5 ; Aladdin, AR, 99,9%) como materiales de partida. En primer lugar, 3,5 mmol de Nb 2 O 5 se dispersó en 35 ml de agua desionizada con una cierta cantidad de LiOH · H 2 O bajo agitación magnética. Las relaciones molares de Li:Nb son 1:3, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1 y 8:1; como los resultados de las muestras preparadas con proporciones de 4:1, 5:1, 6:1 y 7:1 son similares, solo se muestran a continuación las proporciones de Li:Nb =4:1 y 7:1. Las soluciones de suspensión se colocaron en reactores de autoclave de síntesis hidrotermal revestidos con teflón de 50 ml y se mantuvieron a 260 ° C durante 24 h, luego se enfriaron naturalmente a temperatura ambiente. Los polvos tal como se obtuvieron se lavaron luego con agua desionizada y etanol varias veces y se secaron a 60ºC. Finalmente, los productos se calcinaron a varias temperaturas de 500 a 800 ° C durante 2 h con una velocidad de rampa de 5 ° C / min.
Los patrones de difracción de rayos X (XRD) se registraron utilizando un difractómetro Bruker D8 Discover con Cu Kα radiación (40 kV, 40 mA). Las morfologías de las muestras se caracterizaron mediante microscopio electrónico de barrido de emisión de campo (FESEM; JSM-6700F). Los enlaces químicos se analizaron mediante espectroscopia infrarroja transformada de Fourier (FTIR) en el rango de 2000 a 650 cm −1 . El análisis de espectroscopía de fotoelectrones de rayos X (XPS) se realizó en un instrumento Thermo-Fisher Escalab 250Xi para caracterizar el componente químico de los compuestos de Li-Nb-O. El área de superficie específica se midió en un aparato de área de superficie (Micromeritics ASAP 2460) a 77 K por N 2 método de adsorción / desorción (método BET). Los espectros de fotoluminiscencia (PL) se detectaron utilizando un espectrofotómetro de fluorescencia F-280 con una longitud de onda de excitación de 320 nm.
Para evaluar el rendimiento fotocatalítico de los compuestos de Li-Nb-O, se llevó a cabo la degradación de la solución acuosa de azul de metileno (MB) (5 mg / L) bajo irradiación de una lámpara de 500 W Hg a un valor de pH natural. Se dispersaron cincuenta miligramos de polvos en 50 ml de solución acuosa MB. Antes de la irradiación, la suspensión se agitó en la oscuridad durante 1 h para lograr el equilibrio de adsorción. Luego, la suspensión se irradió con la lámpara de Hg. La concentración de MB residual se analizó con un intervalo de 30 min utilizando un espectrofotómetro ultravioleta-visible de infrarrojo cercano (UV-vis-NIR) a 665 nm.
Resultados y discusión
Los patrones de XRD de los productos obtenidos después de la reacción hidrotermal con diferentes proporciones molares de Li / Nb se muestran en la Fig. 1. Es obvio que el LiNbO 3 puro La fase (JCPDF, No. 20-0631) se obtiene con Li:Nb =2:1. Para la relación de Li / Nb menor que 2:1, como 1:1 o 1:3, la fase principal sigue siendo LiNbO 3 , acompañado del residuo de Nb 2 O 5 (JCPDF, No. 37-1468), lo que significa que el contenido de Li no es suficiente para reaccionar completamente con Nb 2 O 5 para formar LiNbO 3 . Cuando aumentamos el contenido de Li en gran medida, ocurre un fenómeno sorprendente:no hay LiNbO 3 se formó después de la reacción hidrotermal, como se muestra claramente en la Fig. 1. Cuando la proporción de Li / Nb es 4:1 o mayor, solo Nb 2 O 5 La fase existe en patrones XRD, no se detectan otras impurezas. ¿Se elimina el ion de litio durante el proceso de lavado? Tal como se informó en la literatura anterior [23].
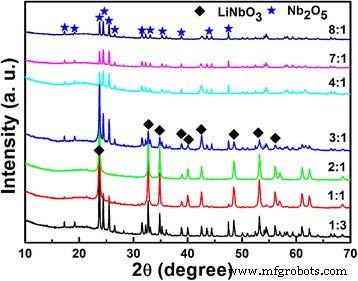
Patrones XRD de los polvos de Li-Nb-O obtenidos después de la reacción hidrotermal con diferentes proporciones molares de Li / Nb
Para ilustrar la evolución de la fase cuando la relación Li / Nb es suficientemente grande, los productos obtenidos por el método hidrotermal, usando Li / Nb =8:1 como ejemplo, se calcinan a diferentes temperaturas y los patrones de XRD se muestran en la Fig.2. . Cuando los productos se calcinan a 500 y 600 ° C, una nueva fase LiNbO 3 Aparece lo que demuestra que existe un elemento Li en los productos obtenidos inmediatamente después de la reacción hidrotermal, aunque no detectado por XRD. Además, aparece un pico de difracción a 30,26 ° a 600 ° C, que puede indexarse como plano (410) de LiNb 3 monoclínico O 8 . La reacción se puede describir mediante la siguiente Eq. (1) [24]:
$$ {\ mathrm {LiNb} \ mathrm {O}} _ 3 + {\ mathrm {Nb}} _ 2 {\ mathrm {O}} _ 5 \ to {\ mathrm {LiNb}} _ 3 {\ mathrm {O}} _ 8 $ $ (1)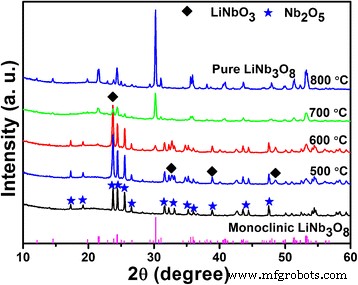
Patrones de XRD de los polvos de Li-Nb-O (relación molar de Li:Nb =8:1) calcinados a diferentes temperaturas durante 2 h
A 700 ° C, el monoclínico LiNb 3 O 8 es la fase predominante con impurezas casi insignificantes. La fase pura de LiNb 3 O 8 se obtiene a 800 ° C con todos los picos de difracción indexados a la fase monoclínica (JCPDF, No. 36-0307), un grupo espacial de P21 / a, que proporciona una nueva forma de preparar LiNb 3 O 8 compuestos.
También se realiza la prueba FTIR para estudiar la evolución de fase de los productos con Li:Nb =8:1, como se muestra en la Fig. 3. La materia prima Nb 2 O 5 se prueba como referencia. En la Fig.3, la banda a 962 cm −1 debido a las vibraciones de estiramiento de Nb =O en Nb 2 O 5 existe hasta 700 ° C [25]. Después de la reacción hidrotermal, no se detectan otras bandas en este rango significa que el único niobato sigue siendo Nb 2 O 5 . Cuando la temperatura de calcinación es de 500 y 600 ° C, una nueva banda a 891 cm −1 aparece, mientras que desaparece a 700 ° C, de acuerdo con los resultados de XRD de la formación y reacción de LiNbO 3 . A 700 y 800 ° C, las bandas a 908 y 828 cm −1 corresponden a la formación de LiNb 3 O 8 compuestos [26, 27]. Los resultados de FTIR son muy consistentes con los resultados de XRD de la Fig. 2.
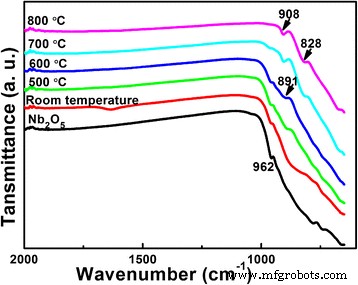
Espectros FTIR de Nb 2 O 5 materias primas y polvos de Li-Nb-O (relación molar de Li:Nb =8:1) calcinados a diferentes temperaturas
Con base en los resultados, podemos concluir que la relación Li / Nb tiene un gran impacto en la formación de LiNbO 3 ; la proporción menor de 3:1 es beneficiosa para la formación de LiNbO 3 , mientras que es mayor que 3:1, no LiNbO 3 formas en absoluto. Según el diagrama, el contenido de Li congruente es el 97,2% en moles del contenido de Nb para la preparación de LiNbO 3 monofásico perfecto , y el exceso o la deficiencia del contenido de Li se compensa con la formación de Li 3 NbO 4 o LiNb 3 O 8 fase [28]. El gran exceso de LiOH es beneficioso para formar Li 3 NbO 4 no LiNbO 3 , mientras que no Li 3 NbO 4 la fase se observa después de la reacción hidrotermal debido a la condición de reacción insuficiente; incluso si el LiNbO 3 partícula formada localmente, se disuelve fácilmente en una solución de LiOH con fuerte alcalinidad [29].
Como se discutió anteriormente, el elemento Li no se detecta después de la reacción hidrotermal sin más calcinación, mientras que realmente existe en los productos con Li:Nb =8:1. Para Nb 2 O 5 , ¿sigue siendo la misma que la materia prima después de la reacción hidrotermal? La prueba XPS se lleva a cabo para caracterizar el componente químico de Nb 2 O 5 materia prima y los productos obtenidos después de la reacción hidrotermal, como se muestra en la Fig. 4. La diferencia de Nb 3d 3/2 y 3d 5/2 es el 2,7 eV para ambas muestras, lo que indica el Nb 5+ estado en ambas muestras sin otras especies de óxidos de Nb reducidos [3]. Las energías de enlace de Nb 3d se desplazan hacia el estado de baja energía de enlace después de la reacción hidrotermal, alrededor de 0,5 eV de diferencia. Significa que el entorno químico del Nb cambia, mientras que no se forman otros compuestos. El cambio puede deberse a la existencia de iones Li en el producto; aunque no se forma un compuesto Li-Nb-O obvio, la existencia de iones Li con mayor iconicidad tiene una fuerte atracción de iones O alrededor de Nb, lo que resulta en el cambio químico de la energía de enlace Nb 3d.
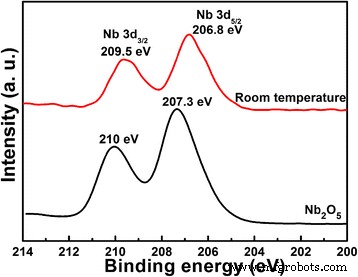
Espectros XPS de Nb 2 O 5 materias primas y productos (relación molar de Li:Nb =8:1) obtenidos después del método hidrotermal
La influencia de los iones Li en Nb 2 O 5 también se observa en imágenes SEM, como se muestra en la Fig. 5. La Figura 5a es la imagen de Nb 2 O 5 materia prima, de forma irregular, estructura densa y longitud de varios micrómetros. Después de la reacción hidrotermal, la partícula de cristal grande se divide en partículas pequeñas con un tamaño máximo de aproximadamente 200 nm, aunque las partículas pequeñas todavía se agregan juntas. A partir de los resultados de XRD y XPS, sabemos que las partículas pequeñas siguen siendo Nb 2 O 5 . El cambio de la morfología de Nb 2 O 5 puede atribuirse a la condición hidrotermal y al gran contenido de LiOH · H 2 O en materias primas.

Imágenes SEM de a Nb 2 O 5 materias primas y b los productos (relación molar de Li:Nb =8:1) obtenidos después del método hidrotermal
Los productos obtenidos después de la reacción hidrotermal se calcinan a 800 ° C con diferentes relaciones Li / Nb. A continuación, elegimos tres relaciones típicas de Li / Nb como ejemplos:1:3, 2:1 y 8:1. Los patrones de XRD de las tres muestras se muestran en la Fig. 6. De los resultados de XRD, LiNbO 3 puro se preparan con Li / Nb =2:1 y no ha mostrado ningún cambio incluso cuando se calcinó a 800 ° C. Para la preparación de otro compuesto Li-Nb-O LiNb 3 O 8 , se puede obtener con dos relaciones Li / Nb absolutamente opuestas:8:1 y 1:3 (designado como LiNb 3 O 8 -8:1 y LiNb 3 O 8 -1:3). Para otras relaciones Li / Nb que no se muestran en la Fig.6, los productos calcinados a 800 ° C dan como resultado la formación de dos fases mixtas:LiNb 3 O 8 y LiNbO 3 . Según los resultados de XRD, LiNb 3 puro O 8 los polvos se preparan con dos proporciones diferentes de Li / Nb, mientras que ¿existen diferencias entre los dos productos?
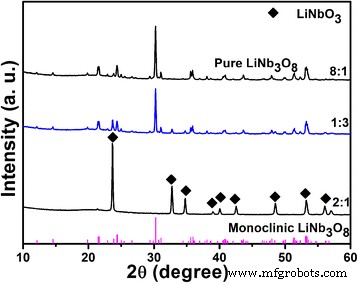
Patrones XRD de tres productos típicos de relaciones Li / Nb calcinados a 800 ° C durante 2 h
Las imágenes SEM de los dos productos se muestran como Fig. 7b, c, respectivamente. Como se muestra en la Fig.7, la morfología de LiNb 3 O 8 -1:3 son bastante diferentes a los de LiNb 3 O 8 -8:1. LiNb 3 O 8 -8:1 tiene una estructura porosa y hueca formada por LiNb 3 O 8 nanopartículas con una longitud de varios micrómetros, similar a la de un panal. Es bastante diferente con la agregación de partículas de la reacción de estado sólido, como LiNb 3 O 8 Se muestra -1:3. Las áreas BET de LiNb 3 O 8 -8:1 y LiNb 3 O 8 -1:3 son 4,46 y 0,96 m 2 / g, respectivamente, el área superficial mayor del primero resulta de la estructura porosa y hueca. La diferencia morfológica se puede atribuir a las diferentes morfologías de los reactivos:para LiNb 3 O 8 -8:1, el reactivo de LiNbO 3 se forma en base a las calcinaciones de los productos después de la reacción hidrotermal, la morfología de los productos se muestra en la Fig. 5b, mientras que para LiNb 3 O 8 -1:3, la morfología de LiNbO 3 obtenido directamente después de la reacción hidrotermal es similar a un hexaedro, como se muestra en la Fig. 7a [21]. La formación de la estructura porosa y hueca de LiNb 3 O 8 -8:1 se puede atribuir a la volatilización del litio durante el proceso de calcinación, que es beneficiosa para la formación de nuevos LiNb 3 O 8 partículas y redes entre las partículas [11]. Para LiNbO 3 calcinado a 800 ° C (es decir, Li / Nb =2:1), su tamaño de grano es de aproximadamente 200 nm y la forma parece irregular, como se muestra en la Fig. 7d; el área BET es de aproximadamente 3,91 m 2 / g.

Imágenes SEM de tres productos típicos de relaciones Li / Nb calcinados a diferentes temperaturas: a 2:1 a 500 ° C, b 1:3, c 8:1 y d 2:1 a 800 ° C
El rendimiento fotocatalítico de LiNb 3 O 8 y LiNbO 3 se muestran en la Fig. 8. A partir de los espectros de absorción UV-vis de MB en el tiempo de irradiación variado (Fig. 8a-d), se observa que la banda de absorción máxima (665 nm) se debilita con el aumento del tiempo de irradiación . La tasa de degradación de MB se mejora en gran medida con los catalizadores de LiNb 3 O 8 y LiNbO 3 bajo luz ultravioleta, especialmente para LiNb 3 O 8 -8:1, aproximadamente el 85% de MB degradado después de 30 min de irradiación, como se muestra en la Fig. 8e. Como la fotodegradación de MB usando catalizadores de Li-Nb-O obedece a la cinética de pseudo-primer orden, descrita por el modo cinético de Langmuir-Hinshelwood modificado [30], las constantes de la tasa de pseudo-primer orden ( k ) se calculan, que se muestran en la Fig. 8f. Las constantes de velocidad de primer orden obtenidas de MB sin catalizadores, LiNb 3 O 8 -1:3, LiNbO 3 y LiNb 3 O 8 -8:1 son 0,71 × 10 −2 , 1,61 × 10 −2 , 4,18 × 10 −2 y 6,73 × 10 −2 min −1 , respectivamente. Cuanto mayor sea la constante de velocidad de primer orden, más sobresaliente será el rendimiento fotocatalítico. El k de LiNb 3 O 8 -8:1 es 9,5 veces MB sin catalizadores, 4,2 veces LiNb 3 O 8 -1:3 y 1,6 veces LiNbO 3 . Comparado con LiNb 3 O 8 -1:3, el mayor rendimiento fotocatalítico de LiNb 3 O 8 -8:1 puede atribuirse a la estructura única porosa y hueca, que proporciona una alta densidad de sitios activos para la degradación de MB [31].
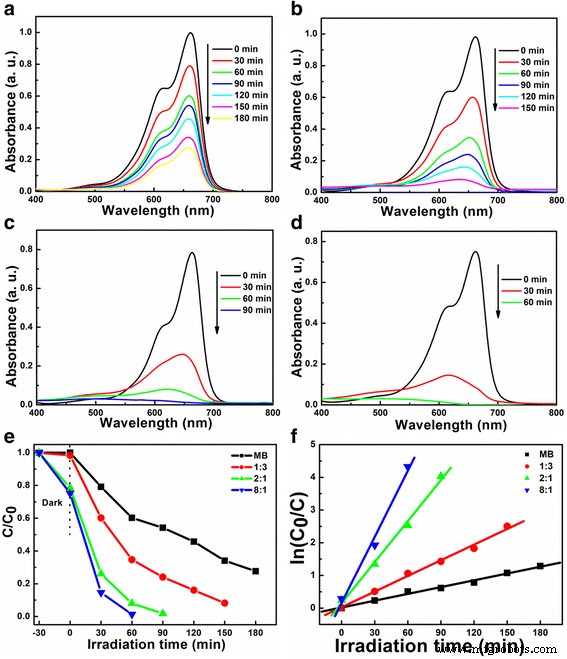
Espectros de absorción UV-vis de la degradación de MB: a sin catalizador y catalizado por b LiNb 3 O 8 -1:3, c LiNbO 3 y d LiNb 3 O 8 -8:1, respectivamente. e Fotodegradación de MB y f ajuste cinético con respecto al tiempo de irradiación utilizando polvos de Li-Nb-O
Comparado con LiNbO 3 , el rendimiento fotocatalítico mejorado de LiNb 3 O 8 -8:1, que tiene casi la misma capacidad de absorción de MB que LiNbO 3 , se puede atribuir a su tipo de estructura en capas con la simetría reducida. La estructura en capas puede mejorar la separación de electrones y huecos [32], de acuerdo con los espectros PL, como se muestra en la Fig. 9. Al mismo tiempo, el LiNb 3 O 8 la estructura está construida por tres octaedros niobatos diferentes y los átomos de Li comparten sitios octaédricos parciales; Se espera que el sitio octaédrico de niobato superior proporcione sitios más activos para la fotocatálisis. Finalmente, la banda prohibida de energía más pequeña de LiNb 3 O 8 (aproximadamente 3,9 eV) que el de LiNbO 3 (4.14 eV) significa que puede utilizar más luz incidente para participar en el proceso fotocatalítico [33].
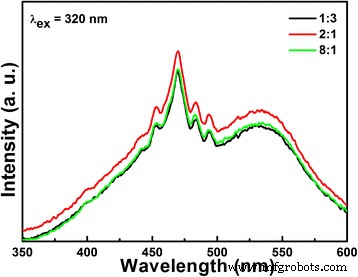
Espectros PL de temperatura ambiente de LiNb 3 O 8 -1:3, LiNbO 3 y LiNb 3 O 8 -8:1 catalizadores
La eficiencia de separación de los portadores fotogenerados de catalizador de Li-Nb-O se investiga mediante espectros de PL, como se muestra en la Fig. 9. Como sabemos, los espectros de emisión de PL resultan principalmente de la recombinación de portadores libres. Como se ve en la Fig. 9, LiNb 3 O 8 muestra picos de emisión más pequeños alrededor de 470 nm que LiNbO 3 . Significa que LiNb 3 O 8 tiene una vida útil más larga del portador de carga y una eficiencia mejorada de transferencia de carga interfacial, lo que se puede atribuir a su estructura en capas con la simetría reducida que mejora la separación de electrones y huecos.
Conclusiones
De los resultados anteriores, podemos concluir que la relación Li / Nb tiene un gran impacto en la formación de LiNbO 3 ; la proporción menor de 3:1 es beneficiosa para la formación de LiNbO 3 , aunque es mayor que 3:1, no forma LiNbO 3 en absoluto y la morfología y enlace químico de Nb 2 O 5 La materia prima está totalmente modificada por iones de Li. La razón se puede atribuir al gran contenido de LiOH, que es beneficioso para formar Li 3 NbO 4 no LiNbO 3 , y también, incluso si el LiNbO 3 La partícula se forma localmente, se disuelve fácilmente en una solución de LiOH con fuerte alcalinidad. Pure LiNb 3 O 8 los polvos se obtienen con dos relaciones Li / Nb absolutamente opuestas:8:1 y 1:3; el primero muestra una estructura porosa y hueca única, bastante diferente con la agregación de partículas (el último muestra). En comparación con Li / Nb =1:3, mayor rendimiento fotocatalítico de LiNb 3 O 8 (Li / Nb =8:1) y se puede atribuir a la estructura única porosa y hueca, que proporciona una alta densidad de sitios activos para la degradación de MB. Comparado con LiNbO 3 , el rendimiento fotocatalítico mejorado de LiNb 3 O 8 se puede atribuir a su tipo de estructura en capas con la simetría reducida que mejora la separación de electrones y huecos.
Nanomateriales
- Presentamos Mark X:rendimiento, precisión y presentación, todo en uno
- Cómo el Internet de las cosas cambia la industria 4.0 y los efectos del Internet de las cosas en las pymes
- Preparación de nanopartículas de mPEG-ICA cargadas con ICA y su aplicación en el tratamiento del daño celular H9c2 inducido por LPS
- Efectos del espesor de la bicapa en las propiedades morfológicas, ópticas y eléctricas de los nanolaminados de Al2O3 / ZnO
- La preparación de la nanoestructura yema-cáscara de Au @ TiO2 y sus aplicaciones para la degradación y detección del azul de metileno
- Preparación y rendimiento fotocatalítico de fotocatalizadores LiNb3O8 de estructura hueca
- Matrices de nanotubos de TiO2:fabricadas con una plantilla blanda-dura y la dependencia del tamaño de grano del rendimiento de las emisiones de campo
- Los efectos de acoplamiento de los polaritones de plasma superficial y las resonancias magnéticas dipolo en metamateriales
- Los efectos de combustión del plasma y el oxígeno/combustible
- Mejorar la precisión y el rendimiento de su máquina de corte por chorro de agua
- Fundamentos de la hoja de corte:los efectos de la calidad de la hoja en el rendimiento del corte



