Hidrocincita soportada por aerogel de sílice e hidrotalcita intercalada con carbonato para la eliminación de alta eficiencia de iones de Pb (II) mediante reacciones de transformación por precipitación
Resumen
En este trabajo, hidrocincita y Zn / Al-CO 3 2− La hidrotalcita soportada sobre aerogel de sílice se preparó mediante un proceso sencillo y económico y se utilizó como adsorbente para la eliminación de Pb (II). La hidrocincita y Zn / Al-CO 3 soportados 2− La hidrotalcita posee un espesor ultrafino, una gran superficie y una cristalinidad débil. En los experimentos de adsorción de Pb (II) por lotes, los adsorbentes con mayor contenido de Zn (II) mostraron mayores capacidades de adsorción de Pb (II), y los datos de adsorción encajaron bien con el modelo de isoterma de Langmuir y el modelo cinético de pseudo-segundo orden, lo que indica una mecanismo de quimisorción superficial. Las capacidades de adsorción calculadas según el modelo de isoterma de Langmuir son 684,9 mg / gy 555,6 mg / g para la hidrocincita y Zn / Al-CO 3 soportados 2− hidrotalcita, respectivamente, superior a las capacidades de adsorción de otros adsorbentes a base de hidrotalcita y la mayoría de los demás adsorbentes inorgánicos informados anteriormente. Los picos de difracción XRD de hidrocincita y Zn / Al-CO 3 2− la hidrotalcita desapareció después de la adsorción, y las especies de Pb (II) se dispersaron uniformemente en los adsorbentes en forma de Pb 3 (CO 3 ) 2 (OH) 2 probado por TEM, mapeo EDS y análisis XRD, lo que demuestra que la naturaleza de la adsorción es la conversión por precipitación de hidrocincita o Zn / Al-CO 3 2− hidrotalcita en Pb 3 (CO 3 ) 2 (OH) 2 . Estos resultados demuestran el efecto de eliminación sinérgico de Pb (II) del CO 3 2− y OH - derivado de hidrocincita y Zn / Al-CO 3 2− La hidrotalcita junto con su espesor ultrafino y su gran superficie contribuyen a las excelentes propiedades de los adsorbentes.
Antecedentes
La contaminación por metales pesados (p. Ej., Pb, Cd y Hg) en los sistemas de distribución de agua y las aguas superficiales causa graves problemas ambientales y de salud de los organismos vivos y ha sido una gran preocupación mundial durante muchos años [1, 2]. Se han utilizado diversas tecnologías, que incluyen precipitación química [3], adsorción [4, 5], intercambio iónico [6, 7], etc. para la eliminación de iones de metales pesados altamente tóxicos del agua, entre las cuales la adsorción es la más utilizada. debido a su simplicidad de funcionamiento, alta eficiencia [8, 9] y poca influencia en el entorno de supervivencia de la biología acuática como el pH [10], por lo que habría una gran fluctuación al eliminar iones de metales pesados mediante precipitación química utilizando altas concentraciones de precipitante reactivos. Por estas razones, se han desarrollado y desarrollado una serie de materiales absorbentes, como materiales inorgánicos [11,12,13,14,15], polímeros [16], biomateriales [17, 18] y resinas de sorción [7, 8]. aplicado para la adsorción de iones metálicos tóxicos de aguas residuales. Sin embargo, todavía existen algunos desafíos que restringen el enfoque de adsorción, como el área de superficie limitada y las correspondientes capacidades de adsorción bajas para la mayoría de los adsorbentes. Por lo tanto, es deseable explorar nuevos materiales adsorbentes de gran área superficial para la eliminación de iones de metales pesados con alta eficiencia.
Las hidrotalcitas (HT, también llamadas hidróxidos dobles en capas), que consisten en capas octaédricas de tipo brucita apiladas que están compuestas por hidróxidos de metales bivalentes y trivalentes con aniones y moléculas de agua que ocupan el espacio entre capas, se han utilizado ampliamente para adsorber varios aniones por intercambio iónico [ 19,20,21]. Estos materiales también se estudiaron como absorbentes y eliminadores de cationes de metales pesados de las aguas en los últimos años [22,23,24,25,26]. El bajo costo, la preparación simple y la alta eficiencia de sorción hacen que estos materiales sean adecuados para su aplicación en el campo del tratamiento de aguas residuales [27, 28]. Los mismos HT podrían adsorber cationes metálicos tóxicos a través de tres vías:(1) sustitución isomorfa de iones metálicos divalentes en el cristal HT por iones metálicos divalentes tóxicos con radios iónicos similares en la solución [24, 27]; (2) reacción del componente hidróxido metálico (principalmente hidróxidos metálicos divalentes) en los HT con iones metálicos tóxicos con diferentes radios iónicos [29]; (3) reacción del carbonato entre capas con iones metálicos tóxicos [29]. A partir de lo anterior, los componentes de hidróxido de metal divalente y carbonato de capa intermedia en las capas son componentes funcionales principales en los HT para la adsorción de iones metálicos tóxicos y, por lo tanto, se espera que los HT intercalados de carbonato (carbonato-HT) que contienen ambos componentes tengan un rendimiento óptimo de adsorción de metales. iones. Sin embargo, los polvos HT sintetizados por métodos convencionales suelen tener áreas superficiales específicas bajas [30], lo que restringe sus propiedades de adsorción. Una buena forma de mejorar la superficie de los HT es apoyándolos en soportes de gran superficie. Li y col. [31] materiales porosos preparados (SBA-15) soportados HT con alta área de superficie mediante tratamiento hidrotermal de larga duración de los óxidos de metales mixtos soportados por SBA-15 preparados previamente. Jong y col. [32] nanofibras de carbono sintetizadas soportaron plaquetas HT con tamaño pequeño y área de superficie mejorada. Sin embargo, los métodos de soporte anteriores son algo complicados y los materiales de soporte son caros. Además, hay pocos informes sobre la adsorción de iones metálicos tóxicos por las sales de hidróxido de carbonato de metal divalente, que también contienen hidróxidos de carbonato e hidróxidos de metales divalentes como carbonato-HT. Por lo tanto, se espera que el desarrollo de sales de hidróxido de carbonato soportado de bajo costo y fácil preparación y carbonato-HT con un área de superficie alta mejore la adsorción de iones metálicos tóxicos.
Los aerogeles de sílice (SA) han despertado mucho interés tanto en la ciencia como en la tecnología debido a su baja densidad aparente, su gran superficie y su baja conductividad térmica [33, 34]. Además, SA es económico (US $ 2 ~ 3 / Kg) debido a su fabricación a gran escala y a una gran demanda en la industria del aislamiento térmico. Por lo tanto, en el presente trabajo, la hidrocincita (Zn 5 (OH) 6 (CO 3 ) 2 ) y Zn / Al-CO 3 2− hidrotalcita apoyada en SA comercial, que proporciona espacios confinados y sitios de nucleación para la carga y el crecimiento de hidrocincita y Zn / Al-CO 3 2− hidrotalcita, se prepararon mediante un método fácil. Las propiedades de textura de la hidrocincita y Zn / Al-CO 3 soportados por SA 2− hidrotalcita se caracterizaron por TEM, XRD, ICP y BET. Se evaluó especialmente el impacto del contenido de iones Zn (II) y el pH para la síntesis de adsorbentes sobre las capacidades de adsorción. Además, se investigaron el equilibrio de adsorción y la cinética y se ajustaron con los modelos de isoterma y cinética correspondientes, respectivamente. Los adsorbentes después de la adsorción se caracterizaron mediante mapeo TEM, XRD y EDS. Finalmente, se discutió un posible mecanismo de adsorción en este sistema de adsorción.
Métodos
Materiales
El nitrato de zinc, el nitrato de aluminio, el hidrogenocarbonato de sodio, el hidróxido de sodio y el nitrato de plomo eran todos de calidad analítica y se compraron a Aladdin Reagent Co., Ltd. (Shanghai, China). El ácido clorhídrico (36–38%) era de calidad analítica y se compró a Sinopharm Chemical Reagent Co., China (Shanghai, China). SA fue proporcionada por Nano Tech Co, LTD (Shaoxing, China).
Preparación de los adsorbentes
El polvo de SA se calcinó a 823 K durante 2 h para eliminar los grupos orgánicos de la superficie antes de su uso. El SA tratado (500 mg) se dispersó en 500 mL de agua desionizada por ultrasonido durante 30 min. A la suspensión de SA obtenida, 25 ml de solución mixta (A) de m mol Zn (NO 3 ) 2 y n mol Al (NO 3 ) 3 en 150 mL de agua desionizada y se agitó durante 5 min, y luego 125 mL de solución mixta A y otra solución mixta de NaOH / NaHCO 3 (0,5 M / 0,5 M) se añadió gota a gota alternativamente. La relación Zn:Al se varió de manera que m + n =0,0075 mol y m : n =3:0, 3:1, 2:1 y 0:1. Los valores de pH finales de las soluciones se ajustaron a 8,8 o 9,5 con la solución mixta anterior de NaOH / NaHCO 3 seguido de un tratamiento hidrotermal a 80 ° C durante 24 h. Los productos obtenidos se recogieron por centrifugación, se lavaron con agua desionizada tres veces y se secaron al vacío. Las muestras finales de hidrocincita soportada por SA (hidrocincita, m : n =3:0) e hidrotalcita de Zn / Al ( m : n =3:1 y 2:1) se indicaron como SA-Zn-HZ y SA-Zn x Al-HT, respectivamente, donde x representa la relación molar de metal divalente / metal trivalente en la solución precursora. La muestra de control de hidróxido de aluminio soportado por SA se designó como SA-Al-H ( m : n =0:1).
Caracterización
Se tomaron micrografías electrónicas de transmisión utilizando el microscopio electrónico JEM-1011 que opera a un voltaje de aceleración de 80 kV. Se obtuvieron micrografías electrónicas de barrido y espectros de dispersión de energía utilizando el microscopio electrónico de barrido JSM-6360LV equipado con un analizador de rayos X de dispersión de energía X-act (EDX) (Oxford INCA). N 2 Las isotermas de adsorción-desorción se obtuvieron usando un analizador de poros Micromeritics ASAP TriStar II 3020 a 77 K en condiciones de adsorción continua. Las muestras se desgasificaron a 150 ° C durante 8 h antes de las mediciones. Las áreas de superficie específicas se calcularon mediante el método de Brunauer-Emmett-Teller, y las distribuciones del tamaño de los poros se midieron utilizando el análisis de Barrett-Joyner-Halenda de las ramas de desorción de las isotermas de nitrógeno. El patrón de difracción de rayos X (XRD) se recogió usando un difractómetro Empyrean XRD. El contenido de elementos de Zn, Si y Al de los adsorbentes se determinó mediante espectroscopía de emisión atómica de plasma acoplado inductivamente (espectrómetro Leeman Prodigy XP ICP-AES).
Experimento de adsorción
La solución acuosa de Pb (II) (1000 ppm) se preparó disolviendo Pb (NO 3 ) 2 en agua desionizada. Posteriormente, se diluyó con agua desionizada hasta la concentración deseada. Las soluciones de Pb (II) con diferentes concentraciones se ajustaron para lograr un pH de aproximadamente 6,0 con 0,1 mol de L −1 Soluciones acuosas de HCl o NaOH. Normalmente, se colocaron 50 mg de adsorbentes en 100 ml de soluciones acuosas de Pb (II) con diferentes concentraciones (100, 200, 300, 400, 500 y 1000 ppm) en un matraz Erlenmeyer, respectivamente. Luego, se agitó el matraz Erlenmeyer (150 rpm) en un agitador incubador con una temperatura establecida de 25 ° C durante un período de 24 h para alcanzar el equilibrio de adsorción. Al final de cada proceso de adsorción, las suspensiones se centrifugaron y los sobrenadantes se filtraron y se utilizaron para determinar las cantidades de Pb (II) mediante el espectrofotómetro de adsorción atómica (AAS) Shimadzu AA-6300. Las capacidades de adsorción de los adsorbentes se calcularon de acuerdo con la siguiente ecuación: q e =( C 0 - C e ) V / m, donde q e representa la cantidad adsorbida en equilibrio (mg g −1 ), C 0 y C e son las concentraciones iniciales y de equilibrio de contaminantes en solución (mg L −1 ), V es el volumen de las soluciones de Pb (II) (ml) y m es el peso seco de los adsorbentes (g). Para el análisis de la cinética de adsorción, se agregaron 50 mg de adsorbentes a 100 mL de solución de Pb (II) con una concentración de 500 ppm. Las suspensiones se agitaron (150 rpm) a 25 ° C. A intervalos de tiempo de reacción específicos de 10, 30, 50, 70, 100, 140, 180, 240, 360, 600 y 1440 min, se tomaron 2 ml de suspensiones y se filtraron mediante una membrana de 0,22 ml. La concentración de Pb (II) en el filtrado se analizó mediante espectrofotómetro de adsorción atómica de llama (Shimadzu AA-6300).
Resultados y discusión
La optimización de los parámetros de síntesis
Para investigar el efecto de los parámetros de síntesis de los adsorbentes sobre su rendimiento de adsorción, las capacidades máximas de adsorción de SA-Zn-HZ, SA-Zn 3 Al-HT, SA-Zn 2 Se probaron Al-HT y SA-Al-H preparados en proporciones variadas de precursor de Zn / Al (3:0, 3:1, 2:1 y 0:1) y pH (8.8 y 9.5) (Fig.1) . Las capacidades máximas de adsorción son 680,8 mg g −1 , 537,8 mg g −1 , 429,5 mg g −1 y 176,4 mg g −1 , respectivamente, para SA-Zn-HZ, SA-Zn 3 Al-HT, SA-Zn 2 Al-HT y SA-Al-H preparados a un pH de 9.5, y esos son 510.6, 482.2, 405.7 y 111.8 mg / g, respectivamente, para SA-Zn-HZ, SA-Zn 3 Al-HT, SA-Zn 2 Al-HT y SA-Al-H preparados a un pH de 8,8. Por lo tanto, se puede concluir que altos contenidos de metales divalentes y pH (como 9.5) en medio sintético son beneficiosos para promover las propiedades de adsorción. El SA-Zn-HZ y SA-Zn 3 Se tomaron Al-HT sintetizados a un pH de 9.5 con altas capacidades de adsorción para los caracteres de textura, el equilibrio de adsorción y la investigación cinética en las siguientes secciones.
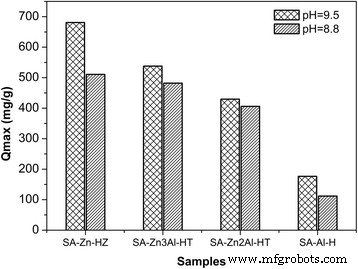
Las capacidades máximas de adsorción de SA-Zn-HZ, SA-Zn x Al-HT y la muestra de control SA-Al-H con varios contenidos de Zn. De izquierda a derecha, el contenido del elemento Zn disminuyó gradualmente
Los caracteres de textura de SA-Zn-HZ y SA-Zn 3 Al-HT
La morfología de SA-Zn-HZ, SA-Zn 3 Al-HT, y el transportador SA se caracterizó por TEM como se muestra en la Fig. 2 y el archivo adicional 1:Figura S1. Hidrocincita (HZ) y Zn / Al-CO 3 2− HT en SA-Zn-HZ y SA-Zn 3 Los compuestos de Al-HT, respectivamente, mostraron todos una estructura de escamas con un espesor ultradelgado (<5 nm). Los parámetros de textura de SA-Zn-HZ y SA-Zn 3 Al-HT se enumeran en la Tabla 1, y las áreas superficiales de SA-Zn-HZ y SA-Zn 3 Al-HT calculado a partir de N 2 isotermas de adsorción-desorción (Fig. 3a) son 264,1 m 2 g −1 y 233,9 m 2 g −1 , respectivamente, menor que el del sustrato SA (archivo adicional 1:Tabla S1 y Figura S2), debido al posible bloqueo de la estructura de poros de SA por HZ laminar y Zn / Al-CO 3 2− HT y la mayor densidad de HZ y HT que la de SA. Como se muestra en la Fig. 3b, los patrones XRD presentan una estructura de hidrocincita (PDF # 19-1458, Zn 5 (CO 3 ) 2 (OH) 6 ) para SA-Zn-HZ y una estructura típica de hidrotalcita intercalada con carbonato (PDF n. ° 51-1525) para SA-Zn 3 Al-HT, respectivamente. Sin embargo, la fuerza de los picos de difracción característicos de ambas muestras es débil, lo que indica la estructura en capas ultradelgadas y la cristalinidad relativamente débil de HZ y HT en los compuestos.

Imágenes TEM de SA-Zn-HZ ( a , b ), SA-Zn 3 Al-HT ( c , d ) preparado a un pH de 9,5
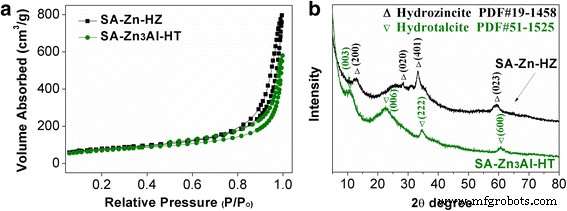
N 2 isotermas de adsorción-desorción ( a ) y patrones XRD ( b ) de SA-Zn-HZ y SA-Zn 3 Al-HT
Isotermas de adsorción de iones Pb (II) en SA-Zn-HZ y SA-Zn 3 Al-HT
El efecto de las concentraciones iniciales de Pb (II) (100, 200, 300, 400, 500 y 1000 ppm) sobre las propiedades de adsorción de SA-Zn-HZ y SA-Zn 3 Al-HT se incluye en la Fig. 4a. Como era de esperar, las capacidades de adsorción de ambos adsorbentes aumentaron con las concentraciones iniciales ascendentes de Pb (II). A concentraciones iniciales bajas de 100, 200 y 300 ppm, las capacidades de adsorción de Pb (II) eran casi linealmente proporcionales a las concentraciones iniciales de Pb (II) tanto para SA-Zn-HZ como para SA-Zn 3 Al-HT. Sin embargo, a concentraciones iniciales altas de Pb (II) de 400, 500 y 1000 ppm, las capacidades de adsorción aumentan lentamente y casi se acercan a sus capacidades máximas de adsorción, lo cual se debe a la falta de sitios de adsorción disponibles en adsorbentes que puedan acomodar más Pb ( II) iones. Los datos de la isoterma de adsorción se ajustaron con los modelos de Langmuir, Freundlich, Sips y Redlich-Peterson, que se representaron matemáticamente como Ecs. (1), (2), (3) y (4) [13, 24, 35,36,37], respectivamente:
$$ {C} _e / {q} _e =1 / \ left ({q} _m {K} _L \ right) + {C} _e / {q} _m $$ (1) $$ \ ln {q} _e =\ ln {K} _F + \ left (1 / n \ right) \ ln {C} _e $$ (2) $$ {q} _e ={q} _m {\ left ({K} _S {C} _e \ right)} ^ {n {} _ s} / \ left \ {1 + {\ left ({K} _S {C} _e \ right)} ^ {n {} _ s} \ right \} $$ (3 ) $$ {q} _e ={q} _m \ left ({K} _ {\ mathrm {RP}} {C} _e \ right) / \ left \ {1 + {\ left ({K} _ {\ mathrm {RP}} {C} _e \ right)} ^ {n_ {RP}} \ right \} $$ (4)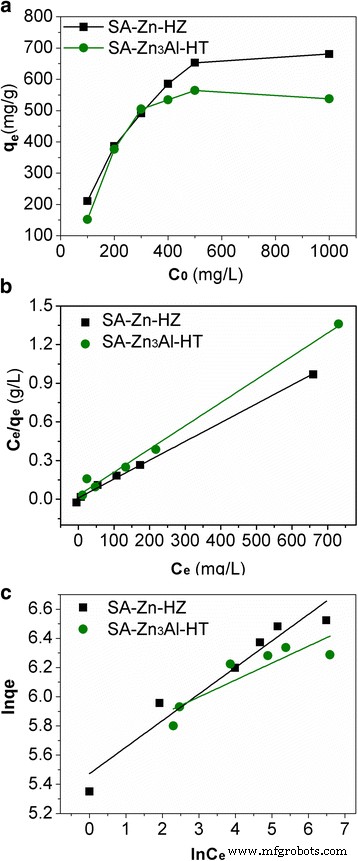
Isotermas de adsorción de Pb (II) en SA-Zn-HZ y SA-Zn 3 Al-HT ( a ), Langmuir ( b ) y Freundlich ( c ) modelos de isotermas de adsorción adecuados para la adsorción de Pb (II). Condiciones del experimento:concentración inicial de Pb (II) 100 ~ 1000 ppm; dosis de adsorbente 0,5 g L −1 ; tiempo de contacto 24 h, solución pH 6,0 ± 0,1; temperatura 30 ° C
Donde C e (mg / L) es la concentración de equilibrio en la fase acuosa; q e (mg / g) es la cantidad de equilibrio adsorbida por el adsorbente; q m (mg / g) indica la capacidad de adsorción saturada teórica; K L (L / mg) es la constante de Langmuir relacionada con la energía de adsorción-desorción y la afinidad de los sitios de unión por los iones; K F es aproximadamente un indicador de la capacidad de adsorción, y 1 / n es la intensidad de adsorción; K S (L / mmol) es la constante isoterma Sips y n S es el factor de heterogeneidad de Freundlich; K RP (L / mg) y n RP son constantes de Redlich-Peterson. Los datos de adsorción y los gráficos de ajuste de los modelos Langmuir, Freundlich, Sips y Redlich-Peterson para la adsorción de Pb (II) en SA-Zn-HZ y SA-Zn 3 Al-HT se muestran en la Fig. 4b, cy el archivo adicional 1:Figura S3, y los parámetros calculados de estos modelos se dan en la Tabla 2 y el archivo adicional 1:Tabla S2. Para los cuatro modelos estudiados, el modelo de Langmuir mostró coeficientes de correlación más significativos ( R 2 ≥ 0,99) con los datos experimentales que los de los modelos de Freundlich, Sips y Redlich-Peterson, respectivamente, y las capacidades máximas de adsorción de SA-Zn-HZ y SA-Zn 3 Al-HT para Pb (II) según el modelo de Langmuir son 684,9 mg / gy 555,6 mg / g, respectivamente.
Cinética de adsorción de iones Pb (II) en SA-Zn-HZ y SA-Zn 3 Al-HT
Se investigó la cinética de adsorción para determinar el tiempo requerido para el equilibrio de adsorción y explicar el mecanismo de adsorción de Pb (II) en los adsorbentes. Datos cinéticos de adsorción de Pb (II) en SA-Zn-HZ y SA-Zn 3 En la Fig. 5a se presentó Al-HT de 0 a 1440 min (24 h). Puede verse que las velocidades de adsorción para ambos adsorbentes fueron rápidas dentro de los primeros 50 minutos, luego disminuyeron gradualmente y, posteriormente, se alcanzó el equilibrio de adsorción. Las rápidas tasas de eliminación de Pb (II) al principio pueden atribuirse a la rápida difusión de Pb (II) desde la solución a granel a las superficies externas de los adsorbentes y una gran cantidad de sitios disponibles de los adsorbentes en la etapa inicial. En etapas posteriores, el lento proceso de adsorción probablemente se atribuyó a la mayor distancia de difusión del Pb (II) sobre el adsorbente y a los sitios de adsorción de superficie limitados de los adsorbentes. Investigar el mecanismo de adsorción de Pb (II) en SA-Zn-HZ y SA-Zn 3 Al-HT, los resultados experimentales se ajustaron con los modelos cinéticos de pseudo-primer orden y pseudo-segundo orden expresados por las Ecs. (5) y (6) [35, 38], respectivamente.
$$ \ ln \ left ({q} _e- {q} _t \ right) =\ ln {q} _e- {k} _1t $$ (5) $$ t / {q} _t =1 / \ left ( {k} _2 {q_e} ^ 2 \ right) + t / {q} _e $$ (6)donde q t (mg / g) es la cantidad de adsorbato eliminado por el adsorbente en el momento t (min); q e (mg / g) es la capacidad de adsorción en equilibrio; k 1 (mínimo −1 ) y k 2 (g / (mg min −1 )) son las constantes de velocidad de los modelos de pseudoprimer orden y pseudo-segundo orden, respectivamente. Las gráficas lineales de ln ( q e - q t ) versus t y las parcelas de t / q t contra t para los modelos cinéticos de pseudo-primer orden y pseudo-segundo orden, respectivamente, se muestran en la Fig. 5b, c. Las capacidades de adsorción ( q e ) y las constantes de velocidad ( k 1 y k 2 ) calculados a partir de las pendientes e intersecciones de las parcelas se resumen en la Tabla 3. Obviamente, el modelo de pseudo-segundo orden con coeficientes de correlación más altos ( R 2 > 0,99) puede ajustarse a los datos cinéticos experimentales mejor que el modelo de pseudo primer orden. Además, los valores de capacidad de adsorción ( q e , cal ) calculados a partir del modelo de pseudo-segundo orden son muy consistentes con el q experimental e valores ( q e, exp ). Estos resultados sugirieron que predominaba el mecanismo de sorción del modelo cinético de pseudo-segundo orden, lo que demuestra que la tasa global de absorción de Pb (II) parecía estar controlada por un proceso de quimisorción [13, 39].
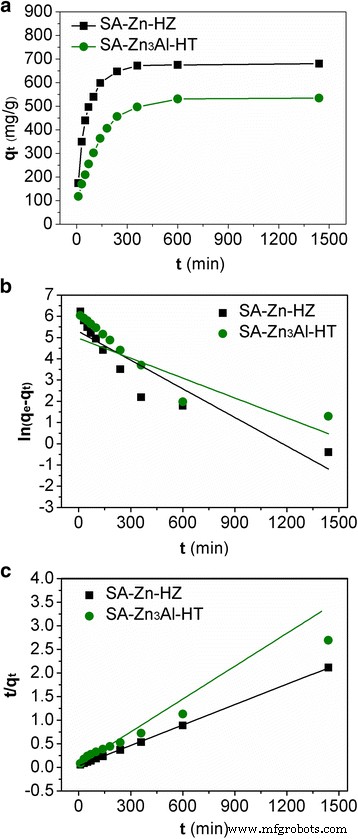
Cinética de adsorción de Pb ( II ) en SA-Zn-HZ y SA-Zn 3 Al-HT ( a ) y gráficos de pseudoprimer orden ( b ) y pseudo-segundo orden ( c ) modelos cinéticos de adsorción equipados para adsorción de Pb (II). Condiciones del experimento:concentración inicial de Pb (II) 500 ppm; dosis de adsorbente 0,5 g L −1 ; tiempo de contacto 0 ~ 24 h, solución pH 6,0 ± 0,1; temperatura 30 ° C
Mecanismo de adsorción y evaluación del rendimiento
Para explorar más el mecanismo de adsorción de Pb (II) en SA-Zn-HZ y SA-Zn 3 Al-HT, las muestras SA-Zn-HZ y SA-Zn 3 Al-HT después de la adsorción (SA-Zn-HZ-Pb y SA-Zn 3 Al-HT-Pb) se caracterizaron por TEM, mapeo EDS y XRD. Tanto SA-Zn-HZ-Pb como SA-Zn 3 Al-HT-Pb (Fig.6) tienen mayor contraste que SA-Zn-HZ y SA-Zn 3 Al-HT en imágenes TEM (Fig. 2), respectivamente, lo que demuestra que se ha adsorbido un alto número atómico de Pb en los adsorbentes de la solución. En el mapeo elemental EDS del archivo adicional 1:Figura S4 y Figura S5, es obvio que el elemento Pb está uniformemente disperso en SA-Zn-HZ-Pb y SA-Zn 3 Al-HT-Pb, que indica indirectamente la nucleación heterogénea de especies de Pb (II) en la superficie de los adsorbentes. El análisis XRD (Fig.7) mostró la especie Pb (II) en SA-Zn-HZ-Pb y SA-Zn 3 Todos los Al-HT-Pb existen en forma de Pb 3 (CO 3 ) 2 (OH) 2 (Hydrocerussite, PDF # 13-0131), que es más estable que Pb (OH) 2 o PbCO 3 debido a la menor constante del producto de solubilidad del primero (3,16 × 10 −46 ) en comparación con los de este último (1,43 × 10 −15 para Pb (OH) 2 y 7,9 × 10 −14 para PbCO 3 ) [40, 41]. Los cambios de pH de la solución con el tiempo en la adsorción se presentan en la Fig. 8. En el tiempo de contacto inicial (0 ~ 210 min), el pH de la solución aumentó continuamente principalmente porque la hidrocincita y la hidrotalcita compuestas de hidróxidos se disolvieron para alcanzar una precipitación-disolución. equilibrio en la solución de Pb débilmente ácida que resultó en la liberación de OH - . Sin embargo, el pH de la solución disminuyó gradualmente con el aumento continuo del tiempo de contacto (210 ~ 1440 min), lo que probablemente se deba a que la hidrocerusita producida en la adsorción depositada en la superficie de la hidrocincita y la hidrotalcita impidió la disolución adicional de ambos adsorbentes y la posterior liberación. de OH - , mientras tanto el OH - se consumió secuencialmente para generar hidrocerusita junto con CO 3 2− y Pb 2+ en la solución. En general, las soluciones de Pb (II) tienen una fluctuación de pH baja con un rango de 6.0 ~ 6.39 y 6.0 ~ 6.21 en el proceso de adsorción usando SA-Zn-HZ y SA-Zn 3 Al-HT como adsorbentes, respectivamente, manifestando que ambos adsorbentes tienen un bajo impacto en el pH del cuerpo de agua.

Imágenes TEM de SA-Zn-HZ-Pb ( a ) y SA-Zn 3 Al-HT-Pb ( b )
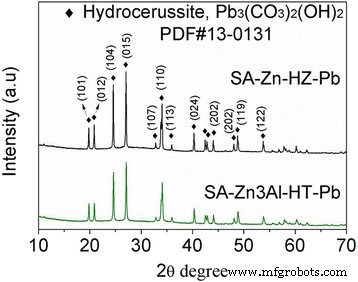
Patrones XRD de SA-Zn-HZ-Pb y SA-Zn 3 Al-HT-Pb
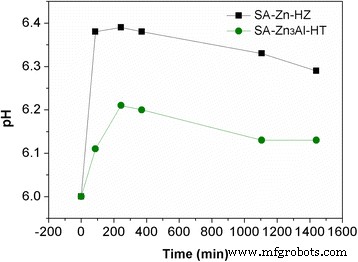
Valores de pH de las soluciones de Pb (II) frente al tiempo de adsorción utilizando SA-Zn-HZ y SA-Zn 3 Al-HT como adsorbentes
En este sistema de adsorción, la sustitución isomórfica del divalente de Zn (II) en SA-Zn-HZ y SA-Zn 3 Al-HT por Pb (II) es imposible debido al radio iónico mucho mayor de Pb (II) (0.119 nm) que el de Zn (II) (0.074 nm). Por lo tanto, la reacción de HZ o Zn / Al-CO 3 2− La HT con cationes tóxicos de Pb (II) probablemente contribuyó en gran medida a la adsorción y provocó la precipitación de hidrocerusita. La transformación de precipitación de HZ (o Zn / Al-CO 3 2− HT) a hidrocerusita en la solución acuosa que contiene Pb (II) probablemente se debió a la menor constante del producto de solubilidad de la última que de la primera [42]. Además, en este sistema de adsorción, el proceso de adsorción basado en las reacciones de transformación de precipitación superficial es irreversible. Antes de alcanzar la adsorción saturada, los catalizadores se pueden reutilizar repetidamente y mostraron una alta eficiencia de eliminación (> 93,5%) en cada ciclo (Fig. 9). Una vez que se alcanza la adsorción saturada, los adsorbentes no pueden reutilizarse incluso después de la calcinación, lo que puede atribuirse a la razón de que los componentes funcionales de la superficie (hidrocincita e hidrotalcita) en los adsorbentes saturados se han transformado en hidrocerusita y la adsorción adicional está restringida.
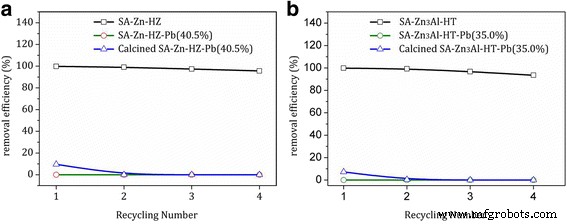
Reciclaje para la eliminación de Pb (II) por a SA-Zn-HZ prístino, SA-Zn-HZ saturado (SA-Zn-HZ-Pb (40,5%)) y SA-Zn-HZ saturado después de la calcinación; b prístino SA-Zn 3 Al-HT, SA-Zn 3 saturado Al-HT (SA-Zn-HZ-Pb (35,0%)) y SA-Zn 3 saturado Al-HT después de la calcinación. Concentración inicial de Pb (II) 100 ppm; dosis de adsorbente 0,5 g L −1 ; tiempo de contacto 24 h, solución pH 6,0 ± 0,1; temperatura 30 ° C
Las capacidades máximas de adsorción de SA-Zn-HZ y SA-Zn 3 Los Al-HT para Pb (II) basados en el modelo de isoterma de Langmuir son 684,9 y 555,6 mg / g, respectivamente, más altos que los de otros adsorbentes a base de hidrotalcita y la mayoría de los demás adsorbentes inorgánicos como el óxido de grafeno, los nanotubos de carbono y el carbón activado. adsorbentes basados en compuestos (Tabla 4). Las propiedades de adsorción superiores junto con el bajo costo y la facilidad de preparación hacen que SA-Zn-HZ y SA-Zn 3 Recolectores altamente competitivos de Al-HT para la eliminación de Pb (II) de las aguas residuales.
Conclusiones
Hemos demostrado las propiedades de textura, las propiedades de adsorción de Pb (II), la cinética de adsorción y el posible mecanismo de adsorción de la hidrocincita soportada por aerogel de sílice y Zn-Al-CO 3 2− hidrotalcita. Tanto la hidrocincita como el Zn / Al-CO 3 soportados 2− La hidrotalcita posee un espesor ultrafino (<5 nm) y una gran superficie. En los experimentos de adsorción de Pb (II) por lotes, los datos de adsorción encajaron bien con el modelo de isoterma de Langmuir y el modelo cinético de pseudo-segundo orden, lo que indica un proceso de quimisorción de superficie. Las capacidades de adsorción saturadas calculadas en base al modelo de isoterma de Langmuir son 684,9 y 555,6 mg / g para la hidrocincita soportada y Zn / Al-CO 3 2− hidrotalcita, respectivamente, cerca de los valores experimentales y superiores a las capacidades de adsorción de otros adsorbentes a base de hidrotalcita y la mayoría de los demás adsorbentes inorgánicos informados anteriormente. Después de la adsorción, las especies de Pb (II) adsorbidas en los adsorbentes existen en forma de hidrocerusita y los picos de difracción XRD de hidrocincita o Zn / Al-CO 3 2− la hidrotalcita desapareció, lo que demuestra que la naturaleza de la adsorción es probablemente la conversión por precipitación de hidrocincita o Zn / Al-CO 3 2− hidrotalcita en hidrocerusita con un producto de baja solubilidad constante en la solución de Pb (II). Finalmente, este trabajo proporcionaría una referencia para desarrollar nuevos absorbentes de iones de metales pesados, por ejemplo, , inmovilización de iones metálicos tóxicos en la superficie de los adsorbentes en forma de precipitados especiales con constantes de producto de baja solubilidad mediante reacciones de transformación de precipitación.
Nanomateriales
- Por qué la impresión 3D y el software son cruciales para la transformación digital
- Transformación digital en la fabricación:los aceleradores y la hoja de ruta para los fabricantes
- Eliminación por adsorción de iones de cobre (II) de una solución acuosa utilizando un nano-adsorbente de magnetita de residuos de cascarilla de molino:síntesis, caracterización, adsorción y mode…
- Metasuperficies dieléctricas de alto orden para divisores de haz de polarización de alta eficiencia y generadores de vórtices ópticos
- Nanoestructuras de superficie formadas por separación de fases de película de nanocompuesto de polímero y sal metálica para aplicaciones antirreflectantes y superhidrofóbicas
- Sílice recubierta de titanio sola y modificada con alginato de sodio como absorbentes de iones de metales pesados
- 20 herramientas y equipos básicos de soldadura para principiantes
- ¿Cuáles son los abrasivos adecuados para su trabajo de remoción y acabado de metal?
- Consejos para aplicar lubricante para metales:evitar el exceso de grasa y más
- Terminología metalúrgica explicada:un glosario para fabricantes y maquinistas
- Centros de mecanizado CNC para extracción de metal de precisión



