Medición de pH
Una medida muy importante en muchos procesos químicos líquidos (industriales, farmacéuticos, de fabricación, de producción de alimentos, etc.) es la del pH:la medida de la concentración de iones de hidrógeno en una solución líquida. Una solución con un valor de pH bajo se llama "ácido", mientras que una con un pH alto se llama "cáustica". La escala de pH común se extiende desde 0 (ácido fuerte) a 14 (cáustico fuerte), con 7 en el medio representando agua pura (neutra):
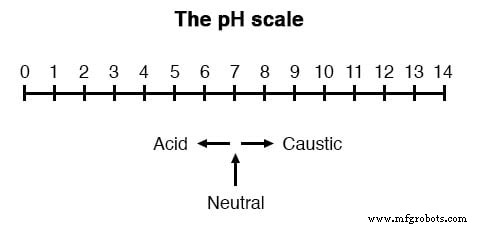
El pH se define de la siguiente manera:la letra minúscula "p" en pH representa el logaritmo común negativo (base diez), mientras que la letra mayúscula "H" representa el elemento hidrógeno. Por tanto, el pH es una medida logarítmica del número de moles de iones de hidrógeno (H +) por litro de solución. Por cierto, el prefijo "p" también se usa con otros tipos de mediciones químicas donde se desea una escala logarítmica, siendo pCO2 (dióxido de carbono) y pO2 (oxígeno) dos de esos ejemplos.
La escala de pH logarítmica funciona así:una solución con 10 -12 moles de iones H + por litro tiene un pH de 12; una solución con 10 -3 moles de iones H + por litro tiene un pH de 3. Aunque es muy poco común, existe algo así como un ácido con una medición de pH por debajo de 0 y un cáustico con un pH por encima de 14. Tales soluciones, comprensiblemente, están bastante concentradas y extremadamente reactivo.
Electrodos de pH
Si bien el pH se puede medir mediante cambios de color en ciertos polvos químicos (la "tira de tornasol" es un ejemplo familiar de las clases de química de la escuela secundaria), el monitoreo y control continuo del proceso del pH requiere un enfoque más sofisticado. El enfoque más común es el uso de un electrodo especialmente preparado diseñado para permitir que los iones de hidrógeno en la solución migren a través de una barrera selectiva, produciendo una diferencia de potencial (voltaje) medible proporcional al pH de la solución:
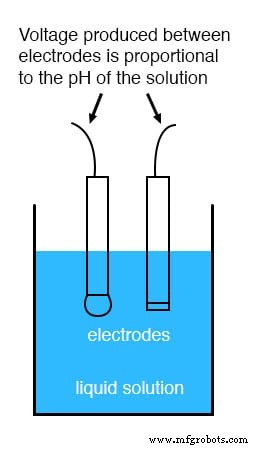
El diseño y la teoría operativa de los electrodos de pH es un tema muy complejo, que se explora aquí solo brevemente. Lo que es importante entender es que estos dos electrodos generan un voltaje directamente proporcional al pH de la solución. A un pH de 7 (neutro), los electrodos producirán 0 voltios entre ellos. A un pH bajo (ácido) se desarrollará un voltaje de una polaridad, y a un pH alto (cáustico) se desarrollará un voltaje de la polaridad opuesta.
Electrodo de medición
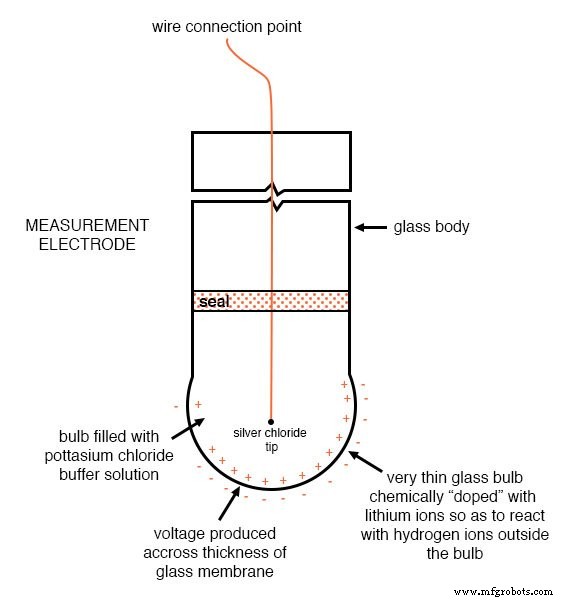
Una restricción de diseño desafortunada de los electrodos de pH es que uno de ellos (llamado medición electrodo) debe estar construido de vidrio especial para crear la barrera selectiva de iones necesaria para filtrar los iones de hidrógeno de todos los demás iones que flotan en la solución. Este vidrio está dopado químicamente con iones de litio, que es lo que lo hace reaccionar electroquímicamente a los iones de hidrógeno. Por supuesto, el vidrio no es exactamente lo que llamaría un "conductor"; más bien, es un aislante extremadamente bueno.
Esto presenta un problema importante si nuestra intención es medir el voltaje entre los dos electrodos. La ruta del circuito desde el contacto de un electrodo, a través de la barrera de vidrio, a través de la solución, al otro electrodo, y de regreso a través del contacto del otro electrodo, es una de extremadamente alta resistencia.
Electrodo de referencia
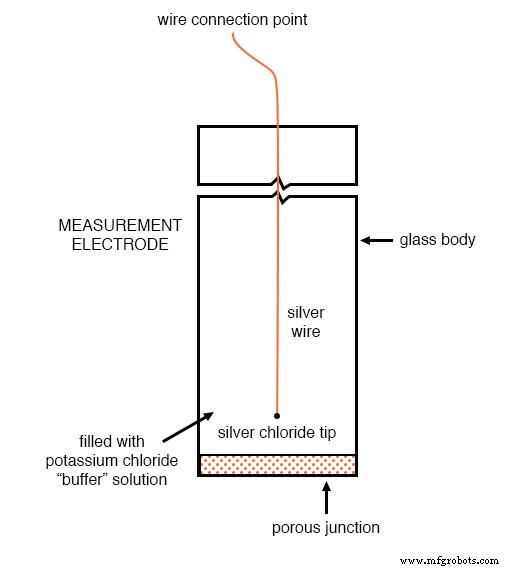
El otro electrodo (llamado referencia electrodo) está hecho de una solución química de solución tampón de pH neutro (7) (generalmente cloruro de potasio) a la que se le permite intercambiar iones con la solución de proceso a través de un separador poroso, formando una conexión de resistencia relativamente baja con el líquido de prueba. Al principio, uno podría estar inclinado a preguntar:¿por qué no sumergir un alambre de metal en la solución para obtener una conexión eléctrica con el líquido? La razón por la que esto no funcionará es que los metales tienden a ser altamente reactivos en soluciones iónicas y pueden producir un voltaje significativo a través de la interfaz de contacto de metal a líquido.
El uso de una interfaz química húmeda con la solución medida es necesario para evitar la creación de tal voltaje, que por supuesto sería interpretado erróneamente por cualquier dispositivo de medición como indicativo de pH.
Aquí hay una ilustración de la construcción del electrodo de medición. Tenga en cuenta la delgada membrana de vidrio dopada con litio a través de la cual se genera el voltaje de pH:
Aquí hay una ilustración de la construcción del electrodo de referencia. La unión porosa que se muestra en la parte inferior del electrodo es donde el tampón de cloruro de potasio y el líquido de proceso interactúan entre sí:
El propósito del electrodo de medición es generar el voltaje utilizado para medir el pH de la solución. Este voltaje aparece a lo largo del espesor del vidrio, colocando el alambre plateado en un lado del voltaje y la solución líquida en el otro. El propósito del electrodo de referencia es proporcionar una conexión estable de voltaje cero a la solución líquida para que se pueda hacer un circuito completo para medir el voltaje del electrodo de vidrio.
Si bien la conexión del electrodo de referencia al líquido de prueba puede ser solo de unos pocos kiloohmios, la resistencia del electrodo de vidrio puede variar de diez a novecientos megaohmios, ¡dependiendo del diseño del electrodo! Siendo que cualquier corriente en este circuito debe viajar a través de ambos resistencias de los electrodos (y la resistencia presentada por el líquido de prueba en sí), estas resistencias están en serie entre sí y, por lo tanto, se suman para hacer un total aún mayor.
Un voltímetro ordinario analógico o incluso digital tiene una resistencia interna demasiado baja para medir el voltaje en un circuito de tan alta resistencia. El diagrama de circuito equivalente de un circuito de sonda de pH típico ilustra el problema:
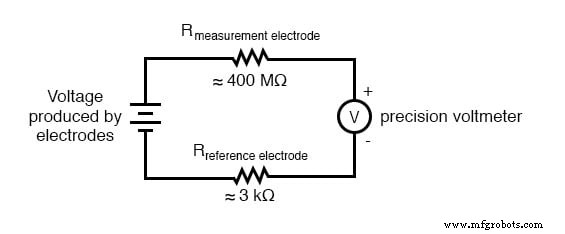
Incluso una corriente de circuito muy pequeña que viaja a través de la alta resistencia de cada componente del circuito (especialmente la membrana de vidrio del electrodo de medición), producirá caídas de voltaje relativamente sustanciales a través de esas resistencias, reduciendo seriamente el voltaje visto por el medidor. Para empeorar las cosas, está el hecho de que el diferencial de voltaje generado por el electrodo de medición es muy pequeño, en el rango de milivoltios (idealmente 59,16 milivoltios por unidad de pH a temperatura ambiente). El medidor utilizado para esta tarea debe ser muy sensible y tener una resistencia de entrada extremadamente alta.
La solución más común a este problema de medición es utilizar un medidor amplificado con una resistencia interna extremadamente alta para medir el voltaje del electrodo, a fin de extraer la menor cantidad de corriente posible a través del circuito. Con componentes semiconductores modernos, un voltímetro con una resistencia de entrada de hasta 10 17 Ω se puede construir con poca dificultad. Otro enfoque, que rara vez se ve en el uso contemporáneo, es utilizar una configuración potenciométrica de medición de voltaje de "equilibrio nulo" para medir este voltaje sin dibujar ninguno corriente del circuito bajo prueba. Si un técnico desea verificar la salida de voltaje entre un par de electrodos de pH, esta sería probablemente la forma más práctica de hacerlo usando solo equipos de medición de sobremesa estándar:
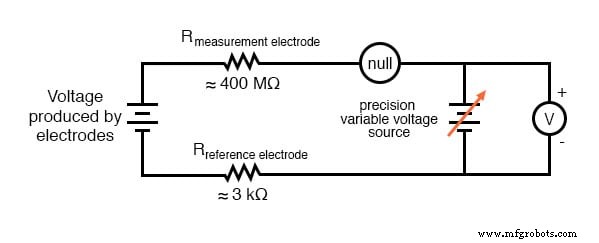
Como es habitual, el técnico ajustará el suministro de voltaje de precisión hasta que el detector nulo registre cero, luego se vería el voltímetro conectado en paralelo con el suministro para obtener una lectura de voltaje. Con el detector "anulado" (registrando exactamente cero), debe haber corriente cero en el circuito del electrodo de pH y, por lo tanto, no debe haber caída de voltaje en las resistencias de ninguno de los electrodos, lo que da el voltaje real del electrodo en los terminales del voltímetro.
Los requisitos de cableado para los electrodos de pH tienden a ser incluso más estrictos que el cableado de termopar, y exigen conexiones muy limpias y distancias cortas de cable (10 yardas o menos, incluso con contactos chapados en oro y cable blindado) para una medición precisa y confiable. Sin embargo, al igual que con los termopares, las desventajas de la medición del pH con electrodos se compensan con las ventajas:buena precisión y relativa simplicidad técnica.
Pocas tecnologías de instrumentación inspiran el asombro y la mística que domina la medición del pH, porque es muy incomprendida y difícil de solucionar. Sin dar más detalles sobre la química exacta de la medición del pH, aquí se pueden dar algunas palabras de sabiduría sobre los sistemas de medición del pH:
- Todos los electrodos de pH tienen una vida útil limitada, y esa vida útil depende en gran medida del tipo y la gravedad del servicio. En algunas aplicaciones, la vida útil de un electrodo de pH de un mes puede considerarse prolongada, y en otras aplicaciones, se puede esperar que los mismos electrodos duren más de un año.
- Debido a que el electrodo de vidrio (medición) es responsable de generar el voltaje proporcional al pH, es el que debe considerarse sospechoso si el sistema de medición no genera suficiente cambio de voltaje para un cambio dado en el pH (aproximadamente 59 milivoltios por pH). unidad), o no responde lo suficientemente rápido a un cambio rápido en el pH del líquido de prueba.
- Si un sistema de medición de pH "se desvía", creando errores de compensación, es probable que el problema esté en el electrodo de referencia, que se supone que proporciona una conexión de voltaje cero con la solución medida.
- Debido a que la medición del pH es una representación logarítmica de la concentración de iones, existe una increíble variedad de condiciones de proceso representadas en la escala de pH aparentemente simple de 0-14. Además, debido a la naturaleza no lineal de la escala logarítmica, un cambio de 1 pH en el extremo superior (digamos, de 12 a 13 pH) no representa la misma cantidad de cambio de actividad química que un cambio de 1 pH en el extremo inferior. (digamos, de 2 a 3 pH). Los ingenieros y técnicos de sistemas de control deben ser conscientes de esta dinámica si hay alguna esperanza de controlar procesar el pH a un valor estable.
- Las siguientes condiciones son peligrosas para los electrodos de medición (vidrio):altas temperaturas, niveles extremos de pH (ya sea ácido o alcalino), alta concentración iónica en el líquido, abrasión, ácido fluorhídrico en el líquido (¡el ácido HF disuelve el vidrio!), y cualquier tipo de revestimiento de material en la superficie del vidrio.
- Los cambios de temperatura en el líquido medido afectan tanto la respuesta del electrodo de medición a un nivel de pH dado (idealmente a 59 mV por unidad de pH) como el pH real del líquido. Los dispositivos de medición de temperatura se pueden insertar en el líquido y las señales de esos dispositivos se pueden usar para compensar el efecto de la temperatura en la medición del pH, pero esto solo compensará la respuesta mV / pH del electrodo de medición, no el cambio de pH real del proceso. líquido!
Todavía se están realizando avances en el campo de la medición del pH, algunos de los cuales son muy prometedores para superar las limitaciones tradicionales de los electrodos de pH. Una de esas tecnologías utiliza un dispositivo llamado transistor de efecto de campo para medir electrostáticamente el voltaje producido por una membrana permeable a iones en lugar de medir el voltaje con un circuito voltímetro real. Si bien esta tecnología tiene sus propias limitaciones, es al menos un concepto pionero y puede resultar más práctico en una fecha posterior.
REVISAR:
- El pH es una representación de la actividad de los iones de hidrógeno en un líquido. Es el logaritmo negativo del número de iones de hidrógeno (en moles) por litro de líquido. Por lo tanto:10 -11 moles de iones de hidrógeno en 1 litro de líquido =11 pH. 10 -5,3 moles de iones de hidrógeno en 1 litro de líquido =5.3 pH.
- La escala de pH básico se extiende de 0 (ácido fuerte) a 7 (agua neutra, pura) a 14 (cáustico fuerte). Las soluciones químicas con niveles de pH por debajo de cero y por encima de 14 son posibles pero raras.
- El pH se puede medir midiendo el voltaje producido entre dos electrodos especiales sumergidos en la solución líquida.
- Un electrodo, hecho de un vidrio especial, se llama medición electrodo. Es un trabajo generar un pequeño voltaje proporcional al pH (idealmente 59,16 mV por unidad de pH).
- El otro electrodo (llamado referencia electrodo) utiliza una unión porosa entre el líquido medido y una solución tampón estable de pH neutro (generalmente cloruro de potasio) para crear una conexión eléctrica de voltaje cero con el líquido. Esto proporciona un punto de continuidad para un circuito completo, de modo que el voltaje producido a través del espesor del vidrio en el electrodo de medición se puede medir con un voltímetro externo.
- La resistencia extremadamente alta de la membrana de vidrio del electrodo de medición exige el uso de un voltímetro con una resistencia interna extremadamente alta, o un voltímetro de balance nulo, para medir el voltaje.
Tecnología Industrial
- Ecuaciones diferenciales
- Integración HMI-PLC
- ¿Qué es la rugosidad de la superficie? Unidad, gráfico, medida
- Tecnología de inserción de monedas como solución térmica de PCB
- De principio a fin:los fundamentos de la medición de superficies
- Solución UGIPURE® 4472 recocida
- Solución UGIMA®-X 4305 recocida
- Solución UGI® 316Ti recocida
- UGIPERM® 12FM recocido en solución
- Solución UGIMA® 4598 recocida
- Solución UGI® S302 recocida



