Estudio antitumoral de nanogeles de condroitina sulfato-metotrexato
Resumen
Los nanogeles de autoensamblaje (NG) se formaron bioconjugando metotrexato (MTX) con sulfato de condroitina (CS). Los MTX-CS NG pueden mejorar en gran medida la solubilidad y mejorar la eficacia de administración de MTX debido a la propiedad de unión a CD44 de CS. Los experimentos de Vivo revelaron que los MTX-CS NG mostraron menos toxicidad que el MTX. Los MTX-CS NG pueden mejorar el efecto antitumoral al tiempo que reducen los efectos secundarios del MTX. Debido a su propiedad de unión a CD44, los conjugados de condroitín sulfato-fármaco podrían ser una plataforma prometedora y eficiente para mejorar la solubilidad de moléculas de fármacos poco solubles, así como la administración dirigida a células cancerosas y tejidos tumorales.
Antecedentes
El metotrexato (ácido 4-amino-10-metilfólico, MTX) es un análogo del folato, que pertenece a la familia de los antimetabolitos antifolato [1]. El MTX fue el primer fármaco utilizado en la terapia tumoral desde la década de 1950 [2], que es un fármaco antitumoral teratogénico y mutágeno, que actúa bloqueando la actividad enzimática e interfiriendo con la síntesis de ADN [3]. Estudios anteriores han demostrado que la administración de fármacos quimioterapéuticos a la célula diana por sí sola no es suficiente para inducir la muerte celular, y el MTX en dosis altas puede mejorar significativamente la tasa de curación y el pronóstico de los pacientes [4]. La baja solubilidad en agua, la baja permeabilidad y la vida media corta del MTX limitan su aplicación clínica [5, 6]. El efecto de la quimioterapia de MTX está influenciado en gran medida por su baja captación de células tumorales, biodistribución tisular y efectos secundarios graves [7]. Sin embargo, una mayor concentración de MTX puede aumentar el riesgo de efectos adversos debido a la escasa biodisponibilidad del MTX [8]. Existe una necesidad urgente de desarrollar un nuevo sistema de administración de fármacos para mejorar la biodisponibilidad de MTX y reducir sus efectos secundarios.
La nanotecnología tiene ventajas en los sistemas de administración de fármacos, incluida la mejora de la estabilidad del fármaco, la extensión de la circulación sanguínea, la reducción de los efectos secundarios y el control de la liberación del fármaco [9,10,11,12,13,14,15]. La tecnología de autoensamblaje se ha utilizado ampliamente en el campo de la administración de fármacos para mejorar la eficacia y reducir los efectos adversos de los fármacos [16,17,18,19,20]. Nuestro estudio tiene como objetivo diseñar un sistema de administración de fármacos nanogel para MTX para mejorar su solubilidad y biodistribución y reducir sus efectos secundarios. El condroitín sulfato (CS) es un glucosaminoglicano ácido (GAG), que constituye un componente importante del cartílago, las paredes de los vasos sanguíneos, la piel, los tendones y otros tejidos conectivos [21]. Los nanogeles basados en el sulfato de condroitina se han estudiado previamente [22, 23]. Los estudios encontraron que CD44 se une a un proteoglicano CS [24, 25, 26]. CD44 es una glicoproteína transmembrana con dominios extracelulares y se ha implicado en la mediación de las interacciones célula-célula y célula-ECM y desempeña un papel en la migración celular [27]. CD44 se expresa en gran medida en el cáncer metastásico en contraste con sus bajos niveles de expresión en tejidos normales [28]. Se han informado nanopartículas basadas en CS para el direccionamiento tumoral y la administración de fármacos antitumorales [29, 30]. Aquí, fabricamos un nuevo tipo de nanogeles CS-MTX de autoensamblaje en un esfuerzo por mejorar la entrega dirigida de moléculas de fármacos MTX a las células cancerosas a través de la interacción CS-CD44.
Métodos
Materiales y muestras
El sulfato de condroitina se adquirió de Dalian Meilun Biotech Co., Ltd. (Dalian, Liaoning, China). Se adquirieron 4-metilmorfolina, tetrahidrofurano y 2-cloro-4, 6-dimetoxi-1, 3, 5-triazina de Sun Chemical Technology (Shanghai, China) Co., Ltd., y se adquirió suero fetal bovino (FBS) de HyClone (Utah, EE. UU.). Todos los demás productos químicos se compraron a Sinopharm Chemical Reagent Co., Ltd. (Shanghai, China). Las ratas Lewis se compraron en Shanghai Sippr-BK Laboratory Animal Co., Ltd. (Shanghai, China).
Síntesis de DMT-MM
El cloruro de 4- (4,6-dimetoxi-1,3,5-triazin-2-il) -4-metilmorfolinio (DMT-MM) se utiliza para reacciones de condensación por deshidratación con activación de ácido carboxílico que se puede utilizar en disolvente acuoso o protónico. sistemas. Se disolvieron veinticinco gramos de 2-cloro-4, 6-dimetoxi-1, 3, 5-triazina (CDMT) en 200 ml de tetrahidrofurano (THF). A continuación, se añadieron gota a gota 18,79 ml de 4-metilmorfolina (NMM) a la solución de CDMT con agitación. Para asegurar una respuesta completa, se debe mantener la agitación durante 30 min. Luego, el producto filtrado se lavó tres veces con THF y se secó al vacío durante 24 h. El DMT-MM se obtuvo como un polvo blanco (esquema 1).
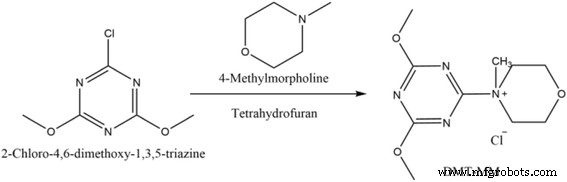
Vías sintéticas en la formación de DMT-MM
Síntesis de MTX-CS
El CS conjugado con MTX fue activado por DMT-MM. Para la activación de CS, se disolvió CS (1,0 g) en 20 ml de agua ultrapura y se activó añadiendo DMT-MM (0,769 g). La reacción se llevó a cabo durante 30 min a temperatura ambiente. Luego, el CS activado se hizo reaccionar adicionalmente con MTX durante 24 horas a temperatura ambiente. La solución se dializó durante 48 h con cambio de agua cada 4 hy se liofilizó. El MTX-CS se obtuvo como un polvo amarillo. El polvo amarillo se examinó mediante espectrometría de infrarrojos por transformada de Fourier (ALPHA, BRUKER, EE. UU.). Los espectros FTIR se registraron desde 400 a 4000 cm −1 . 1 Se usó H NMR para determinar si el MTX estaba conjugado con CS (esquema 2).
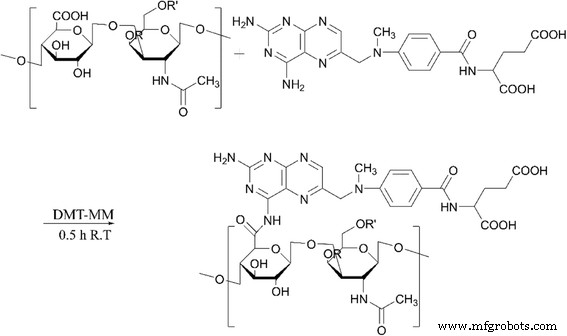
Vías sintéticas en la formación de MTX-CS
Citotoxicidad de los nanogeles MTX-CS
La citotoxicidad de los nanogeles se analizó usando A549T y cultivo de células tumorales Hela y células endoteliales de vena umbilical humana (HUVEC). Las células A549T y Hela se sembraron en placas de 96 pocillos a una densidad de 5 × 10 3 células por pocillo en 1640, suplementadas con FBS al 10% e incubadas durante 24 h en CO 2 al 5% a 37 ° C. A la A549T le siguió un tratamiento con diferentes concentraciones de MTX-CS NG (0, 5, 10, 20, 30, 40, 50, 100, 200, 400 μM), y a la Hela le siguió un tratamiento con diferentes concentraciones de MTX- CS NG (0, 5, 10, 30, 40, 60, 80, 100 μM) durante otras 48 h. Las concentraciones de MTX-CS NG se basaron en el contenido de MTX en cada muestra. Las concentraciones de CS se basaron en el contenido de MTX-CS NG en cada muestra. Las HUVEC se sembraron en placas de 96 pocillos a una densidad de 5 × 10 3 células por pocillo en DMEM, suplementadas con FBS al 10% e incubadas durante 24 h bajo CO 2 al 5% a 37 ° C. A continuación, se añadió a la HUVEC diferentes concentraciones de MTX-CS NG (0, 5, 10, 20, 30, 40, 50, 100, 200, 400 μM). Las concentraciones de MTX-CS NG se basaron en el contenido de MTX en cada muestra. Las concentraciones de CS se basaron en el contenido de MTX-CS NG en cada muestra. El ensayo MTT es una medida de la actividad celular. Se agregaron veinte microlitros de tampón CCK-8 a cada pocillo y se incubaron a 37 ° C bajo 5% de CO 2 durante otras 4 h. Se retiró el medio y se añadieron 200 µl de DMSO a cada pocillo. La absorbancia se midió a una longitud de onda de 490 nm (570 nm como referencia) en un lector de microplacas MULTISKAN GO (Thermo Scientific, EE. UU.).
Diseño animal y experimental
Para analizar la toxicidad de MTX-CS NG in vivo, se adquirieron dieciocho ratas macho Sprague-Dawley del Centro de Animales Experimentales de la Academia de Ciencias Médicas de Zhejiang (Hangzhou, Zhejiang, China). Esas ratas se alojaron bajo un ciclo de 12 horas de luz y 12 horas de oscuridad con acceso libre al agua y la comida. Las ratas, de 8 semanas de edad (200 ± 10 g), se dividieron aleatoriamente en tres grupos:grupo de control (inyectado con el mismo volumen de solución salina), grupo MTX (inyectado con 1,25 μmol kg −1 día −1 ) y el grupo MTX-CS NG (inyectado con 25 mg kg −1 día −1 MTX-CS NG). La dosis de MTX del grupo de MTX-CS NG fue igual a una dosis libre del grupo de MTX (1,25 μmol kg −1 día −1 ). Los fármacos se administraron otro día mediante inyecciones intraperitoneales, respectivamente. Después de 2 semanas de tratamiento (siete inyecciones en total), todas las ratas fueron sacrificadas por decapitación para futuras investigaciones.
Estudio histológico
Después de la decapitación, todos los bazos de las ratas se disecaron rápidamente y se lavaron dos veces con solución salina tamponada con fosfato (PBS) y se fijaron al 4% ( w / v ) paraformaldehído (pH =7,4) (Sigma-Aldrich, MO, EE.UU.) durante 24 h. Luego, los tejidos se prepararon para la tinción con hematoxilina y eosina (H&E) utilizando procedimientos estándar y se obtuvieron con un microscopio óptico de alta calidad.
Resultados y discusión
Síntesis de MTX-CS
Para determinar si el MTX se conjugó con CS, usamos FTIR y 1 H RMN para analizar las muestras de bioconjugado MTX, CS y MTX-CS. La Figura 1 muestra los espectros FTIR de CS (Figura 1a), MTX (Figura 1b) y bioconjugados MTX-CS (Figura 1c). Como se muestra en la Fig. 1b, MTX tenía una transmitancia característica a 3355, 2951, 1646, 1600, 1540, 1493, 1403 y 1207 cm −1 . El FTIR alcanza su punto máximo a 1600 y 1540 cm −1 puede asignarse al estiramiento de para-benceno, que podría encontrarse en el espectro FTIR de MTX (Fig. 1b) y bioconjugados MTX-CS (Fig. 1c). Los resultados de FTIR indicaron que MTX se conjugó con éxito con CS.
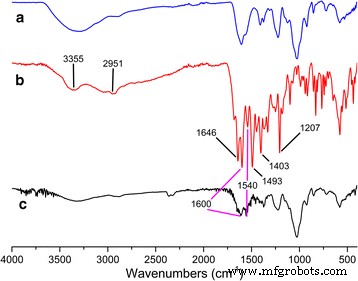
un Espectro FTIR de CS. b Espectro FTIR de MTX. c Espectro FTIR de MTX-CS
La Figura 2 muestra el 1 Espectros de RMN H de bioconjugados CS, MTX y MTX-CS. Los picos en 6,93 (2H, d, J =10,1 Hz) y 7,84 (2H, d, J =10,1 Hz) se puede asignar al grupo benzoílo de MTX. Los picos a 4,90 (2 H, s) se pueden asignar al metileno junto al grupo 2,4-diamino-6-pteridinilo, y los picos a 8,69 (1 H, s) se pueden asignar al 2, 4-diamino- Grupo 6-pteridinilo de MTX como sugiere la Fig. 2b. El 1 H NMR de CS-MTX (Fig. 2c) sugirió que el CS (parte de disacárido δ H las señales estaban entre 3,20 y 5,40, con 5,39 asignado como carbono anomérico) se unió con éxito al MTX (el desplazamiento químico del grupo benzoílo fue de 8,00 y 6,88, y el grupo metilo estaba en 3,20). La RMN también demostró que MTX estaba conjugado con CS.
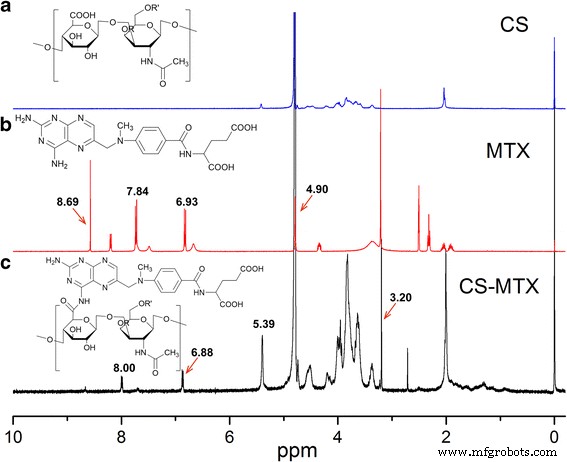
1 Espectros de H RMN de CS, MTX y CS-MTX. un 1 Espectros de H RMN de CS; CS se disolvió en D 2 O. b 1 Espectro de H RMN de MTX; Se disolvió MTX en dimetilsulfóxido-d6. c 1 Espectro de H RMN de CS-MTX; CS-MTX se disolvió en D 2 O
Para calcular la cantidad de MTX conjugado con CS, las muestras se disolvieron en agua ultrapura y se agitaron durante 48 ha temperatura ambiente. La cantidad de MTX se determinó mediante el uso de un espectrofotómetro UV-vis a 309 nm. La cantidad de MTX se midió mediante espectroscopía UV-vis. Finalmente, la cantidad calculada de metotrexato en MTX-CS NG fue del 13,65%. Los nanogeles formados por la encapsulación de moléculas de MTX hidrófobas por la capa exterior de cadenas laterales hidrófilas de CS (Fig. 3a). Los nanogeles se caracterizaron por dispersión dinámica de luz (DLS), microscopio de fuerza atómica (AFM) y microscopio electrónico de transmisión (TEM). Como se muestra, los datos de DLS midieron el tamaño de todos los nanogeles en el rango de 100 a 400 nm (Fig. 3b). El tamaño de partícula de las nanopartículas es principalmente de unos 200 nm. La imagen AFM de los nanogeles confirmó que las nanopartículas estaban bien distribuidas con un tamaño y morfología similares de aproximadamente 200 nm (Fig. 3c). Las imágenes TEM también mostraron que el tamaño de los nanogeles eran nanoesferas con un tamaño en el rango de 200 a 240 nm. El tamaño de partícula de las nanopartículas es principalmente de unos 200 nm (Fig. 3d, e).
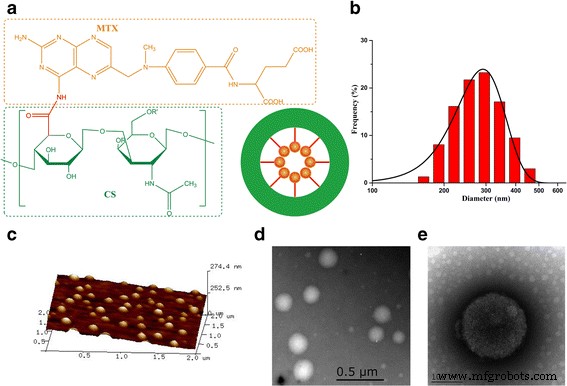
Ilustración esquemática de los MTX-CS NG. Caracterización de dispersión dinámica de luz (DLS), microscopio de fuerza atómica (AFM) y microscopía electrónica de transmisión (TEM) de MTX-CS NG. un Ilustración esquemática de los MTX-CS NG. b Tamaño de MTX-CS NG medido por DLS en experimentos representativos. c Imágenes AFM de MTX-CS NG. d , e Imágenes TEM de MTX-CS NG
Para calcular la cantidad de MTX conjugado con CS, las muestras se disolvieron en agua ultrapura y se agitaron durante 48 ha temperatura ambiente. La cantidad de MTX se determinó mediante el uso de un espectrofotómetro UV-vis a 313 nm.
La cantidad de MTX se midió mediante espectroscopía UV-vis. En primer lugar, se estableció una curva estándar de absorción de UV de metotrexato libre (Fig. 4). La relación entre la absorbancia y la concentración de MTX libre es:
$$ A \ kern0.5em =\ kern0.5em 0.0518 \ mathrm {C} \ kern0.5em + \ kern0.5em 0.0019 \ \ left ({R} ^ 2 \ kern0.5em =\ kern0.5em 0.9998 \ right) $$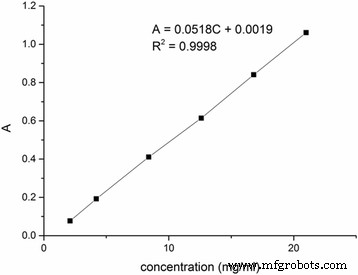
Curva estándar de absorción UV de metotrexato
Luego, se disolvieron 28,8 mg de MTX-CS en 1000 ml de agua ultrapura y la absorción de UV es 0,2055. Finalmente, la cantidad calculada de metotrexato en MTX-CS NG fue del 13,65%.
Citotoxicidad de los nanogeles MTX-CS
La actividad antitumoral in vitro de MTX-CS NG, MTX libre y MTX mezclado con CS se analizó utilizando cultivos de células tumorales A549T y Hela. Como muestra el ensayo MTT (Fig. 5), los MTX-CS NG podrían reducir significativamente la viabilidad de ambas células cancerosas, mientras que el MTX libre no mostró ningún efecto a altas concentraciones. MTX mezclado con CS a alta concentración incluso promueve el crecimiento de células cancerosas. La viabilidad de Hela se redujo del 73,81% para MTX libre al 60,16% para MTX-CS NG (disminución del 13,65% en la viabilidad celular) a la concentración de fármaco de 10 µM (Fig. 5a). Asimismo, la viabilidad de las células A549T se redujo del 80,23% para MTX libre al 46,04% para MTX-CS NG (disminución del 34,09% en la viabilidad celular) a la concentración de fármaco 50 µM (Fig. 5b). Los polisacáridos, como el ácido hialurónico, se utilizan como grupo de dirección de los conjugados o nanopartículas de fármacos para la terapia del cáncer, ya que se une específicamente al receptor CD44 [31]. El sulfato de condroitina también puede actuar como ligando para el receptor CD44 [25, 27], lo que significa que el CS puede promover la captación de MTX-CS NG por las células cancerosas y mejorar la eficacia farmacológica del MTX. Además, las nanopartículas pueden mejorar la estabilidad del fármaco y controlar su liberación [32, 33]. Todos los resultados demostraron que la actividad antitumoral de MTX-CS NG era mejor que MTX libre, así como MTX mezclado con CS. Con una mayor eficiencia de administración intracelular de moléculas de fármaco MTX, la selectividad de dirección de MTX-CS NG también mejoró en comparación con la misma concentración de MTX libre. Estos resultados demuestran que los MTX-CS NG tienen un mejor efecto antitumoral que el MTX libre.
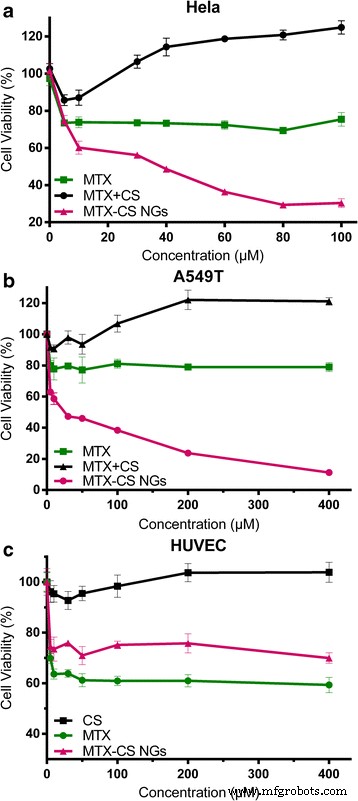
un Viabilidad celular de A549 T en presencia de MTX libre, MTX y CS libres y MTX-CS NG en 48 h. b Viabilidad celular de Hela en presencia de MTX libre, MTX y CS libres y MTX-CS NG en 48 h. c Viabilidad celular de HUVEC en presencia de MTX, CS y MTX-CS NG libres en 48 h
El efecto adverso de MTX-CS NG, MTX libre y CS se analizó utilizando cultivo HUVEC. Como muestra el ensayo MTT (Fig. 5c), los MTX-CS NG podrían reducir significativamente el efecto secundario mientras que el MTX libre podría reducir significativamente la viabilidad de HUVEC. La viabilidad de HUVEC aumentó del 63,6% para MTX libre al 73,5% para MTX-CS NG (aumento del 9,9% en la viabilidad celular) a la concentración de fármaco de 10 µM (Fig. 5c). La viabilidad celular de HUVEC a 400 µM era todavía del 69,95%. El resultado indicó que los MTX-CS NG podrían reducir los efectos secundarios en la célula normal.
Diseño animal y experimental
Uno de los principales efectos secundarios tóxicos del MTX utilizado para tratar a los pacientes con cáncer es la mucositis intestinal, que provoca una rápida reducción del peso corporal [34]. Luego probamos los efectos protectores de MTX-CS NG contra la pérdida de peso inducida por quimioterapia en ratas macho Sprague-Dawley. La supervivencia y los pesos se controlaron durante 14 días después de la inyección de solución salina, MTX libre y MTX-CS NG. No se encontraron muertes en ninguno de los tres grupos. Se observó una disminución abrupta en el peso corporal de todos los grupos de MTX (1,25 μmol kg −1 día −1 durante 14 días), lo que indica claramente que las ratas experimentaron el síndrome de quimioterapia y los daños inducidos por la quimioterapia, lo que resultó en enfermedad y pérdida de peso corporal, mientras que el peso corporal de las ratas tratadas con MTX-CS NG (4,25 mg kg −1 día −1 durante 14 días) tuvo un ligero aumento (Fig. 6). Los resultados muestran que los MTX-CS NG no causaron efectos adversos. Estos hallazgos apoyan la entrega de MTX al tejido tumoral a través de la interacción CD44-CS y reducen la citotoxicidad del fármaco MTX.
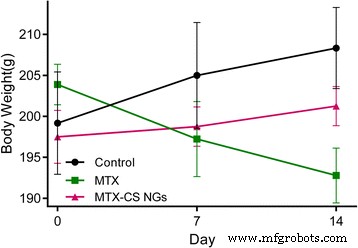
Efectos de MTX y MTX-CS NG sobre el peso corporal de la rata. El día de la primera inyección se consideró como el día 0. Solución salina, MTX (1,25 μmol kg −1 día −1 ) y MTX-CS NG (4,25 mg kg −1 día −1 ) recibieron otro día mediante inyecciones intraperitoneales, respectivamente, al grupo correspondiente. Los resultados se expresan como media ± SEM y se analizan usando t prueba. * P <0.05 en comparación con la fecha del día 0
Para investigar más a fondo la toxicidad in vivo de MTX-CS NG, se realizó un análisis histológico del bazo de ratas para determinar si MTX-CS NG causaba daño tisular (Fig. 7). Las secciones del grupo de control mostraron la estructura del bazo normal, compuesto de pulpa blanca (formas) y pulpa roja (RP), con trabéculas fibrosas (T) que se extienden hacia la pulpa esplénica. La pulpa blanca contiene vainas linfoides periarteriales y folículos esplénicos y está rodeada por zonas marginales, mientras que la pulpa roja está compuesta por cordones esplénicos y está separada por sinusoides esplénicos (Figs. 7a y 7b). El grupo tratado con MTX mostró un estrechamiento grave tanto de la pulpa blanca (caja negra) como de la RP. Los depósitos de hemosiderina también se pueden encontrar en el grupo tratado con MTX (Figs. 7c y 7d). El grupo tratado con MTX-CS NG mostró un leve estrechamiento tanto de la pulpa blanca (formas) como de la PR, sin que se encontraron depósitos de hemosiderina. Tanto la pulpa blanca como la roja mostraron un leve estrechamiento en comparación con el grupo de MTX (Figs. 7e y 7f). Los resultados anteriores indicaron que los MTX-CS NG tienen pocos efectos secundarios en el tejido normal [35, 36].
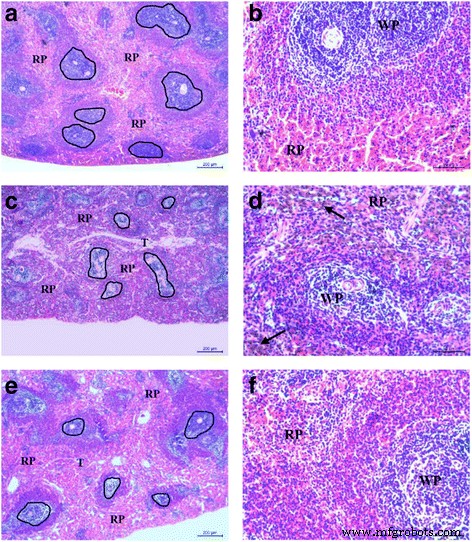
Los efectos de toxicidad de MTX y MTX-CS NG en el bazo de las ratas. Bazo teñido con H&E extirpado de ratones después de 14 días de tratamiento después de siete inyecciones intraperitoneales. un , b Secciones del grupo de control. c , d El grupo tratado con MTX. e , f El grupo tratado con MTX-CS NG
Conclusiones
En resumen, fabricamos con éxito nanogeles autoensamblados para una administración de fármacos antitumorales altamente eficiente. Los nanogeles conjugados con MTX-CS tenían un tamaño de aproximadamente 200 nm, mostrando buena estabilidad y solubilidad. Los MTX-CS NG mostraron una citotoxicidad más fuerte y específica que el MTX. Los experimentos in vivo revelaron que los MTX-CS NG mostraron menos toxicidad que el MTX. Los MTX-CS NG pueden mejorar el efecto antitumoral al tiempo que reducen los efectos secundarios del MTX. Debido a su propiedad de unión a CD44, los conjugados de condroitín sulfato-fármaco podrían ser una plataforma prometedora y eficiente para mejorar la solubilidad de moléculas de fármacos poco solubles, así como la administración dirigida activa y selectiva a células cancerosas y tejidos tumorales.
Abreviaturas
- 1 RMN H:
-
Resonancia magnética nuclear 1H
- AFM:
-
Microscopio de fuerza atómica
- CDMT:
-
2-cloro-4, 6-dimetoxi-1, 3, 5-triazina
- CS:
-
Sulfato de condroitina
- DLS:
-
Dispersión de luz dinámica
- DMT-MM:
-
Cloruro de 4- (4,6-dimetoxi-1,3,5-triazin-2-il) -4-metilmorfolinio
- FTIR:
-
Infrarrojos por transformada de Fourier
- MTT:
-
Bromuro de 3- (4,5-dimetil-2-tiazolil) -2,5-difenil-2-H-tetrazolio
- MTX:
-
Metotrexato
- MTX-CS NG:
-
Nanogeles de metotrexato-condroitín sulfato
- NG:
-
Nanogeles
- NMM:
-
4-metilmorfolina
- TEM:
-
Microscopio electrónico de transmisión
- THF:
-
Tetrahidrofurano
- UV-vis:
-
Espectroscopía ultravioleta visible
Nanomateriales
- Parche de nicotina
- Nanofibras y filamentos para una mejor administración de fármacos
- Reutilización de fármacos
- Administración de medicamentos basados en células para aplicaciones de cáncer
- Efecto superficial sobre el transporte de petróleo en nanocanales:un estudio de dinámica molecular
- El estudio de un nuevo sistema micelar similar a un gusano mejorado con nanopartículas
- Estudio de los primeros principios sobre la estabilidad y la imagen STM del borofeno
- Efectos del pH microambiental de los liposomas sobre la estabilidad química del fármaco cargado
- Nanotecnología:del sistema de imágenes in vivo a la administración controlada de fármacos
- Estudio in vitro de la influencia de nanopartículas de Au en las líneas celulares HT29 y SPEV
- Estudio numérico de un absorbedor solar eficiente que consta de nanopartículas metálicas



