Efectos del pH microambiental de los liposomas sobre la estabilidad química del fármaco cargado
Resumen
El liposoma es un sistema portador prometedor para la liberación de moléculas bioactivas. Sin embargo, el suministro exitoso de moléculas sensibles al pH todavía está limitado por la inestabilidad intrínseca de las cargas útiles en el entorno fisiológico. Aquí, desarrollamos un sistema de liposomas especial que posee un microambiente ácido en la cámara acuosa interna para mejorar la estabilidad química de cargas útiles sensibles al pH. Se prepararon liposomas cargados con curcumina (Cur-LP) con valores de pH internos variados (pH 2,5, 5,0 o 7,4). Estos Cur-LP tienen un tamaño de partícula similar de 300 nm, estabilidades físicas comparables y perfiles de liberación in vitro análogos. Curiosamente, la estabilidad química de la curcumina liposomal en suero bovino fetal al 50% y su eficacia anticancerosa in vitro dependen del pH microambiental (Cur-LP-2.5> Cur-LP-5.0> Cur-LP-7.4). Esta estabilidad del suero todavía tiene espacio para mejorar aún más para mejorar la aplicabilidad de Cur-LP. En conclusión, la creación de un microambiente ácido en la cámara interna del liposoma es factible y eficiente para mejorar la estabilidad química de las cargas útiles sensibles al pH.
Antecedentes
El liposoma, un vehículo de membrana artificial, ha mostrado un gran potencial en la administración de fármacos debido a su capacidad de carga de fármacos, biodegradabilidad y biocompatibilidad [1, 2, 3, 4]. El liposoma clásico es similar con una estructura de células vivas, que normalmente consta de una bicapa de fosfolípidos y una cámara interna acuosa [5, 6, 7]. Debido a esta estructura, el liposoma es capaz de solubilizar las moléculas insolubles del fármaco y evitar que el fármaco cargado del entorno fisiológico severo [8,9,10]. Además, la superficie de los liposomas se puede modificar para prolongar el tiempo de circulación sanguínea y / o atacar tejidos específicos [11,12,13,14,15]. Con estas ventajas antes mencionadas, se han aprobado clínicamente varios sistemas de liposomas [8, 9, 16].
Aunque la administración de muchos fármacos se ha mejorado mediante la incorporación en liposomas, la administración de algunos fármacos sensibles al pH todavía está limitada por la inestabilidad de la propia molécula del fármaco en el entorno fisiológico (valores de pH neutros). Generalmente, el liposoma se prepara en una solución tampón neutra y, por tanto, las moléculas de fármaco cargadas también se encuentran en un entorno neutro después de su incorporación al liposoma. Por consiguiente, aquellas moléculas que solo son estables en un entorno ácido serían aún inestables incluso en forma de liposomas. Por lo tanto, el desarrollo de un enfoque novedoso para mejorar la estabilidad de los fármacos sensibles al pH es de gran importancia para la entrega exitosa de estas cargas útiles por parte de los liposomas.
Como se mencionó anteriormente, el liposoma tiene un espacio acuoso en su cámara interior, que se puede utilizar para proporcionar cargas útiles de fármacos con un microambiente ácido (Fig. 1). En este trabajo, utilizamos la curcumina como fármaco modelo y nuestro objetivo es proporcionar un enfoque novedoso para mejorar la estabilidad química de las moléculas de fármaco cargadas en los liposomas. Es bien sabido que la curcumina es una molécula lipofílica y se ha utilizado ampliamente en alimentos, medicamentos y cosméticos debido a sus diversas bioactividades [17,18,19,20,21]. Sin embargo, su administración está muy limitada por su insolubilidad e inestabilidad en los fluidos biológicos [22,23,24,25]. Hasta ahora, todavía no ha cumplido su promesa clínica, en parte debido a la inestabilidad mediada por el pH [26]. Por lo tanto, la curcumina es un fármaco modelo adecuado para este trabajo.
Esquemas del liposoma con acidez microambiental variada en su cámara acuosa interna
Métodos
Materiales
Los fosfolípidos (lecitina de soja para uso inyectable) se adquirieron en Shanghai Tai-Wei Pharmaceutical Co., Ltd., (Shanghai, China). El colesterol se obtuvo de Amresco (Solon, OH, EE. UU.). Poloxamer 188 (F68) fue amablemente donado por BASF (China) Co., Ltd., (Shanghai, China). La curcumina fue suministrada por Sigma (St. Louis, MO, EE. UU.). El suero fetal bovino (FBS) se adquirió de HyClone (Logan, UT, EE. UU.). Todos los demás reactivos químicos utilizados en este estudio fueron de grado analítico o mejor.
Preparación de liposomas cargados con curcumina (Cur-LP)
Los liposomas con valores de pH microambientales variados se prepararon utilizando el método de evaporación de acuerdo con trabajos anteriores con algunas modificaciones [27, 28]. Brevemente, se disolvieron fosfolípidos (75 mg) y colesterol (5 mg) en 0,5 ml de etanol que contenía 2 mg / ml de curcumina. La solución de etanol se mezcló con 5 ml de PBS 0,001 M que contenía 1% ( w / v ) F68 que sirvió como tensioactivo para estrechar la distribución de tamaños. Después de agitar magnéticamente durante 1 min (mezclador magnético de temperatura constante, DF-101S, Zhengzhou Greatwall Scientific Industrial and Trade Co., Ltd., Zhengzhou, China), la emulsión resultante se evaporó al vacío y se oscureció durante 30 min a 35 ° C para eliminar el etanol. La acidez en la cámara interna de Cur-LP se ajustó mediante el uso de PBS con valores de pH variados de 2,5, 5,0 o 7,4 durante la preparación. La suspensión resultante se centrifugó a baja velocidad (3000 rpm, 5 min) para precipitar curcumina libre. Después, el sobrenadante se centrifugó a alta velocidad (16 krpm, 10 min) y los sedimentos se resuspendieron en PBS (pH 7,4) antes de su uso posterior. Este procedimiento proporcionó a estos LP un entorno externo idéntico. Los liposomas obtenidos con diferentes valores de pH microambientales se presentaron como Cur-LP-2.5, Cur-LP-5.0 y Cur-LP-7.4, respectivamente. Los liposomas en blanco también se fabricaron como se indicó anteriormente.
Caracterización de liposomas
El tamaño hidrodinámico, la distribución del tamaño y el potencial zeta son los tres parámetros básicos para los sistemas de liposomas. El tamaño y el potencial zeta de LP se determinaron mediante dispersión de luz dinámica (DLS) y dispersión de luz electroforética (ELS), respectivamente, utilizando ZetasizerNano ZS90 (Malvern Instruments Ltd., Malvern, Reino Unido) a 25 ° C [29]. El ciclo de medición fue determinado automáticamente por el sistema del instrumento. El tamaño de partícula se presentó mediante distribución de intensidad y la distribución de tamaño se evaluó mediante índice de polidispersidad (PDI).
Determinación de la eficiencia de encapsulación (EE)
EE, un parámetro importante para el control de calidad, es de gran importancia en el desarrollo de sistemas de administración basados en liposomas. La determinación de EE se basó en el método de centrifugación a alta velocidad. Brevemente, se centrifugaron 100 μl de Cur-LP a baja velocidad (3000 rpm, 5 min) para precipitar la curcumina libre no disuelta, y 50 μl de sobrenadante se sometieron a centrifugación a alta velocidad (16 krpm, 10 min) para separar Curcumina. LP de la diminuta curcumina disuelta. Los sedimentos se resuspendieron en 500 μl de PBS (es decir, dilución de 10 veces), una alícuota de 10 μl de la cual se mezcló con 300 μl de etanol mediante vórtice y sonicación durante 30 s. Se determinó la intensidad fluorescente de la curcumina en la solución resultante (longitud de onda de excitación (Ex), 458 nm; longitud de onda de emisión (Em), 548 nm) y se presentó como F e , es decir, la intensidad fluorescente de la curcumina encapsulada. También se diluyeron 10 veces más con PBS otros 50 µl de Cur-LP reciente que contenía curcumina libre y encapsulada, y se mezclaron 10 µl de la solución diluida con 300 µl de etanol. La intensidad fluorescente de la solución resultante se midió y se presentó como F t , es decir, la intensidad fluorescente de la curcumina total. Por tanto, el EE se calculó con la siguiente ecuación:EE = F e / F t .
Microscopía electrónica de barrido (SEM)
La morfología de LP se observó mediante microscopía electrónica de barrido (SEM, INSPECT F, FEI, Países Bajos) [30]. Brevemente, la suspensión LP se diluyó 100 veces con agua destilada y se colocó una gota de la suspensión diluida en una hoja de vidrio limpia. Después de secar al aire, la muestra se revistió con oro justo antes del SEM.
Estabilidad física de los liposomas
La estabilidad física es un parámetro muy significativo para el almacenamiento y transporte de un sistema coloidal. La estabilidad física de los liposomas se presentó mediante la estabilidad coloidal y se investigó de acuerdo con un método anterior [31]. Brevemente, se agregaron 100 μl de LP a los tubos y se mantuvieron a 37 ° C. A diferentes intervalos de tiempo, se midió el tamaño de LP y se comparó con el tamaño inicial para indicar la estabilidad termodinámica. Además, también se agregaron otros 300 μl de LP a los tubos y se mantuvieron a 37 ° C. A los mismos intervalos de tiempo, se recogieron 100 µl del líquido de la capa superior. La transmitancia de las muestras recolectadas se midió a 550 nm y se comparó con el valor inicial para indicar la estabilidad cinética.
Versión in vitro
El perfil de liberación de los liposomas juega un papel importante en la predicción del destino y la eficacia in vivo de los liposomas. La liberación in vitro de curcumina de Cur-LP se estudió utilizando el método de diálisis dinámica [32]. Brevemente, se añadió 1 ml de cada Cur-LP a una bolsa de diálisis (corte de peso molecular, 10 kD), que se utilizó para retener liposomas pero mantener permeables las moléculas de curcumina liberadas. La bolsa de diálisis cargada con la muestra se empapó en 4 ml de medio de liberación (PBS 0,001 M que contenía Tween 80 al 0,1%, pH 7,4) y el estudio de liberación se llevó a cabo lejos de la luz (37ºC, 100 rpm). En cada intervalo de tiempo fijo, el medio de liberación se recogió y se reemplazó con 4 ml de medio fresco para simular las condiciones de inmersión. El medio recogido se diluyó a 5 ml con PBS y se diluyó 15 veces más con etanol. La curcumina en la solución resultante se cuantificó mediante espectrofotometría de fluorescencia (Ex 458 nm, Em 548 nm). Además, se disolvió curcumina en polvo en el medio de liberación anterior y la liberación de la solución de curcumina se llevó a cabo a pH 7,4 para investigar si la bolsa de diálisis retendría moléculas de curcumina.
Estabilidad química de la curcumina liposomal
La estabilidad química es un parámetro clave para predecir el metabolismo, la eficacia y la toxicidad de los fármacos. La estabilidad química de Cur-LP se examinó en FBS al 50%. Brevemente, 100 µl de Cur-LPs se diluyeron 10 veces con PBS (pH 7,4) y luego se mezclaron con 1 ml de FBS. Las muestras se agitaron en un agitador horizontal lejos de la luz (37 ° C, 100 rpm). A intervalos de tiempo fijos, se recogió una alícuota de 10 μl de muestra y se mezcló con 300 μl de etanol seguido inmediatamente de centrifugación (16 krpm, 5 min). La curcumina restante en el sobrenadante se cuantificó como se indicó anteriormente.
Eficacia anticáncer in vitro
La eficacia anticáncer preliminar de los tres Cur-LP se investigó utilizando células HepG2 de carcinoma hepatocelular de hígado humano. Brevemente, las células HepG2 se sembraron en placas de cultivo celular de 96 pocillos a una densidad de 10.000 células por pocillo y se cultivaron en condiciones estándar (37 ° C / 5% CO 2 ) durante 24 h en medio de cultivo PRIM-1640 suplementado con FBS al 10%. Posteriormente, se retiró el medio de cultivo y las células se lavaron con PBS. Los Cur-LP se diluyeron en medio de cultivo sin suero (4 µg / ml de curcumina) y se añadieron a las células, seguido de incubación continua durante 1 y 3 días a 37 ° C. El valor de DO de las células viables se midió mediante el ensayo cck-8. Las células tratadas con medio de cultivo en blanco sirvieron como control y la viabilidad celular (%) fue el porcentaje del valor de DO de las muestras en relación con el control.
Estadísticas
Todos los datos se presentan como media ± de (desviaciones estándar). Las diferencias entre dos grupos, analizadas por el estudiante t prueba, se consideraron estadísticamente significativas cuando la p el valor era inferior a 0,05.
Resultados y discusión
Caracterización de liposomas
El pH microambiental del liposoma se refiere a la acidez en la cámara acuosa interna del liposoma (Fig. 1), que es diferente del pH en el ambiente externo. En este trabajo, el pH ambiental externo de todas las suspensiones de liposomas fue de 7,4 a menos que se indique lo contrario.
El tamaño de partícula, el potencial zeta y la eficiencia de encapsulación (EE) son parámetros importantes para el control de calidad de los liposomas. El tamaño de tres Cur-LP era similar entre sí (alrededor de 300 nm, Fig. 2a). El PDI de cada formulación fue inferior a 0,2, lo que indica una distribución de tamaño estrecha. Curiosamente, el potencial zeta negativo de Cur-LP-7.4 (−9 mV) es significativamente menor que el de los otros dos Cur-LP (~ −18 mV). Por lo general, el potencial zeta negativo disminuiría e incluso se convertiría en un valor positivo al disminuir el pH de la fase dispersa debido al aumento de H + concentración. De hecho, observamos este fenómeno al preparar Cur-LP en soluciones sin tampón de HCl / NaOH con pH de 2,5, 5,0 y 7,4 (Fig. 2b). En el caso de PBS, sin embargo, la existencia de PO 4 3− , HPO 4 2− y / o H 2 PO 4 - y su interacción con LP puede conducir a situaciones más complicadas y resultados diferentes. Es bien sabido que el potencial zeta juega un papel clave en el mantenimiento de la estabilidad coloidal de la suspensión a nanoescala. En general, un valor absoluto más alto del potencial zeta conduce a un sistema de suspensión coloidal más estable.
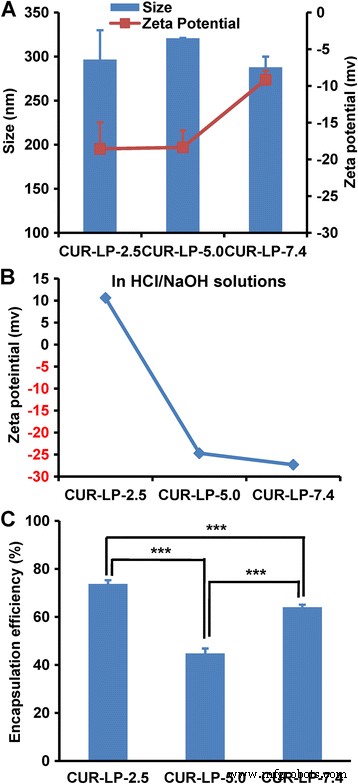
Caracterización fisicoquímica de liposomas. un Tamaño hidrodinámico y potencial zeta de Cur-LP fabricados en PBS con pH 2,5, 5,0 y 7,4, respectivamente. b Potencial zeta de Cur-LP fabricados en soluciones de HCl / NaOH con pH 2,5, 5,0 y 7,4, respectivamente. c Eficiencia de encapsulación de Cur-LP preparados en PBS. Datos presentados como media ± de ( n =3). Significación estadística entre grupos:*** p <0,001
La EE es motivo de preocupación durante el desarrollo de los liposomas. Por lo general, aumentar la EE es importante para reducir los costos y mejorar la eficacia. En este trabajo, el EE de Cur-LP-2.5 es 74% (Fig.2c), que es el más alto entre Cur-LP-5.0 (45%) y Cur-LP-7.4 (64%), lo que indica que Cur- LP-2.5 es la mejor formulación para entregar curcumina desde el punto de EE. Las razones de la variedad en EE a diferentes valores de pH no están muy claras, pero pueden estar relacionadas con la solubilidad de la curcumina, que es soluble en álcalis o en disolventes extremadamente ácidos [33].
La morfología de los liposomas examinados por SEM se muestra en la Fig. 3. Las partículas de LP-2.5 (Fig. 3a) y LP-5.0 (Fig. 3b) son de forma esférica y tienen una distribución de partículas uniforme. El LP-7.4 también muestra una forma de esfera, pero se puede observar claramente la adhesión entre las partículas (Fig. 3c), lo que indica que el proceso de secado durante la preparación de la muestra SEM conduciría a la agregación de LP-7.4. Esto puede deberse al valor absoluto relativamente bajo del potencial zeta de LP-7.4 (Fig. 2a). Además, el tamaño de partícula medido por SEM es más pequeño que el tamaño hidrodinámico medido por DLS, que se debe a la pérdida de la capa de hidratación del liposoma después del proceso de secado para SEM.
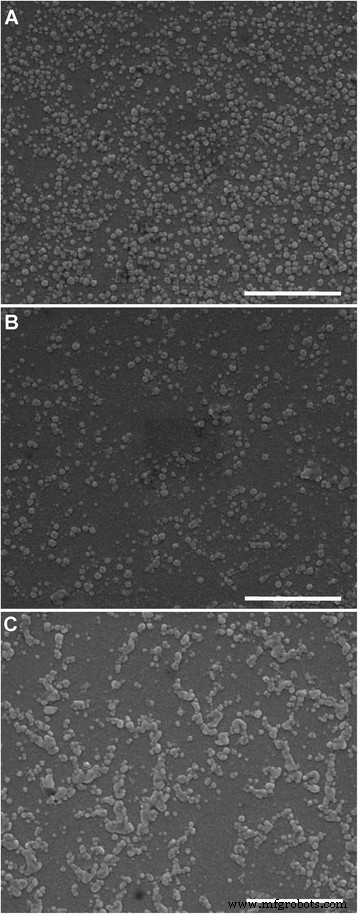
Imágenes SEM de liposomas con pH microambiental a 2.5, b 5.0 y c 7.4. Barra de escala , 1 μm
Estabilidad física del liposoma
El liposoma es un sistema coloidal y su estabilidad física puede presentarse mediante la estabilidad coloidal, que tiene un impacto sustancial en el almacenamiento de liposomas y otras aplicaciones [34, 35]. La agregación de partículas (inestabilidad termodinámica) y la sedimentación (inestabilidad cinética) son los dos aspectos esenciales de la inestabilidad coloidal. La agregación conduce a un tamaño aparente más grande y la sedimentación conduce a cambios en la transmitancia de la suspensión. Más importante aún, el aumento de tamaño puede afectar directamente la eficacia de los nano-sistemas, ya que se ha demostrado que el tamaño de las partículas tiene un gran impacto en la captación celular, la citotoxicidad, el perfil farmacocinético y la distribución tisular [36, 37].
Aquí, examinamos las propiedades de agregación y sedimentación de tres sistemas de liposomas para indicar su estabilidad termodinámica y cinética, respectivamente. Como se muestra en la Fig. 4a, los tres LP no mostraron cambios sustanciales en el tamaño hidrodinámico dentro de las 72 h, lo que indica que todos estos LP tienen una estabilidad termodinámica muy alta. Mientras tanto, el cambio de transmitancia de los tres LP fue inferior al 10% (Fig. 4b), lo que indica poca sedimentación de partículas y, por lo tanto, una alta estabilidad cinética. Estos resultados sugieren que los tres LP tienen una excelente estabilidad coloidal en 72 h, y que el pH microambiental no influye en la estabilidad física del liposoma.
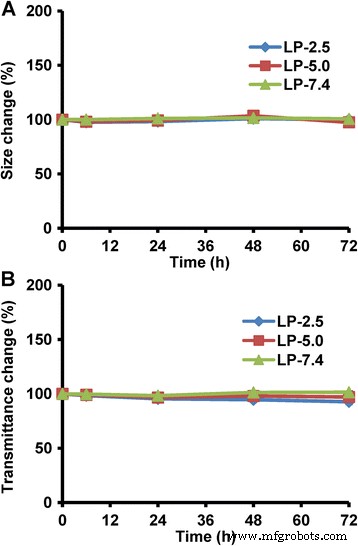
Estabilidad física de liposomas con valores de pH microambientales variados (pH 2,5, 5,0 y 7,4). un Estabilidad termodinámica indicando agregación de partículas. b Estabilidad cinética que indica la sedimentación de partículas. Los datos se presentan como media ± sd ( n =3)
Versión in vitro
El perfil de liberación de fármacos de los liposomas se examina habitualmente para evaluar la calidad de la formulación, proporcionar una referencia para el régimen de dosificación y predecir la eficacia in vivo. En general, casi todos los sistemas liposomales tienen una propiedad de liberación sostenida del fármaco. Aquí, examinamos el comportamiento de liberación in vitro de tres Cur-LP en PBS (pH 7,4). Mientras tanto, también se examinó la liberación de la solución de curcumina para confirmar si la membrana de diálisis afectaría la difusión de la curcumina. Como se muestra en la Fig. 5a, la curcumina se liberó muy rápidamente de su solución (> 80% a las 6 h), lo que indica que la bolsa de diálisis no tuvo ningún efecto sobre la difusión de la curcumina. En contraste con la rápida liberación de la solución de curcumina, todos los Cur-LP mostraron una propiedad obvia de liberación sostenida (Fig. 5b), y los perfiles de liberación eran muy similares entre sí, lo que indica que el pH microambiental no tuvo un efecto significativo sobre la curcumina. velocidad de liberación. En detalle, la curcumina se liberó un poco más rápido en las primeras 8 h debido probablemente a la liberación de ráfaga inicial (el porcentaje de liberación acumulada fue de alrededor del 5%). Después de 8 h, la curcumina se liberó un poco más lentamente y el porcentaje de liberación acumulada fue ~ 30% en 72 h. Se supone que la velocidad de liberación in vivo o en presencia de suero sería sustancialmente más rápida debido en parte al metabolismo de los lípidos.
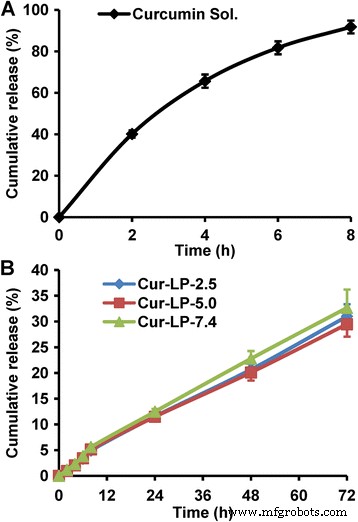
Perfiles de liberación in vitro de diferentes formulaciones de curcumina en PBS (pH 7,4). un Solución de curcumina, en la que se disolvió curcumina en PBS que contenía Tween 80 al 0,1% (pH 7,4). b Cur-LP con pH microambiental variado de 2,5, 5,0 y 7,4, respectivamente. Los datos se presentan como media ± sd ( n =3)
Curiosamente, los perfiles de lanzamiento de los tres Cur-LP están cerca de las líneas rectas. Por lo tanto, se realizó el ajuste lineal a los tres perfiles de liberación. Como se muestra en la Tabla 1, todos estos perfiles mostraron una linealidad muy buena con un grado de ajuste superior a 0,99 (también se muestran las ecuaciones de regresión), lo que sugiere que la liberación de Cur-LP se ajustó a la cinética de orden cero. En otros estudios similares, se encontró que la liberación de curcumina de los liposomas no era lineal [38, 39]. Desde el punto de vista de la investigación y el desarrollo de fármacos, la cinética de liberación de orden cero es el perfil de liberación más ideal porque proporciona una velocidad de liberación constante del fármaco y, por lo tanto, es capaz de mantener el efecto terapéutico durante mucho tiempo, disminuir los tiempos de administración y reducir los efectos secundarios. . Por lo tanto, los LP preparados en este trabajo pueden ser portadores prometedores para la administración controlada de medicamentos.
Efecto del pH microambiental sobre la estabilidad química de Cur-LP
La estabilidad química de la curcumina liposomal en FBS se muestra en la Fig. 6. Después de la incubación durante 2 h, quedó 89% de curcumina para Cur-LP-2.5, significativamente más alto que 74% para Cur-LP-5.0 y 61% para Cur-LP -7,4 ( p <0,001). A las 4 h posteriores a la incubación, quedaba un 69% de curcumina para Cur-LP-2.5, significativamente más alto que 53% para Cur-LP-5.0 y 40% para Cur-LP-7.4 ( p <0,01). A las 6 h posteriores a la incubación, quedaba 55% de curcumina para Cur-LP-2.5, aún significativamente más alto que 43% para Cur-LP-5.0 y 34% para Cur-LP-7.4 ( p <0,05). Está claro que la estabilidad química de los Cur-LP depende del pH microambiental:Cur-LP-2.5> Cur-LP-5.0> Cur-LP-7.4. Esta estabilidad química dependiente del pH de Cur-LP es consistente con otro trabajo, que mostró la estabilidad dependiente del pH de la curcumina libre [26]. La liberación in vitro se realizó en medio libre de suero y la liberación acumulativa pudo ser del 30% a las 72 h. Sin embargo, el estudio de estabilidad química se realizó en una solución que contenía suero, en la que las enzimas del suero podrían degradar la curcumina liberada y también romper el liposoma y así degradar la curcumina no liberada. Esta es la razón por la que se liberó un 30% de curcumina a las 72 h en el estudio de liberación in vitro, pero solo el 55% permaneció a las 6 h para Cur-LP-2.5 en el estudio de estabilidad sérica.
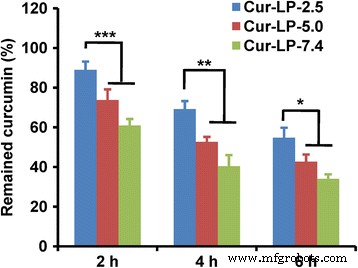
Estabilidad química de la curcumina liposomal (Cur-LP) con valores de pH microambientales variados (pH 2,5, 5,0 y 7,4). La estabilidad se examinó cuantificando la curcumina restante después de incubar Cur-LP con FBS al 50%. Los datos se presentan como media ± sd ( n =3). Significación estadística entre grupos:*** p <0,001, ** p <0.01, * p <0.05
Los liposomas constan de dos partes en estructura:una es la bicapa lipídica hidrofóbica y la otra es la cámara acuosa interior hidrofílica. Es fácil de entender que un fármaco hidrófilo sensible al pH se ubicaría en la cámara acuosa interna, y su estabilidad se vería significativamente afectada por el pH microambiental en la cámara acuosa, donde el volumen de amortiguación y la capacidad de amortiguación serían mucho mayores. que en la bicapa lipídica. Por el contrario, la curcumina es una molécula hidrófoba y estaría ubicada en la bicapa lipídica. Por esta razón, es bastante interesante encontrar la estabilidad química microambiental dependiente del pH de la curcumina liposomal. Se supone que el espacio en la bicapa lipídica no sería absolutamente anhidro aunque es hidrófobo. Como sabemos, la membrana de las células vivas no es absolutamente anhidra en su bicapa lipídica. En cambio, contiene un cierto volumen pequeño de solución acuosa para el transporte de iones y moléculas solubles en agua. Asimismo, también existiría un cierto volumen pequeño de solución tampón con los mismos componentes que la cámara interior en la bicapa lipídica hidrófoba después de la preparación satisfactoria del liposoma. Por tanto, el fármaco hidrófobo ubicado en la bicapa lipídica puede verse directamente afectado por el pH microambiental del liposoma. Además, el microambiente ácido puede reducir las actividades de algunas enzimas que muestran la mejor actividad en condiciones fisiológicas normales. Esto también contribuye a la mayor estabilidad química de la curcumina liposomal en el pH microambiental más bajo. Se ha informado que los liposomas compuestos de fosfatidilcolina de huevo (EPC) perdieron rápidamente su gradiente de pH interno en tampón (pH 7,4), y la capacidad de mantener el gradiente de pH se mejoró sustancialmente sustituyendo EPC (temperatura de transición de fase ( T m ) ≈ −5 ° C) con la T alta m (41 ° C) lípido DPPC (dipalmitoil fosfatidilcolina) y por adición de colesterol [40]. En el presente trabajo, el liposoma está compuesto por lecitina de soja ( T m es de alrededor de 238,2 ° C [41]) y colesterol. Por lo tanto, se puede esperar que el gradiente de pH microambiental de los liposomas preparados en este trabajo se mantenga durante un período prolongado. Este es un fuerte apoyo a los resultados y suposiciones que se muestran arriba.
Eficacia anticáncer in vitro
Hemos demostrado la estabilidad química microambiental dependiente del pH de la curcumina liposomal anterior. Aquí, llevamos a cabo un estudio preliminar in vitro para investigar la eficacia contra el cáncer de estas curcumina liposomal. Curiosamente, los LP en blanco podrían mejorar el crecimiento celular el día 1 y mantener esta función hasta cierto punto hasta el día 3 en comparación con el grupo de control (Fig. 7). Esto indica que los LP en blanco pueden proporcionar nutrición a las células, lo cual es consistente con nuestro informe anterior [27]. La curcumina libre mostró poca eficacia contra el cáncer debido a su solubilidad bastante limitada. Por el contrario, los Cur-LP demostraron una eficacia anticancerígena significativa de una manera microambiental dependiente del pH. Después del tratamiento durante 1 día, Cur-LP-2.5 y Cur-LP-5.0 mostraron una capacidad significativamente mayor para inhibir el crecimiento de células HepG2 que Cur-LP-7.4 (la viabilidad celular fue del 80% para Cur-LP-2.5 y Cur-LP -5.0 y 90% para Cur-LP-7.4). En el día 3 posterior al tratamiento, la viabilidad celular disminuyó sustancialmente y Cur-LP-2.5 y Cur-LP-5.0 mostraron una eficacia anticancerosa comparable y significativamente más alta que Cur-LP-7.4. La viabilidad celular fue del 24% para Cur-LP-2.5 ( p <0.05 frente a Cur-LP-7.4), 21% para Cur-LP-5.0 ( p <0.01 vs Cur-LP-7.4) y 39% para Cur-LP-7.4. Estos resultados indican que la eficacia anticancerosa de la curcumina liposomal depende del tiempo y del pH microambiental. Teniendo en cuenta la mayor EE y la estabilidad química de Cur-LP-2.5 que Cur-LP-5.0, los liposomas con un pH microambiental de 2.5 tendrían el mayor potencial de aplicación práctica.
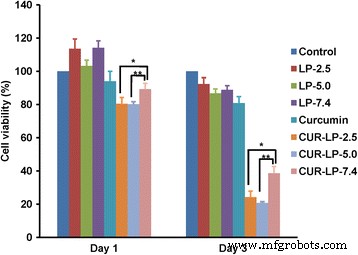
Eficacia contra el cáncer de la curcumina liposomal con pH microambiental variado (2,5, 5,0 y 7,4). La viabilidad de las células HepG2 en los días 1 y 3 después del tratamiento con LP en blanco, curcumina libre y Cur-LP se examinó mediante el ensayo cck-8. Las células tratadas con medio de cultivo en blanco que contenía suero sirvieron como control. Los datos se presentan como media ± sd ( n =3). Significación estadística entre grupos:** p <0.01, * p <0.05
Conclusiones
El liposoma, como sistema de administración de fármacos ampliamente utilizado, es capaz de mejorar la solubilidad de los fármacos insolubles en agua, protegiendo las cargas útiles del fármaco del entorno fisiológico hostil y entregando las cargas útiles a un tejido objetivo. Sin embargo, la administración de fármacos sensibles al pH todavía está limitada por su inestabilidad natural en condiciones fisiológicas (ambiente neutro). En este trabajo, proponemos un enfoque novedoso para mejorar la estabilidad química de cargas útiles de fármacos sensibles al pH mediante la regulación de la acidez microambiental de los liposomas. Los hallazgos muestran que la estabilidad química y la eficacia in vitro del modelo de curcumina, un fármaco sensible al pH, se mejora significativamente al acidificar el microambiente de los liposomas. En conclusión, la regulación del pH microambiental de los liposomas es factible para mejorar la estabilidad química de las cargas útiles de fármacos sensibles al pH, incluso para los fármacos hidrófobos que se encuentran en la bicapa lipídica.
Nanomateriales
- Fresado químico de aleación de titanio
- Propiedades físicas y químicas del tungsteno
- Propiedades químicas del titanio
- ¿Qué es la deposición de vapor químico?
- Efectos del circuito
- Parche de nicotina
- Nanofibras y filamentos para una mejor administración de fármacos
- Reutilización de fármacos
- Los 4 mejores plásticos resistentes a productos químicos
- Efectos del forjado en acero al carbono
- El torno horizontal promueve la estabilidad



