Nuevos conocimientos sobre la adsorción de CO2 en nanomateriales basados en hidróxido doble en capas (LDH)
Resumen
El espaciamiento interlaminar de los hidróxidos dobles en capas (LDH) se amplió primero con iones dodecilsulfonato, y luego, se injertó químicamente (3-aminopropil) trietoxisilano (APS) (APS / LDH). Las características estructurales y la estabilidad térmica de estas muestras preparadas se caracterizaron por difracción de rayos X (XRD), microscopía electrónica de transmisión (TEM), espectrómetro infrarrojo de transformada de Fourier de reflectancia (FTIR), análisis termogravimétrico (TG) y análisis elemental (EA), respectivamente. . El CO 2 El rendimiento de la adsorción se investigó adoptando TG y espectroscopia de transformada de Fourier infrarroja de reflectancia difusa (DRIFTS). Los resultados presentaron que el CO 2 La capacidad de adsorción en APS / LDH fue tan alta como 90 mg / gy no mostró una reducción obvia durante una prueba de adsorción-desorción de cinco ciclos, lo que indica su estabilidad de rendimiento superior. Los resultados de DRIFTS mostraron que tanto los carbamatos como el CO 2 débilmente acotado Las especies se generaron en APS / LDH. La especie adsorbida débilmente se debió al ambiente químico local diferente para el CO 2 captura proporcionada por los restos superficiales de las LDH, como el silanol libre y los enlaces de hidrógeno.
Antecedentes
El efecto invernadero y el cambio climático global causado principalmente por el CO 2 sustantivo las emisiones de las centrales eléctricas de carbón han despertado la preocupación del público en general [1, 2, 3]. Por lo tanto, CO 2 La captura debe adoptarse para su posterior almacenamiento o utilización para reducir su nivel de concentración en la atmósfera. Varios sorbentes a base de solventes y sólidos han ganado gran atención para el CO 2 captura, especialmente los materiales compuestos porosos modificados con amina por su consumo de energía comparativamente bajo para la regeneración y fácil implementación en un amplio rango de temperaturas y presiones [4, 5, 6].
Un CO 2 alto y estable La capacidad de adsorción es principal para el proceso de separación a gran escala de la captura de carbono del gas de combustión con un gran volumen y baja presión parcial en el rango de temperatura de 50 ~ 100 ° C [1]. Como los grupos amino muestran afinidad por el CO 2 moléculas, varios soportes porosos con gran superficie y volúmenes de poros se adoptaron para obtener adsorbentes compuestos basados en su acomodación a las aminas impregnadas desde el trabajo de Song en 2002 [7]. Y el CO 2 más alto La capacidad de adsorción reportada en la literatura podría alcanzar hasta 7,9 mmol / g [8]. Sin embargo, estos tipos de composites impregnados son susceptibles de degradación del rendimiento durante la operación de adsorción-desorción cíclica, lo que sugiere una escasa estabilidad que también es un criterio importante para aplicaciones reales [9]. Además, las aminas aglomeradas y las partículas recubiertas de CO 2 también generan una fuerte limitación de la difusión. desde la superficie a los voluminosos grupos amino, lo que reduciría la eficiencia de la amina definida como las cantidades de CO 2 adsorbido moléculas por cada mol de átomo de nitrógeno.
Para mejorar la estabilidad térmica y la eficiencia amina de los adsorbentes compuestos, una monocapa o menos de CO 2 sitios de afinidad se formula mediante el injerto de aminosilanos en los materiales de soporte en función de su reacción de co-condensación, que ha sido ampliamente estudiada adoptando 3-aminopropiltrimetoxisilano (APS), 3- (trimetoxisilil) propiletilendiamina (diamina) o 3- [2- (2 -aminoetilamino) etilamino] propiltrimetoxisilano (triamina), etc. [2, 10,11,12]. Estos tipos de compuestos injertados muestran limitaciones de difusión más bajas y estabilidad superior, aunque puede haber un límite superior de CO 2 capacidad de adsorción ya que se supone que se exigieron dos moles de grupos amina expuestos para capturar un mol de CO 2 moléculas de acuerdo con el mecanismo de iones híbridos [13, 14]. Sin embargo, la naturaleza química de los materiales de soporte también podría afectar el CO 2 Rendimiento de adsorción. Las contribuciones de los hidroxilos superficiales al CO 2 Se ha investigado la captura ya sea a través de su fuerza física débil directa [15] o mediante su enlace de hidrógeno con las aminas injertadas [13, 16] en adsorbentes basados en sílice / titania.
Los hidróxidos dobles en capas (LDH) son compuestos ordenados que se ensamblan mediante aniones de interlaminación y laminados de capas con carga positiva con la fórmula general de [M 1 - x 2+ M x 3+ (OH) 2 ] x + (A n - ) x / n · MH 2 O, donde M 2+ y M 3+ representan cationes metálicos y A es un anión [17]. Las LDH tienen aplicaciones extendidas en adsorción, catálisis, fotoquímica, etc. debido a su estructura sintonizable y bajo costo de materias primas [6, 18, 19, 20], que también lo convierten en un posible candidato para el CO 2 de poscombustión. capturar. Wang y col. [21] sintetizaron LDH modificadas con amina a través de una ruta de exfoliación e injerto e informaron que estos adsorbentes serían útiles en CO 2 procesos de captura con una temperatura alta de 80 ° C, mientras que el CO 2 La capacidad de adsorción en sílice mesoporosa hexagonal modificada con amina (HMS) disminuyó de 1,34 mmol / ga 25 ° C a 0,45 mmol / ga 75 ° C [22]. Esto sugiere que la sustancia química local de las LDH, ya que los materiales de apoyo, podrían afectar el CO 2 adsorción de una manera diferente a los soportes de sílice. Sin embargo, hasta donde se nos reconoce, pocos informes han discutido sobre esto. Es necesario un estudio sistemático para investigar los sorbentes basados en LDH y comprender mejor su CO 2 Mecanismos de adsorción.
Teniendo esto en cuenta, en este documento se han preparado LDH modificadas con (3-aminopropil) trietoxisilano (APS) (APS / LDH) adoptando dodecil sulfato (DS) para la intercalación previa. Las características estructurales de los APS / LDH se han abordado en detalle en otro lugar [21]. Sin embargo, se reintroducirán algunas cantidades para ilustrar el vínculo entre CO 2 rendimiento de adsorción y características superficiales de las LDH. El CO 2 Las propiedades de adsorción-desorción en APS / LDH se exploraron principalmente utilizando mediciones de espectroscopía de transformada de Fourier infrarroja de reflectancia difusa in situ (DRIFTS).
Métodos
Todos los productos químicos utilizados se compraron a Aladdin reagent Co., Ltd., y fueron A.R. calificación. Y estos productos químicos se utilizaron sin tratamiento adicional.
Las LDH sintetizadas se prepararon como muestra de control mediante un método de coprecipitación. Una solución mixta que contiene 0,075 mol de Mg (NO 3 ) 2 · 6H 2 O y 0,025 mol de Al (NO 3 ) 3 · 9H 2 Primero se obtuvo O, que luego se añadió a un Na 2 CO 3 solución acuosa (0,5 mol / L, 100 ml) con agitación vigorosa a 70ºC. El valor de pH de esta mezcla se mantuvo en aproximadamente 10 usando una solución acuosa de NaOH (4 M) seguido de agitación durante otras 4 h. Después de eso, el precipitado resultante se filtró, se lavó con agua destilada varias veces y se secó al vacío a 120ºC durante la noche. Las LDH intercaladas por DS (DS / LDH) se sintetizaron 7 de acuerdo con un informe anterior [21]. Normalmente, 4,00 g de Mg (NO 3 ) 2 · 6H 2 O y 1,95 g de Al (NO 3 ) 3 · 9H 2 Se disolvieron O en 50 ml de agua desionizada. La solución obtenida se añadió gota a gota a la solución acuosa de dodecilsulfato de sodio (3 g / 100 ml de agua destilada) con agitación continua a 70ºC. También se debe prestar especial atención al ajuste del pH a alrededor de 10. El mismo postratamiento descrito anteriormente también se aplicó a los DS / LDH.
Las LDH injertadas con APS (APS / LDH) se prepararon como sigue. Se disolvieron dos gramos de DS / LDH en un matraz cónico con 500 ml de disolvente tolueno y luego se sometieron a sonicación durante 5 h. Se recogió abundante gel blanco media hora más tarde. Se añadieron quince mililitros de (3-aminopropil) trietoxisilano y la solución de la mezcla se envejeció a 60ºC en una atmósfera de nitrógeno durante 5 h. El sedimento se extrajo por filtración, se lavó repetidamente y luego se secó en un horno de vacío a 120 ° C durante la noche.
Las fases cristalinas de las muestras se analizaron mediante un difractómetro de rayos X con radiación CuKα (XRD:modelo D / max RA; Rigaku Co., Japón, radiación CuKα 0.15418 nm), y se recolectaron datos para ángulos de dispersión (2 θ ) que osciló entre 5 ° y 70 ° con un tamaño de paso de 0,02 °. La micromorfología se investigó mediante microscopía electrónica de transmisión (TEM:Tecnai G2 F20; FEI Company, EE. UU.). El análisis elemental se realizó en Flash EA1112 (Thermo Finnigan, EE. UU.). Se empleó un espectrómetro de infrarrojos por transformada de Fourier (FTIR, IR Affinity-1; SHIMADZU, Japón) para registrar los espectros de IR de las muestras preparadas. Se prepararon placas de bromuro de potasio (KBr) mezcladas con 1/50 de muestra aplicando 20 toneladas de presión de aceite y luego se escanearon de 400 a 4000 cm −1 con una resolución de 0,2 cm −1 . La estabilidad térmica de las muestras sólidas se determinó mediante análisis termogravimétrico (TG; NETZSCH STA 409 Luxx, Selb / Bavaria, Alemania). Las muestras se calentaron desde temperatura ambiente a 600 ° C con una velocidad de calentamiento de 10 K / min en atmósfera de nitrógeno.
La información sobre las especies superficiales y el comportamiento molecular en la superficie de los adsorbentes se obtuvo a través de DRIFTS (espectrómetro Nicolet 6700 FT-IR, Thermo Scientific, EE. UU.), Que estaba equipado con un sistema de control de temperatura y acoplado con ventanas ZnSe. En la celda DRIFTS, se pretrataron adsorbentes en polvo durante 1 ha 200 ° C bajo un flujo de nitrógeno de 30 ml / min. Cuando la temperatura se estabilizó a 50 ° C, un CO 2 Se introdujo un flujo de gas de 5 ml / min en la celda durante un período de tiempo hasta que se logró la saturación completa. Aquí, el CO 2 La concentración (~ 14% en volumen) en la mezcla de gases indicó su concentración general del gas de combustión industrial. Los espectros DRIFTS se recogieron con 4 cm −1 resolución y 64 sans co-agregados con la consideración de los espectros de fondo registrados justo antes de la introducción de moléculas de sonda.
CO 2 TG también determinó la capacidad de adsorción. Se pretrataron aproximadamente 10 mg de muestras a 120 ° C durante 1 h en atmósfera de nitrógeno a 100 ml / min. Después de enfriar a la temperatura de adsorción, CO 2 puro el flujo se cambió hasta el equilibrio dinámico de adsorción. El peso ganado final se consideró como su CO 2 capacidad de adsorción. Las muestras saturadas se regeneraron en las condiciones de pretratamiento. Este procedimiento de adsorción-regeneración se repitió cinco veces para evaluar la estabilidad del rendimiento de los materiales adsorbentes modificados.
Resultados y discusión
Como se muestra en la Fig.1, surgió una serie de picos típicos debido a las estructuras en capas para las LDH sintetizadas en 2 θ =11,5 °, 23,0 °, 34,5 ° y 60,5 °, que se atribuyeron a (003), (006), (009) y (110) planos de celosía, respectivamente, de acuerdo con las literaturas anteriores [23, 24]. Cabe señalar que una reflexión de Bragg de ángulo inferior (003), además del orden de pozo (00 l ), apareció para DS / LDH generadas por la estructura expandida como la intercalación de aniones orgánicos en las placas laminadas de LDH. Esta capa intermedia expandida, que sugiere una alta exposición de grupos hidroxilo de la superficie y una baja limitación de difusión, permitió que las DS / LDH fueran un precursor de la posterior introducción de APS. El injerto de APS redujo drásticamente la cristalinidad. Sin embargo, la estructura similar a hidrotalcita del huésped se conservó para la reflexión observada (110). Esto fue confirmado por la imagen TEM de APS / LDH (Fig. 2) cuando se demostraron los agregados de partículas escamosas irregulares.
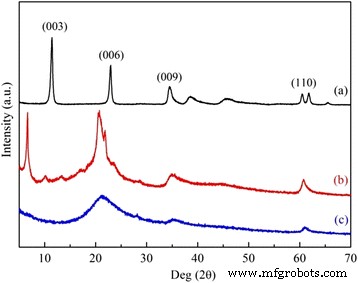
Perfiles de difracción de rayos X de ( a ) LDH, ( b ) DS / LDH, y (c) APS / LDH

Imagen TEM de APS / LDH
La relación molar de C / N es 9 en la molécula de APS (C 9 H 23 NO 3 Si). En consecuencia, las relaciones molares de C / N serían 7, 5 o 3 si 1, 2 o 3 grupos etoxisilano se condensan con los grupos hidroxilo de la superficie en los laminados de LDH, respectivamente [21]. Aquí, se adoptó la relación molar de C / N (Tabla 1) para confirmar aún más el éxito del injerto de APS. Como se obtuvo la relación molar C / N de 6,59, por lo tanto, al menos un grupo etoxisilano en cada molécula de APS se ató a las capas metálicas, mientras que los otros se presentaron como grupos etoxisilano intactos o enlaces silanol libres después de la hidrólisis.
Se llevó a cabo un estudio de TG-DTG (DTG es la curva derivada de TG) para investigar la estabilidad térmica de las LDH modificadas. Como se presenta en la Fig. 3, las DS / LDH experimentaron tres etapas de pérdida de masa, que se atribuyeron a la eliminación del agua adsorbida por debajo de 150 ° C; la deshidroxilación durante el rango de temperatura de 150 a 300 ° C con una pérdida prominente ocurrió a 240 ° C, así como la deshidroxilación y descomposición adicional del dodecil sulfato por encima de 300 ° C [24, 25]. El comportamiento de descomposición térmica de APS / LDH fue significativamente diferente (Fig. 4). Se observó que la pérdida de peso de APS / LDH debido a la deshidroxilación (150 ~ 300 ° C) fue de aproximadamente el 10%, mucho menor que la de DS / LDH (aproximadamente 30%). Esto podría atribuirse principalmente al consumo de -OH en los laminados de LDH después del injerto de APS a través de la reacción de condensación como se interpreta en la Fig. 5. Además, una pérdida de peso alcanzó su punto máximo incluso a una temperatura más alta a 321 ° C debido a la deshidroxilación retardada. en APS / LDH que podrían beneficiarse del enlace de hidrógeno entre el terminal –NH 2 de moléculas de APS y los hidroxilos de superficie en laminados LDH.
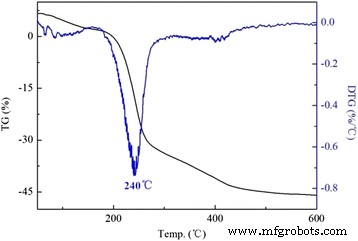
Curvas TG-DTG de DS / LDH
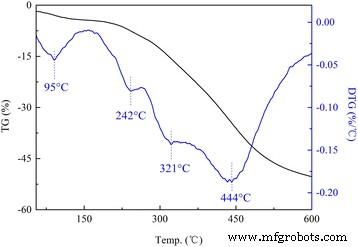
Curvas TG-DTG de APS / LDH
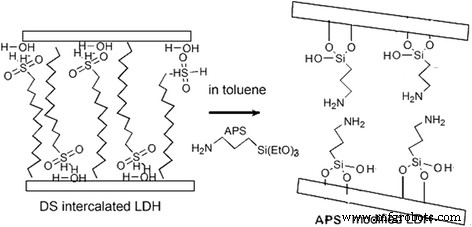
Ilustración esquemática para la formación de APS / LDH
Los espectros de IR de LDH modificados se muestran en la Fig. 6. Para LDH, el pico ancho fuerte centrado en 3460 y la banda en 1650 cm −1 estaba relacionado con las vibraciones de estiramiento y flexión de los grupos hidroxilo de la superficie y / o la capa intermedia, respectivamente. Las bandas de absorción a 1370 cm −1 se asignaron tanto al carbonato monodentado como al NO 3 intercalado - en el espacio entre capas de LDH. Un matiz de vibraciones reticulares de Mg – O, así como los modos Al – O, se superponen al espectro que va de 800 a 400 cm −1 . Las moléculas de DS en DS / LDH mostraron un grupo de bandas características en 2920 (vibración de estiramiento de –CH 3 grupos), 2852 (vibración de estiramiento de –CH 2 grupos), 1465 (enlace de flexión C – H del esqueleto orgánico) y 1217/1075 cm −1 (las vibraciones de estiramiento asimétricas y simétricas de –SO 3 2− grupos). Sin embargo, las intensidades de estas bandas características se debilitaron sustancialmente después del injerto de APS, mientras que se observaron nuevas bandas relacionadas con los enlaces N-H y N-C en las moléculas de APS, por ejemplo, la vibración de N-H 2 en los grupos de amina primaria (RNH 2 ) a 1570/1468 cm −1 y la vibración de flexión C – N de C – N a 1124 cm −1 [13, 23].
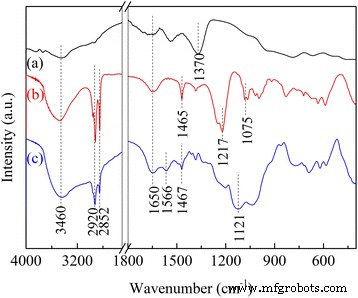
Espectros FTIR de ( a ) LDH, ( b ) DS / LDH y ( c ) APS / LDH
Aunque parte de los grupos -OH de la superficie en los laminados de LDH se consumieron a través de su reacción de condensación con los silanoles de APS como se mencionó anteriormente, las bandas ubicadas en 3460 y 1650 cm −1 fueron algo mejorados. Se informó que se produciría una distribución no uniforme de APS injertado, como la agrupación de grupos amino a través de su enlace de hidrógeno intermolecular [16] y la protonación de especies de amina (RNH 3 + ) generados bajo la existencia de agua [26], con hidroxilos superficiales o con grupos silanol libres. También se sostuvo que las moléculas o grupos básicos podrían unirse por enlaces de hidrógeno a los hidroxilos superficiales de las LDH, aunque este enlace era bastante débil [27]. Por lo tanto, aquí, la mejora de estas bandas de absorción se atribuyó al –NH 2 acotado grupos superpuestos con el grupo –OH en la misma región de IR [28], lo que indica un entorno local bastante diferente para el CO 2 adsorción.
CO 2 El rendimiento de adsorción de LDH modificadas con amina fue investigado por TGA a diferentes temperaturas de prueba. Como se muestra en la Fig.7, CO 2 Las cantidades de adsorción en APS / LDH aumentaron drásticamente en los primeros 30 minutos, seguidas de una etapa de saturación lenta. A CO 2 Se obtuvo una capacidad de adsorción tan alta como 2.09 mmol / g durante esta etapa de saturación, mucho más alta que la de las LDH (típicamente menos de 1.0 mmol / g [29, 30, 31]). Por lo tanto, los grupos amino incorporados contribuyeron a CO 2 capturando significativamente. Cabe señalar que los APS / LDH exhibieron un CO 2 cantidad de adsorción de 1,55 mg / ga 25 ° C mientras que mostró una capacidad de adsorción bastante estable en un rango de temperatura de 30 a 75 ° C. APS comienza a reaccionar con CO 2 desde 28ºC [21]. Por lo tanto, la mayor viscosidad del APS a 25 ° C generaría una mayor limitación de transferencia de masa y debilitaría aún más su función para el CO 2 capturando.
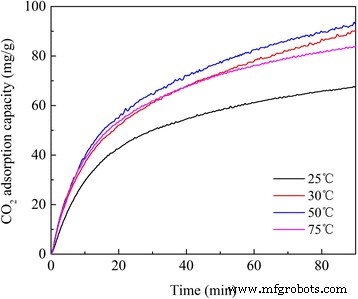
CO 2 Perfiles de adsorción en APS / LDH a diferentes temperaturas
Fue la accesibilidad de los grupos amino y la proximidad de los pares de amino adyacentes lo que esencialmente determinó el CO 2 capacidad de adsorción de materiales modificados con aminas. Las aminas impregnadas quisieran aglomerarse en los poros de los soportes, lo que generó una fuerte limitación de la difusión del CO 2 moléculas de la superficie a la masa [2, 9, 25, 32]. Sin embargo, la accesibilidad de los sitios activos en APS / LDH también podría verse afectada negativamente por las cadenas de hidrocarburos intercaladas entre los laminados de LDH, lo que redujo la movilidad y la proximidad relativa de los pares de amino. Esto fue desfavorable para la eficiencia de amina de APS / LDH presumiblemente, que resultó ser ligeramente superior a 0,5 que era el valor máximo basado en el mecanismo de iones híbridos (Tabla 1). Por lo tanto, se dedujo que puede haber un mecanismo de adsorción diferente que contribuya a la eficiencia de la amina.
Se adoptó la medición DRIFTS para investigar el CO 2 mecanismo de adsorción en APS / LDH (Fig. 8). Exposición al CO 2 / N 2 mezcla de gases provocó la aparición de varios picos de absorción típicos, que se debieron a la deformación N – H en RNH 3 + a 1629 y 1489 cm −1 , el modo de estiramiento asimétrico de COO - a 1567 cm −1 , y la vibración esquelética NCOO a 1428 y 1326 cm −1 [13]. Obviamente, CO 2 la adsorción en las aminas primarias se produjo a través del mecanismo de iones híbridos con una secuencia de dos pasos, es decir, la formación de un ión bipolar en primer lugar y la posterior transferencia de protones [13, 14].
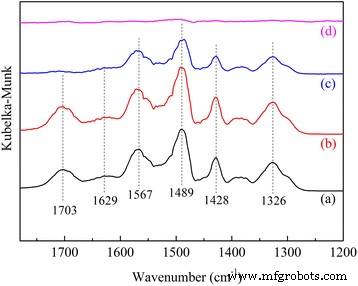
Espectros de DRIFTS de CO 2 adsorción y desorción en APS / LDH:( a ) adsorción durante 5 min, ( b ) adsorción durante 20 min, ( c ) purgar durante 30 min a temperatura ambiente, ( d ) purgar durante otros 30 min a 120 ° C
Especialmente, la banda emergida a 1703 cm −1 necesitaba una mayor identificación. Como desapareció por completo en condiciones de regeneración suave, mientras que los carbamatos generados se descompusieron a una temperatura más alta, esta banda podría estar relacionada con un CO 2 débilmente unido especies alrededor del límite −NH 2 grupo [33] que proporcionó un entorno local diferente para la adsorción. CO 2 las moléculas podrían capturarse en estos grupos amino mediante enlaces de hidrógeno. Wu y col. [13] atribuyó la banda de absorción a 1706 cm −1 al CO 2 enlazado con hidrógeno especies generadas por su adsorción cerca de los grupos amina protonados. Danon y col. [16] también encontró que la superficie SBA-15 juega un papel importante en las interacciones específicas entre CO 2 y restos atados a la superficie de SBA-15.
Se desea especialmente un rendimiento de adsorción / desorción cíclica estable de los adsorbentes para el proceso de separación práctico. El rendimiento cíclico de APS / LDH se obtuvo (Fig. 9) a través de su exposición a CO 2 a diferentes temperaturas de adsorción y luego regeneración a 120 ° C repetidamente. El CO 2 La capacidad de adsorción fluctuó alrededor de su cantidad de adsorción inicial durante estos cinco ciclos a estas temperaturas de prueba, mostrando un excelente desempeño cíclico. Esto proporcionó a APS / LDH una gran viabilidad para capturar CO 2 de centrales térmicas a base de combustibles fósiles [1]. En primer lugar, se podría lograr un ahorro de energía para la regeneración en comparación con las muestras de LDH calcinadas que necesitaban activación a temperaturas elevadas, por ejemplo, 400 ° C [34]. Además, el CO 2 La adsorción en muestras de LDH calcinadas disminuyó con el número creciente de ciclos de adsorción / desorción térmica debido a la quimisorción irreversible causada por la mala estabilidad térmica y la aglomeración de partículas [35], mientras que las APS / LDH aquí mostraron una estabilidad de rendimiento superior.
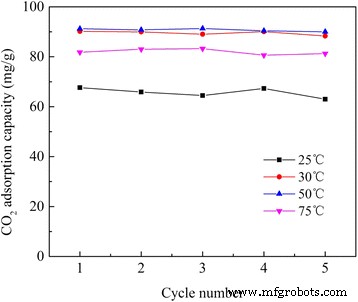
Estabilidad del rendimiento de APS / LDH durante los ciclos consecutivos de adsorción-desorción
Conclusiones
Se injertó una monocapa de grupos amino terminales de APS en LDH (APS / LDH) para CO 2 capturar. Se encontró que el espaciamiento de capas agrandado formado por columnas de dodecilsulfonato era beneficioso para la introducción de APS. APS se unió a los laminados de LDH mediante interacción covalente. Los grupos amino incorporados contribuyeron mucho al CO 2 captura de APS / LDH tanto a través del mecanismo de iones híbridos como de enlace débil, como lo confirman los resultados de DRIFTS. El CO 2 La capacidad de adsorción se estabilizó en aproximadamente 90 mg / g durante los cinco ciclos de adsorción-desorción, mostrando un gran potencial de aplicación en los procesos de adsorción por cambios de temperatura.
Para los adsorbentes de óxidos basados en LDH, el CO 2 reducido gradualmente La captación se pudo observar principalmente debido a la creciente falta de disponibilidad de los sitios básicos. Sin embargo, los APS / LDH son más resistentes a una variedad de condiciones de tratamiento, ya que se basan en la combinación química de (3-aminopropil) trietoxisilano y las capas metálicas. Esto previene eficazmente la pérdida significativa de capacidad de adsorción debido a la lixiviación orgánica de los sólidos durante la prueba cíclica. Y el CO 2 capturado podría desorberse completamente por debajo de 120 ° C en APS / LDH, que es una temperatura de operación bastante segura para evitar la degradación de la amina o la alteración de la conformación térmica.
Abreviaturas
- APS:
-
(3-aminopropil) trietoxisilano
- DRIFTS:
-
Espectroscopía infrarroja de reflectancia difusa por transformada de Fourier
- DS:
-
Dodecil sulfato
- EA:
-
Análisis elemental
- FTIR:
-
Espectrómetro infrarrojo de reflectancia por transformada de Fourier
- HMS:
-
Sílice mesoporosa hexagonal
- LDH:
-
Hidróxidos dobles en capas
- TEM:
-
Microscopía electrónica de transmisión
- TG-DTG:
-
Curva derivada de análisis termogravimétrico de TG
- XRD:
-
Difracción de rayos X
Nanomateriales
- Nuevo documento técnico de OMP:un análisis profundo de las decisiones basadas en datos
- ¿Introduciendo nueva tecnología en el lugar de trabajo? Esto es lo que necesita saber
- El grafeno pone los nanomateriales en su lugar
- Wittmann Battenfeld se muda a una nueva ubicación en Brasil
- Nuevo dispositivo flexible puede transformar señales WiFi en electricidad
- La nueva IA puede transformar imágenes fijas en animaciones 3D
- El nuevo método puede convertir cualquier objeto en una unidad de almacenamiento de datos
- Logotipo y proyecto de sitio web lanza una nueva barra flotante en aguas rentables
- IIoT da nueva vida a la fábrica de aire acondicionado
- Oliver Wyman:Información sobre la fábrica del futuro
- Soluciones de corte inteligente se muda a una nueva ubicación



